Дж.Р.Портманс
1 Лаборатория по биометрия и спортно хранене, Факултет по двигателни науки, Свободен университет в Брюксел, Брюксел, Белгия
А. Карпентие
1 Лаборатория по биометрия и спортно хранене, Факултет по двигателни науки, Свободен университет в Брюксел, Брюксел, Белгия
L.O. Перейра-Ланча
2 Departamento de Nutrição, Instituto Vita, São Paulo, SP, Бразилия
А. Ланча, младши.
3 Laboratório de Nutrição Aplicada à Atividade Motora, Escola de Educação Física e Esporte, Universidade de São Paulo, São Paulo, SP, Бразилия
Резюме
Общ изглед на метаболизма на протеините
При хората телесната протеинова маса осигурява архитектурна подкрепа, ензими за катализиране на метаболитните реакции, сигнализиране на междинни продукти в и между клетъчните тъкани и гориво за подпомагане на оцеляването при екстремни ситуации. Скелетните мускули са основният депозит на протеинови молекули (около 40% от телесното тегло при млади мъже с индекс на телесна маса 20-22) и близо 60% от общия телесен протеин при хората. Други органи или тъкани съдържат протеин, като черния дроб, който синтезира плазмени протеини (включително албумин, който представлява близо 50% от чернодробните протеини), имунни клетки (главно левкоцити), храносмилателни ензими, кост и дермален колаген (1). За всяка клетка или тъкан белтъчният баланс отразява нетния протеинов синтез и разграждането на протеините, които се различават значително между тъканите и органите и между клетъчните отделения.
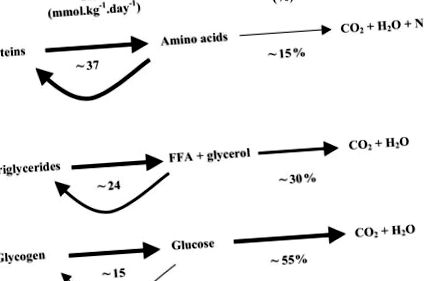
Тъй като няма резерв за съхранение на протеини, човешкото тяло е изправено пред деликатен и динамичен баланс, който поддържа хомеостазата в присъствието на екологични предизвикателства. В условия на покой, измерванията в стационарно състояние на оборота на гориво при постабсорбционни хора показват уникална ситуация, при която в сравнение с въглехидратите и триглицеридите протеините имат най-бързата скорост на оборот и най-ниската степен на окисление (Фигура 1) (2).
Катаболни реакции и окисление
Черният дроб и в по-малка степен бъбреците са основните места на метаболизма на аминокиселините при хората. Когато бозайниците поглъщат излишни протеини, количествата аминокиселини, по-големи от необходимите за синтеза на протеини и други азотни съединения, не могат да се съхраняват или отделят и излишъкът се окислява или превръща във въглехидрати и липиди. По време на разграждането на аминокиселината, а-амино групата се отстранява и полученият въглероден скелет се превръща в основен метаболитен междинен продукт. По-голямата част от въглеродния скелет от аминокиселини се метаболизира в пируват, ацетил-КоА или едно от междинните съединения на цикъла на трикарбоксилната киселина (3).
Загубата на α-амино групата става чрез окислително дезаминиране (с помощта на ензима глутамат дехидрогеназа) и трансдезаминиране (с използване на няколко аминотрансферази и глутамат дехидрогеназа). Повечето от аминокиселините могат да бъдат превърнати в съответните им оксокиселини чрез реакции с аминотрансферази (наричани още трансаминази). Всички аминокиселини с изключение на две (лизин и треонин) изглежда могат да бъдат трансаминирани, въпреки че не винаги е ясно колко голяма роля играят тези реакции в нормалното разграждане на аминокиселините в черния дроб.
Реакциите, катализирани от аминотрансферазите (като се използва пиридоксал фосфат-витамин В6 като протезна група) и от глутамат дехидрогеназата (като се използват NAD + или NADP + като окислители) са близо до равновесие, така че да се осигурят 2-оксокиселини, като цялостният процес може да бъде лесно се обръщат и аминокиселините могат да бъдат синтезирани, както и разградени. Системата за почти равновесно трансдезаминиране осигурява лесен механизъм, при който концентрациите както на аминокиселините, така и на 2-оксокиселините се поддържат доста постоянни, въпреки вариациите в големината и посоката на метаболитния поток през тази система. Метаболизмът на аминокиселините, в допълнение към аденозина, генерира по-голямата част от амоняка. Междувременно повечето тъкани отделят азот главно като аланин или глутамин, за да буферират токсичността на амоняка. Първата реакция използва аминотрансфераза от глутамат към пируват, а втората реакция пренася самия амоняк в глутамат и се катализира от глутамин синтетаза.
Въпреки че голяма част от амоняка не произтича от катаболизъм в черния дроб, цикълът на уреята се случва изключително в чернодробната тъкан и изисква четири молекули "богат на енергия" фосфат за синтеза на една молекула карбамид. При хората до 90% от азота в урината е под формата на урея.
Изглежда, че цикълът на карбамида се регулира от неравновесни реакции, като първата реакция е стъпката на генериране на потока. Синтезът на фумарат от урейния цикъл е важен, тъй като той свързва урейния цикъл и цикъла на трикарбоксилната киселина. В това отношение фумарат, водещ до оксалоацетат, може да се превърне в глюкоза по пътя на глюконеогенезата.
Много клетки са способни да концентрират аминокиселини от извънклетъчната среда, но преди вътреклетъчния метаболизъм аминокиселините трябва да бъдат транспортирани през клетъчната мембрана. Този транспорт се медиира от специфични аминокиселинни транспортери, протеини, които разпознават, свързват и транспортират тези аминокиселини от извънклетъчната среда в клетката или обратно.
Скелетните мускули, червата и черният дроб са особено важни за изхвърлянето на излишните аминокиселини. Голяма част от азота се насочва само в няколко съединения за транспорт между тъканите (главно аланин и глутамин). Отлагането на свободни аминокиселини в мускулите често представлява цели 80% от общото количество в цялото тяло. За разлика от това, плазмата съдържа много малък дял от общия аминокиселинен пул, вариращ от 0,2 до 6% за отделните аминокиселини.
Изчислено е, че свободният от мускули аминокиселини при нормален мъж с тегло 70 kg е около 86,5 g, с изключение на таурин и 121,5 g, включително таурин (3). Последното съединение се синтезира от цистеин и тауринът се екскретира като такъв или под формата на таурохолат или сродни жлъчни соли. В мускулните тъкани на бозайници тауринът действа като мембранен стабилизатор и модулатор на капацитета за съхранение на Ca 2+ на саркоплазматичния ретикулум. От общия набор от свободни аминокиселини в човешкия скелетен мускул, осемте незаменими аминокиселини (EAA) представляват само 8,4%, докато глутаминът, глутаматът и аланинът представляват близо 79%. Сред аминокиселините аминокиселините с разклонена верига (левцин, изолевцин и валин) представляват особен интерес, тъй като 60% от общото разпределение на специфични ензими, необходими за тяхното окисление (α-кетокиселинни дехидрогенази) при хората, се намира в скелета мускул. Тези аминокиселини, за разлика от повечето други, се поемат от набраздените мускули след хранене и частично се окисляват в тези тъкани. В периода на абсорбция на глад, мускулът на човешкия крак по същество освобождава аланин и глутамин (60% от общото освобождаване).
Окисляването на аминокиселини в мускулите води до значително количество генериране на АТФ. Ако приемем общ състав на аминокиселините в мускулите, общият баланс на разграждането на аминокиселините е: 1 mol аминокиселини + 5 mol O2 → 0.70 mol карбамид + 4.11 mol CO2 + 0.34 mol SO4 2− + 22.19 mol ATP. Това уравнение също така гласи, че около 0,4 mol еквивалент глюкоза може да се образува в черния дроб или 72 g от 110 g смесени аминокиселини. Пълното окисление на левцин, изолевцин и валин дава съответно 43, 42 и 32 mol АТР за молекула аминокиселина. Съотношението P/O обаче е само 2,4 в сравнение с 2,8 за мазнините и 3,1 за гликогена; по този начин аминокиселините не са добро гориво за производство на максимална мощност.
Понастоящем е доста трудно точно да се оцени енергийният баланс от ежедневното снабдяване с аминокиселини в мускулната тъкан, особено при хората. Въпреки това, ~ 90% от азота, получен от аминокиселините с разклонена верига (BCAA), се освобождава като глутамин и само ~ 10% като аланин. Jungas et al. (4) изчислява нетния баланс на АТФ и киселинно-алкалния баланс, свързан с окисляването на аминокиселините в скелетните мускули и заключава, че при условия на покой общото АТФ-равновесие възлиза на ∼4,5 mol излишък на АТФ на ден, или около 50% от общото окисление от аминокиселини в мускулите, тънките черва, бъбреците и черния дроб, взети заедно. Отново това подчертава значението на мускулната маса в енергийния баланс на целия организъм. Нетният ефект от окисляването на аминокиселини до глюкоза в черния дроб е да направи близо две трети от общата енергия, налична от окислението на аминокиселините, достъпна за периферните тъкани.
Методология за изследване на белтъчния оборот
Нашето научно наследство в изследването на белтъчния метаболизъм започва с Блек (1756) и Ръдърфорд (1772), които наблюдават отделянето на CO2 и NH3 съответно в животински тъкани. Оттогава метаболитните промени, предизвикани от прием на протеин, са широко проучени. Понастоящем методологичните подходи се основават на разреждането на изотопния индикатор и прилагането му за изчисляване на синтеза и обмена на протеини на цялото тяло и тъканите.
Бозайниковите организми използват значително количество енергия в основното или стандартното състояние, когато не се извършва нетна работа и цялата свободна енергия се разсейва. Протеините, полимерите на аминокиселините, се разграждат непрекъснато (катаболизъм) и се обновяват (анаболизъм) чрез многобройни и сложни метаболитни процеси. Стандартната скорост на метаболизма може да бъде дефинирана като стационарна скорост на производство на топлина от целия организъм при „стандартни“ условия (буден и в покой).
Директното измерване на протеиновия синтез може да предостави подходяща информация относно метаболитното състояние на отделните тъкани. Методите за директно включване, използващи проследяващи молекули, са използвани за измерване на синтеза на специфични протеини. Основният метод е да се осигури известно количество маркирано съединение (индикатор), което да се смеси с ендогенния пул от аминокиселини, който трябва да бъде включен в протеина с течение на времето. Няколко техники, както неинвазивни, така и инвазивни, са използвани за анализ на синтеза и разграждането на човешки протеин по време и след тренировка.
Неинвазивни техники
2 H2O приложение. Обозначена вода се прилага орално на субектите (около 5 ml/kg телесно тегло) (5). Ди-деутеро-белязаната вода бързо се дисоциира, за да се получи моноизотопно белязана вода (2 HHO), а равновесието на 2 H-белязана вода с различни аминокиселини води до генерирането на единично белязани съединения. Уникалността на използването на 2 H2O е, че за разлика от аминокиселините, които трябва да получат влизане в клетките чрез транспортери, 2 H-маркирането се случва вътреклетъчно (Фигура 2) (5).
- Опростени диетични ефекти на остро изчерпване на триптофан от нова аминокиселинна смес върху
- Безплатни пълноценни хранителни протеини и аминокиселини във вегетарианските диети - преглед
- Лишаването от хранителни вещества убива раковите клетки на бъбреците. Прекъсването на аминокиселината предизвиква клетъчна смърт в
- Нуждаете се от протеин Ето 9 аминокиселини, открити изобилно в растенията - една зелена планета
- Препоръки за изисквания за хранене - Програма за грижа за деца и възрастни - рафт NCBI