Резюме
Въведение
Предлага се оптимално хранене за пациенти в интензивно лечение да бъде осигуряването на енергия, определена от индиректната калориметрия, и осигуряването на протеини от най-малко 1,2 g/kg тегло преди приемане на ден. Доказателствата в подкрепа на тези хранителни цели се основават на сурогатни резултати и все още не са обосновани от ориентирани към пациента, клинично значими крайни точки. В настоящото проучване ние оценихме ефектите от постигането на оптимално хранене при пациенти с интензивно отделение по време на техния период на механична вентилация върху смъртността.
Методи
Това беше проспективно наблюдателно кохортно проучване в смесено медицинско-хирургично отделение за интензивно лечение с 28 легла в академична болница. 243 последователни смесени медицински хирургични пациенти са били записани на 3–5 ден след приема, ако са имали очакван престой от поне още 5–7 дни. Те са били подложени на индиректна калориметрия като част от рутинните грижи. Храненето се ръководеше от резултата от индиректната калориметрия и ние се стремихме да осигурим поне 1,2 g протеин/kg/ден. Изчислени са кумулативни баланси за периода на механична вентилация. Резултатните параметри бяха интензивно отделение, 28-дневна и болнична смъртност.
Резултати
При жените, когато се коригира за тегло, ръст, оценка на Apache II, категория на диагнозата и хипергликемичен индекс, пациентите, които са постигнали своите хранителни цели в сравнение с тези, които не са показали коефициент на риск (HR) от 0,199 за интензивна смъртност (CI 0,048– 0,831; P = 0,027), HR от 0,079 за 28-дневна смъртност (CI 0,013–0,467; P = 0,005) и HR от 0,328 за болнична смъртност (CI 0,113–0,952; P = 0,04). Постигането на енергийни цели, макар и непостигане на белтъчни цели, не повлиява смъртността на интензивното отделение; HR за 28-дневна смъртност е 0,120 (CI 0,027–0,528; P = 0,005) и 0,318 за болнична смъртност (CI 0,107–0,945; P = 0,039). Не е установена разлика в резултата, свързана с оптималното хранене при мъжете.
Заключения
Оптималната хранителна терапия подобрява интензивното отделение, 28-дневната и болничната преживяемост при пациенти с интензивно отделение Пациентите, които постигат както енергийни, така и протеинови цели, имат по-добри резултати от тези, които достигат само енергийната цел. В настоящото проучване мъжете не са се възползвали от оптималното хранене.
Въведение
Храненето е неразделна и важна част от терапията в интензивното отделение. Хранителната терапия има за цел запазване или възстановяване на телесната протеинова маса и осигуряване на адекватни количества енергия. На хипотетична основа, сурогатните маркери за оптимално хранене по отношение на осигуряването на енергия и протеини предлагат доставката на енергия, измерена чрез индиректна калориметрия, и осигуряване на 1,2 до 1,5 g протеин на kg тегло преди прием за критично болни пациенти [1]. Доказано е, че неадекватното осигуряване на енергия корелира с появата на усложнения, като синдром на дихателен дистрес при възрастни, инфекции, бъбречна недостатъчност, рани под налягане и необходимост от операция [2, 3]. Наскоро Anbar и колеги [4] предоставиха предварителни доказателства в група от 50 пациенти с очакван престой на интензивно отделение повече от три дни, че осигуряването на енергия съгласно индиректната калориметрия доведе до кумулативни положителни енергийни баланси, докато контролната група (насочена към 25 kcal/kg) имаше отрицателен кумулативен енергиен баланс; болничната заболеваемост и болничната смъртност са намалели в интервенционната група.
Изследванията, насочени към подобряване на хранителната подкрепа чрез прилагане на базирани на доказателства алгоритми, не успяха да покажат значителни положителни ефекти върху оцеляването, но хранителните цели, предложени за сурогатните маркери за оптимално хранене, не бяха постигнати [5–7]. Липсата на констатации за клинично значими ефекти от хранителната терапия в по-ранни проучвания може по този начин да се обясни с недостатъчно осигуряване на енергия и протеини.
В настоящото изследване анализираме ефектите от достигане на енергийно осигуряване, ръководено от индиректна калориметрия и осигуряване на най-малко 1,2 g/kg телесно тегло преди приемане. Търсихме ефект на оптималното хранене върху смъртността като параметър на резултата.
Материали и методи
Проучването е проведено в бъдеще при група от смесени медицински хирургични пациенти във висша университетска болница. Според насоките на Американската асоциация за респираторни грижи (AARC) [8] ние избрахме пациенти, които се нуждаят от дългосрочни остри грижи, пациенти с известен или подозиран хранителен дефицит и подгрупи с хранителни и стресови фактори, които могат значително да изкривят прогнозата от Уравнение на Харис-Бенедикт. Пациентите с дългосрочни остри грижи бяха включени, ако на три до пет дни (времето на индиректната калориметрия) предвидимият период на изкуствено хранене беше поне още пет до седем дни; ако възрастта е над 18 години и ако това е първото постъпване в интензивното отделение по време на болничния престой. Ограничаващи фактори за включване бяха: фракция на вдъхновен кислород над 0,6, изтичане на въздух през маншетите и/или дренажите на гърдите, ограничена наличност поради използването на метаболитния монитор или на двамата интензивисти, извършили измерванията, обслужване/отстраняване на дефекти на наличен само метаболитен монитор и спиране на лечението поради лоша прогноза.
Изследването е одобрено от комисията по етика на Медицинския център на Университета VU. Необходимостта от информирано съгласие беше отказана, тъй като не бяха включени никакви допълнителни процедури освен обичайната интензивна практика и данните, използвани в това проучване, трябваше да бъдат събрани за клинични цели. Холандското законодателство не изисква информирано съгласие за такова лечение и събиране на данни на базата на клиничен протокол, при условие че резултатите са анонимни.
Нашият хранителен протокол е насочен към ранно ентерално хранене, започвайки в рамките на 24 часа след приемането [вж. Допълнителен файл с данни 1]. Изборът за изчисляване на енергийния разход в покой (REE) като Харис-Бенедикт по време на 1.2 произхожда от препоръката на Александър и колегите му [9], където действителните REE се сравняват с формулите, използвани в интензивното отделение. Също така насоките на AARC използват уравнението на Харис-Бенедикт. Допълнителните 10% за активност произхождат от проучване на ван Ланшот и колеги [10], където са извършени 24-часови индиректни калориметрични измервания за определяне на общите енергийни разходи (TEE).
По този начин енергийната цел се определя от уравнението на Харис-Бенедикт 1984 плюс 30%, докато се извърши индиректна калориметрия [11]. Индиректните калориметрични измервания се извършват като част от рутинните грижи, обикновено между третия и петия ден след приема, съгласно насоките на AARC [8].
След измерването, калоричната цел беше определена на измерената REE плюс 10% за активност и храненето беше коригирано, за да отговори на новата калорична цел. Повторни измервания бяха извършени, когато са клинично показани, съгласно насоките на AARC. Предоставянето на калории е съобразено с най-новите калориметрични измервания. Протеинът беше снабден с цел от 1,2 до 1,5 g/kg телесно тегло преди приемане. Според холандските насоки за осигуряване на протеини, пациентите с ИТМ над 30 kg/m 2 се коригират за наднормено тегло, за да се изчисли тяхната нужда от протеин; ИТМ от 27,5 kg/m 2 е използван за изчисляване на съответното тегло и необходимото количество протеин/kg/ден [12].
За да постигнем както енергийни, така и белтъчни цели, използвахме алгоритъм за ентерално хранене, който определя хранителната формула и количеството, което трябва да се даде, за да отговори на двете изисквания [13]. Използваните ентерални хранителни формули са: Nutrison standard ® (1000 kcal и 40 g протеин на 1000 ml); Nutrison protein plus ® (1250 kcal и 63 g протеин на 1000 ml; и двата от Numico, Zoetermeer, Холандия); и Promote ® (1000 kcal и 63 g протеин на 1000 ml; от Abbott Nutrition, Hoofddorp, Холандия). Парентерално хранене през периода на проучването първоначално се осигурява от нашата аптека като разтвор „всичко в едно“, съдържащ 1000 kcal и 47 g протеин на литър, а по-късно се използва търговски продукт (Struktokabiven, Fresenius-Kabi AG, Bad Homburg vd H, Германия), съдържащ 1050 kcal и 50 g протеин на литър.
Данните от непреки калориметрични измервания са въведени в нашата система за управление на данни (Metavision ®, IMD-soft, Тел-Авив, Израел) от август 2004 г. и включването започва от тази дата. Извличането на данни беше извършено през март 2006 г. REE беше измерен с калориметър (Deltatrac ™ MBM-100 Metabolic Monitor, Datex-Engstrom Division, Instrumentation Corp. Helsinki, Финландия), свързан с вентилатора при пациенти с механична вентилация. Измерванията бяха извършени за период от 1 до 1,5 часа в условия на покой, след калибриране на устройството.
За всяка възраст на пациента (години), пол, тегло (kg) и ръст (cm), BMI (kg/m 2), остра физиология и оценка на хроничното здраве (APACHE) II, група за диагностика, продължителност на престоя в отделението за интензивно лечение ( ICU-LOS), продължителност на вентилация (LOV), изчислена TEE (Harris-Benedict 1984 плюс 30%), измерена REE, от която TEE е изчислена като REE плюс 10%, дневен прием на енергия и протеини от всички източници, но през устата през периодът на механична вентилация и всички стойности на глюкозата в кръвта по време на периода на прием в интензивното отделение са записани. Данните за ICU-LOS и данните за смъртността, които не могат да бъдат извлечени от местната база данни на ICU, бяха извлечени от болничната информационна система. За всеки отделен пациент вероятността от смърт се изчислява от APACHE рейтинга, от който се изчислява стандартизираното съотношение на смъртността за групите [14].
За тегло и ръст на пациентите използвахме данните преди прием, получени от амбулаторната клиника за предварителна оценка, от по-ранни измервания, направени по време на приема, или от данни, получени в други здравни заведения. В противен случай роднините или по възможност пациентът бяха помолени да предоставят тези данни. Ако тези данни не могат да бъдат извлечени, теглото се изчислява и височината се измерва или изчислява от един от двамата опитни интензивисти, извършили косвените калориметрични измервания.
Хранителни данни и изчисления
Определянето на адекватността на гликемичния контрол се извършва чрез изчисляване на хипергликемичния индекс (HGI) в mmol/L на пациент през целия период на интензивно отделение. Средният брой проби от глюкоза на пациент в нашата единица е 6,2 на ден. HGI се определя като площта под кривата над горната граница на нормата (ниво на глюкоза 6,0 mmol/l), разделена на общия ICU-LOS [15].
Променливите на резултата са смърт от каквато и да е причина в интензивното отделение, 28-дневна смъртност и болнична смъртност.
Статистически анализ
Описателните данни се отчитат като средно и стандартно отклонение, медиана и обхват или като честота и процент.
Регресионен анализ на Cox с LOS на болницата като времева променлива, ICU, 28-дневна и болнична смъртност като променливи на резултата и постигната хранителна цел (да/не), постигната енергийна цел (да/не) и постигната цел на протеина (да/не) като независими променливи. Тъй като беше установено, че полът е съществен модификатор на ефекта, данните бяха анализирани поотделно за мъже и жени. Всички представени съотношения на риск (HR) бяха коригирани за тегло, височина, APACHE II резултат, категория на диагнозата и HGI. SPSS 14 (SPSS Inc., Чикаго, IL, САЩ) е използван за статистически анализ. A P
Резултати
Двеста четиридесет и три последователни пациенти изпълниха критериите за включване. От тях 184 пациенти са били хранени изключително с ентерално хранене, четирима пациенти са били хранени изключително с парентерално хранене и 55 пациенти са получавали ентерално и парентерално хранене през периода на механична вентилация. Формулата на Харис-Бенедикт преди непрякото калориметрично измерване е подценявана с 13,2% с по-малко от 10%, 70,4% от оценките е била в рамките на +/- 10% и при 16,5% надценена с повече от 10%; пристрастие от + 0,9% прави прогнозата приемлива за група. Въпреки това, прогнозата може силно да се отклонява от индиректната калориметрична стойност за отделни пациенти с максимална отрицателна грешка от 23,8% и максимална положителна грешка от 38,8%. Средната продължителност между приема и непряката калориметрия е била шест дни.
Според постигането на кумулативните хранителни цели пациентите са били поставени в една от четирите групи. Демографските, клиничните и хранителните данни са представени в Таблица 1 и Таблица 2 поотделно за мъже и жени. Жените постигат хранителни цели по-често от мъжете (34/102; 33,3% срещу 25/141; 17,7%).
Резултатите от статистическия анализ са представени в Таблица 3. Регресионният анализ на Кокс не показва значими ефекти от постигането на хранителни цели върху смъртността при мъжете.
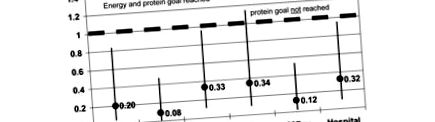
За женската част от населението HRs за интензивно отделение, 28-дневна и болнична смъртност са значително по-ниски за групата, която е постигнала както енергийни, така и белтъчни цели, в сравнение с групата, която не е постигнала и двете цели. Най-силните ефекти са наблюдавани върху 28-дневната смъртност (HR = 0,079; доверителен интервал (CI) = 0,013 до 0,467; P = 0,005). Ефектите от постигането както на енергийни, така и на протеинови цели са по-очевидни, отколкото когато се постигне само енергийната цел (Фигура 1). В последния случай HR за смъртността на интензивното отделение не достигна значение. HRs за болнична смъртност обаче са еквивалентни между тези две групи.
Коефициенти на риск за жените според постигнатата енергийна цел и постигнатата цел на протеините или не. ICU = отделение за интензивно лечение.
Таблица 3 също така показва резултатите за сравнение на групите, които са постигнали целта на протеина или не, независимо от енергийната цел, и резултатите от постигането на енергийната цел или не, независимо от целта на протеина. Анализът на стандартизираното съотношение на смъртността по групи с хранителни цели и по пол показва ниска прогнозирана/наблюдавана смъртност за жени, които са постигнали както енергийната, така и протеиновата цел, но при мъжете този ефект липсва.
Дискусия
Постигането на хранителни цели, в това проучване, дефинирано като доставка на енергия с минимум 90% от измерената REE плюс 10% и осигуряване на протеини от най-малко 1,2 g/kg телесно тегло преди приемане през периода на механична вентилация, води до 80 % намален шанс за смърт в реанимацията и 92% намалена 28-дневна смъртност, докато болничната смъртност е 67% по-ниска в сравнение с пациентите, които не достигат горепосочените хранителни цели. Тези ефекти се проявяват само при женската част от популацията на интензивното отделение. При мъжете не могат да бъдат открити статистически значими ефекти от храненето върху резултата.
Постигането само на енергийната цел и непостигането на 1,2 g протеин/ден при жените води до по-неблагоприятни резултати, отколкото когато се постигнат както енергийни, така и протеинови цели. Шансът да умре в интензивното отделение не се влияе от постигането само на енергийната цел, но все още има намален шанс за смърт от 88% на 28 дни и 68% намаление на болничната смъртност.
Жените имат по-ниско телесно тегло като група и по този начин по-малко енергийни разходи от мъжете. Тъй като прилагането на обема на формули за ентерално хранене е ограничаващ фактор в началото на хранителната терапия, жените са по-склонни да постигнат своите хранителни цели.
Енергийният дефицит се проявява особено в първите дни след приема, когато целевият обем не може да се приложи поради задържане, бавно увеличаване на хранителния обем към целевия обем, хемодинамична нестабилност и диагностични и терапевтични интервенции.
Наскоро Pichard и колеги [16] демонстрираха, че осигуряването на повече от 1500 kcal/ден през първите три дни от приема, освен парентерална глюкоза, намалява смъртността на интензивното отделение и смъртността в болницата. Ранното осигуряване на енергия намалява кумулативния калориен дефицит.
Доколкото ни е известно, нашето проучване е първото, в което са демонстрирани благоприятни ефекти както на енергийното, така и на протеиновото осигуряване върху смъртността при критично болни пациенти.
По този начин е правдоподобно, че разликите в дизайна на изследванията, броя на включените пациенти, различни дефиниции за хранителни цели и анализи на ниво група, вместо анализи на ниво отделни пациенти, отчитат различните ефекти на храненето върху смъртността.
Нашето проучване има ограничения. Това е наблюдателно проучване. Нито е установен телесният състав, нито са извършени азотни баланси, така че хипотезираната корелация между нетната загуба на протеин и смъртността не може да бъде обоснована. Както при подобни проучвания, теглото преди приемане не е било точно известно за всички пациенти. Въпреки че при статистическия анализ коригирахме за тегло, ръст, APACHE-II, диагнозна група и гликемичен контрол, възможно е други фактори да са повлияли на смъртността. Въпреки че хипотезата за оптимално хранене не взема предвид пола, бихме могли да демонстрираме само ефект върху смъртността при жените. Освен това препоръките за количеството енергия и протеини при критично болни пациенти произхождат от ограничен брой проучвания и може да се окажат недостатъчно съобразени с индивидуалните нужди на толкова разнообразна популация [19–22].
Заключения
В заключение, основната констатация на нашето проучване е, че постигането както на енергийна цел, ръководена от индиректна калориметрия, така и на осигуряване на протеин в количество от най-малко 1,2 g/kg телесно тегло преди приемане по време на изкуственото хранене, докато се проветрява механично, намалява ОИТ, 28-дневна и болнична смъртност при женската част от населението. Благоприятният ефект при жените върху смъртността на интензивното отделение не може да бъде демонстриран за тези, които са постигнали енергийната цел, но не са успели да постигнат 1,2 g протеин/kg/ден. За мъжете не може да бъде доказано благоприятно въздействие върху смъртността от постигането на тези хранителни цели през периода на изкуствена вентилация.
Въпреки че нашите открития трябва да бъдат потвърдени от други, ние твърдим, че наблюдаваните полезни ефекти от храненето при жените са толкова изразени, че трябва да се положат крайни усилия за осигуряване на адекватно осигуряване както на енергия, така и на протеини. Необходими са допълнителни изследвания, за да се изяснят основните механизми, които да обяснят връзката между храненето, пола и смъртността при пациентите на интензивно отделение.
Ключови съобщения
Оптималното хранене за пациенти в интензивно лечение може да се определи като осигуряване на енергия в действителност и протеин в количество от 1,2 до 1,5 g/kg телесно тегло преди заболяване/ден.
Досега целите на оптималното хранене бяха заместващи крайни точки; това проучване показва, че за дългосрочните остри грижи на пациентите от женски пол, оптималното хранене влияе върху клинично значимите резултати.
Пациентите, които постигат своите енергийни и протеинови цели, имат значително по-ниска интензивна интензивност, 28 дневна и болнична смъртност в сравнение с тези, които не достигат тези цели.
При дългосрочните остри грижи за пациентите от женски пол постигането както на енергийни, така и на протеинови цели е по-изгодно от постигането само на енергийната цел: в последния случай смъртността на интензивното отделение не се засяга и ефектът върху 28-дневната смъртност е по-малко очевиден, което предполага, че благоприятният ефект от постигането на целта на протеините е особено важен в ранната фаза на критично заболяване.
В настоящото проучване полезните ефекти на оптималното хранене не могат да бъдат демонстрирани при мъжката част от нашето население.
Съкращения
Американска асоциация за дихателни грижи
остра физиология и оценка на хроничното здраве
- Оптимална диета и хранене за футболисти
- Супер хранене за бебета Правилният начин да нахраните бебето си за оптимално здраве от Катрин Ерлих
- Оптимално хранително програмиране и коучинг; Метаболитни разтвори
- Периодизация на храненето за спортисти за издръжливост и енергия Оптимално хранене за цял живот
- Прогресивна хранителна информация за храненето - диетични балансьори за коне