Рафаел М. Коста
1 Катедра по фармакология, Медицинско училище в Рибейрао Прето, Университет в Сао Пауло, Рибейрао Прето, Бразилия
Карла Б. Невес
2 Институт за сърдечно-съдови и медицински науки, Британска сърдечна фондация, Център за сърдечно-съдови изследвания в Глазгоу, Университет в Глазгоу, Глазгоу, Великобритания
Рита С. Тостес
1 Катедра по фармакология, Медицинско училище в Рибейрао Прето, Университет в Сао Пауло, Рибейрао Прето, Бразилия
Нубия С. Лобато
3 Институт по здравни науки, Федерален университет в Гояс, Джай, Бразилия
Резюме
Въведение
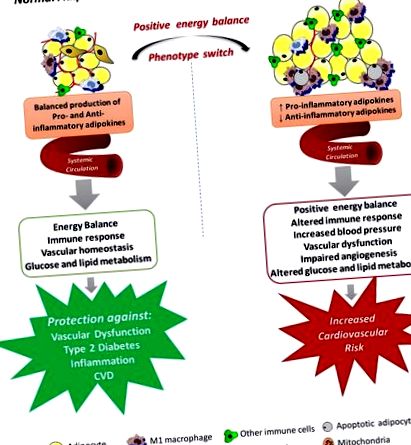
Затлъстяването е бързо нарастващ проблем, който достига епидемични размери в световен мащаб, засягащ както деца, така и възрастни (Ogden et al., 2016; Lim et al., 2017). Това състояние се определя като непропорционално телесно тегло за височина с прекомерно натрупване на мазнини, което често е придружено от леко, хронично, системно възпаление (Gonzalez-Muniesa et al., 2017). Има нововъзникващи научни, медицински и поведенчески данни, показващи, че централното отлагане на мастната тъкан е свързано с повишен риск от заболеваемост и смъртност поради няколко сърдечно-съдови усложнения, включително инсулт, застойна сърдечна недостатъчност, инфаркт на миокарда и сърдечно-съдова смърт и това е независима от връзката между затлъстяването и компонентите на метаболитния синдром и други сърдечно-съдови рискови фактори (Arnlöv et al., 2010; Williams et al., 2015). Предишна подкрепа за това разбиране беше предоставена от Американската сърдечна асоциация през 1998 г., която преквалифицира затлъстяването като основен, модифицируем рисков фактор за коронарна болест на сърцето (ИБС) (Eckel and Krauss, 1998).
Освен че се счита за най-големия енергиен резервоар в тялото, бялата мастна тъкан (WAT) е призната и за изключително сложен ендокринен орган, който произвежда и секретира няколко вещества с ендокринна, паракринна и автокринна функции, действайки като основен регулатор на системната енергийна хомеостаза (Rosen and Spiegelman, 2014). При затлъстяване мастната тъкан може да стане нефункционална и да не успее да се разшири по подходящ начин, за да съхранява излишната енергия. Това води до извънматочно отлагане на мазнини в други тъкани, които регулират метаболитната хомеостаза (Tchoukalova et al., 2010). Разширяването на WAT е свързано с множество местни последици, включително възпаление (Apovian et al., 2008), фиброза (Henegar et al., 2008), хипоксия (Jiang et al., 2011), нерегулирана секреция на адипокин (Jernås et al., 2006; Skurk et al., 2007) и нарушава митохондриалната функция (Heinonen et al., 2015). Последиците от цялото тяло на дисфункцията на WAT включват анормален глюкозен и липиден метаболизъм, инсулинова резистентност, повишаване на кръвното налягане, коагулация, фибринолиза, възпаление и ендотелна дисфункция, като всички те предоставят важни механизми, свързващи затлъстяването със сърдечно-съдови заболявания.
Затлъстяване и сърдечно-съдов риск
Механизми, чрез които системната дисфункция на мастната тъкан може да доведе до развитие на съдова дисфункция при затлъстяване. Мастната тъкан произвежда различни хемокини, цитокини и хормони, които се секретират в кръвоносната система и действат в няколко физиологични процеси, включително енергиен баланс, имунни отговори, кръвно налягане, съдова хомеостаза и ангиогенеза, глюкозен и липиден метаболизъм. Разширяването на мастната тъкан води до некротична и/или апоптотична клетъчна смърт и това е успоредно с инфилтрация на активирани макрофаги, повишено производство на провъзпалителни адипокини и реактивни кислородни видове, насърчаване на състоянието на системно активиране на ендотелните клетки и съдова дисфункция, всички което може да допринесе за повишения сърдечно-съдов риск, свързан със затлъстяването.
Ефекти на периваскуларната мастна тъкан върху съдовата функция
Структурните и физиологични характеристики на PVAT варират в зависимост от местоположението му. В мезентериалните артерии PVAT прилича на WAT, с по-малко диференцирани адипоцити, лоша васкуларизация, специфичен профил на производство/секреция на цитокини и съдържа инфилтрати на макрофаги, фибробласти и клетки на имунната система (Guzik et al., 2013). От друга страна, скорошни проучвания демонстрират, че PVAT на гръдната аорта проявява характеристики, които приличат на НДНТ, а не на WAT (Fitzgibbons et al., 2011; Chang et al., 2012), включително експресия на гени, силно или единствено изразени в BAT, наличието на многолокулни адипоцити и голямо изобилие от митохондрии. Подобно на НДНТ, PVAT се активира от студа и генерира топлина. Интересното е, че индуцираното от студа активиране на термогенезата при PVAT се придружава от затихване на атеросклеротичния процес при мишки с дефицит на аполипопротеин Е (ApoE -/-), докато такава защита се губи при мишки, при които PVAT липсва (Chang et al., 2012), което показва, че термогенните свойства на PVAT също медиират неговите съдови защитни ефекти.
Въпреки че не можем да разгледаме темата подробно в този ръкопис, важно е да се отбележи, че са описани много други механизми, участващи в индуцираните от PVRF антиконтрактилни ефекти. Lu и сътрудници, използвайки пръстени на долната куха вена при отсъствие и присъствие на PVAT и ендотел, установиха, че отстраняването на ендотел премахва PVAT антиконтрактилния отговор. Същата група изследователи предполага, че PVAT освобождава Ang 1–7, което, действайки върху рецепторите в ендотела, води до освобождаване на азотен оксид (NO) и активиране на Kv канали с последваща съдова релаксация (Lu et al., 2011) . PVRF може да действа и чрез независими от ендотел механизми, включващи производството на водороден пероксид (H2O2) и последващо активиране на гуанилил циклаза (sGC) (Gao et al., 2007).
Периваскуларна дисфункция на мастната тъкан като основен фактор, допринасящ за свързаната със затлъстяването съдова дисфункция
Периваскуларна дисфункция на мастната тъкан и свързана със затлъстяването съдова дисфункция. Периваскуларната мастна тъкан (PVAT) секретира голямо разнообразие от биологично активни молекули, включително адипокините, които модулират съдовия тонус, миграцията и пролиферацията на гладкомускулните клетки, неоинтималната хиперплазия, възпалителните реакции и оксидативния стрес. Затлъстяването е свързано със структурни и функционални промени в PVAT, което води до дисбаланс в полза на вазоконстрикторни и противовъзпалителни вещества, хипертрофия на адипоцитите, както и промени в инсулиновите сигнални пътища. SMC, гладка мускулна клетка; ROS, реактивни кислородни видове; НЕ, азотен оксид.
Митохондриалната електронно-транспортна верига (mETC), важен източник на ROS, също е посочена като интегрален компонент, замесен във физиологичната регулация на съдовата функция от PVAT. Наскоро показахме, че O2 - продукцията от mETC се увеличава в PVAT по време на индуцирана от норадреналина (NE) аортна мускулна контракция. O 2 - впоследствие се превръща в H2O2 от манганов SOD (Mn-SOD), който от своя страна модулира контракцията на VSMC (Costa et al., 2016). След тези констатации ние предоставихме недвусмислени доказателства, свързващи митохондриите с свързания с PVAT оксидативен стрес и последващата загуба на антиконтрактилните ефекти на PVAT, наблюдавани при експериментално затлъстяване (da Costa et al., 2017) При тези условия увеличаването на PVAT-медиираното генериране на ROS се превръща във важен признак на повишена съдова контракция. Тъй като PVAT има подобен фенотип на BAT, включително експресията на UCP-1, който е необходим за не трепереща термогенеза, както беше обсъдено по-горе, и като се има предвид, че локалният енергиен метаболизъм, предизвикан от промени в температурата, засяга съдовата функция и атерогенезата (Brown et al ., 2014), може да се предположи, че увеличеното производство на енергия в PVAT при затлъстяване също засяга биологията на съдовете, благоприятствайки развитието на ССЗ.
Тези констатации, в допълнение към наблюденията, че локалното натрупване на мастна тъкан е последователно свързано с намалена вазодилатация, медиирана от потока (Albu et al., 2005), нивата на инсулин на гладно и инсулиновата резистентност при хората (Rittig et al., 2008), подкрепят участието на PVAT-извлечени фактори като паракрин, а не ендокринни медиатори както на микроваскуларна дисфункция, така и на инсулинова резистентност при затлъстяване. Също така има огромна излишък по тези пътища, които подкрепят мнението, че връзката между PVAT и кардиометаболичните рискови фактори може да не е просто следствие от цялостното затлъстяване, а потенциално да представлява допълнителен рисков фактор. Като се има предвид, че хипергликемията и хиперинсулинемията могат също директно да увредят съдовата функция и съответно изхвърлянето на глюкоза, също така е възможно да се предложи порочен кръг на PVAT дисфункция, който допринася и се влошава от увреждането на хомеостазата на инсулина.
Възпаление в периваскуларната мастна тъкан: връзката между затлъстяването и сърдечно-съдовите заболявания?
Възпалението на PVAT може също да бъде свързано с променено освобождаване на адипокини и други релаксиращи фактори, получени от адипоцити (Antonopoulos et al., 2015; Woodward et al., 2017). Първоначалната подкрепа за това разбиране идва от констатациите, че периваскуларните адипоцити от хора и мишки без атеросклеротично заболяване показват повишено проинфламаторно състояние и намалена адипоцитна диференциация при основни условия в сравнение с адипоцити, получени от подкожни и висцерални мастни депа, и че храненето с високо съдържание на мазнини причинява по-нататъшно намаляване на свързаната с адипоцити генна експресия, докато повишава регулацията на проинфламаторната генна експресия (Chatterjee et al., 2009). По-конкретно, секрецията на противовъзпалителния адипокин адипонектин е значително намалена, докато тази на провоспалителните цитокини IL-6, IL-8 и MCP-1 е значително увеличена в периваскуларните адипоцити. Тези промени имат също директен ефект върху вазоактивните свойства на PVAT, както е доказано в проучвания с малки артерии върху животни и хора, където е доказано, че хипоксията и възпалението намаляват локалните вазоактивни свойства на PVAT чрез оксидативен стрес (Greenstein et al., 2009).
Взети заедно, тези открития не само осигуряват множество слоеве потенциални медиатори за възпалителния компонент на PVAT при затлъстяване, но също така ясно демонстрират, че двупосочните взаимодействия между това, че системното метаболитно възпаление и локалните имунни компоненти са критични съображения при определяне на свързаните физиологични и патологични съдови резултати със затлъстяване. Близостта на PVAT като богат източник на възпалителни цитокини и други медиатори, заедно със свързаните с тях промени в тази тъкан, подкрепят концепцията, че специфичните промени в местните депа на мастната тъкан допринасят за болестни процеси в съседната съдова стена.
Клинична мярка на периваскуларна мастна тъкан при свързана със затлъстяването оценка на сърдечно-съдовия риск: намиране на смисъла
Някои от първоначалните мисли и съображения за взаимната връзка между PVAT и рисковите фактори за ССЗ са предоставени от клинични находки, показващи връзка между периваскуларната и епикардната мастна тъкан с основните антропометрични и клинични параметри на метаболитния синдром (Iacobellis et al., 2003b). Всъщност се наблюдава много добра корелация между епикардната мастна тъкан, оценена чрез ехокардиография, и обиколката на талията, диастоличното кръвно налягане, плазмения инсулин на гладно, LDL холестерола и адипонектина в плазмата (Iacobellis et al., 2003b). Важно е, че връзката на инсулиновата чувствителност и ниските нива на адипонектин с дебелината на епикардната мазнина е независима от ИТМ, което предполага, че оценката на PVAT може да осигури по-чувствителна и по-специфична мярка за истинското съдържание на висцерални мазнини (Iacobellis et al., 2003a). В подкрепа на тези констатации, неотдавнашен мета-анализ на публикувани доклади стигна до заключението, че ехокардиографската дебелина на епикардиалната мастна тъкан е значително по-висока при пациенти с метаболитен синдром, отколкото при тези без него (Pierdomenico et al., 2013).
Обобщение
По-нататъшната дисекция на съдовите сигнални пътища, променени от PVAT-извлечени фактори, вероятно ще разкрие функционални стратегии за потискане на негативните ефекти от абнормен излишък на мастна тъкан върху усложненията на ССЗ, без да променя полезните ефекти на нормалните мастни депа. Останалите предизвикателства в тази област могат да бъдат идентифицирани в две различни области. Как структурните и функционални промени на PVAT започват при затлъстяването и в кой момент става вредно? Какви са подходящите моделни системи и пътища за изясняване на неизвестните механизми за предотвратяване или лечение на ССЗ при хора? Що се отнася до приноса на новите характеризирани адипокини, има и няколко интересни и нововъзникващи концепции. Предвид тези предизвикателства и необходимостта от терапевтични подходи, които не повлияват трайно цялостните физиологични ефекти на PVAT, предаването на експериментални прозрения в успешни клинични интервенции ще изисква съвместни и разнообразни кръстосани изследвания, нови експериментални подходи и интегриране на генетични вариации с други екологични модификатори за установяване на връзки със сложни сърдечно-съдови фенотипове и улесняване на успешния превод на човешко заболяване.
Авторски приноси
RC, KN, RT и NL еднакво допринесоха за концепцията за хартия, изготвяйки ръкописа и одобриха окончателната му версия.
Изявление за конфликт на интереси
Авторите декларират, че изследването е проведено при липса на каквито и да било търговски или финансови отношения, които биха могли да се тълкуват като потенциален конфликт на интереси.
- Затлъстяване, загуба на тегло и условни сърдечно-съдови рискови фактори - Tzotzas - 2011 - Прегледи на затлъстяването
- Резултати от затлъстяване и риск от инфекции на дихателните пътища от кохортно проучване, основано на дневник на инфекцията
- Платинени хапчета за отслабване - намалява риска от сърдечно-съдови заболявания RSP Nutrition Quadralean - St
- Затлъстяване, пиене; Нездравословна диета, която добавя към риска от подагра - ревматологът
- Затлъстяването повишава риска от рак на маточната шийка