Руй Юан
1 Катедра по фармакология, Фармацевтичен колеж, Университет Бейхуа, Дзилин 132013, Китай
Гуангрен Слънце
2 Департамент по хранителни науки, Лесотехнически колеж, Университет Бейхуа, Дзилин 132013, Китай
Джиаки Гао
1 Катедра по фармакология, Фармацевтичен колеж, Университет Бейхуа, Дзилин 132013, Китай
Зепенг Ю
1 Катедра по фармакология, Фармацевтичен колеж, Университет Бейхуа, Дзилин 132013, Китай
Чунян Ю
3 Катедра по патология, Медицински колеж, Университет Бейхуа, Дзилин 132013, Китай
Чунмей Уанг
1 Катедра по фармакология, Фармацевтичен колеж, Университет Бейхуа, Дзилин 132013, Китай
Jinghui Sun
1 Катедра по фармакология, Фармацевтичен колеж, Университет Бейхуа, Дзилин 132013, Китай
Той Ли
1 Катедра по фармакология, Фармацевтичен колеж, Университет Бейхуа, Дзилин 132013, Китай
Jianguang Chen
1 Катедра по фармакология, Фармацевтичен колеж, Университет Бейхуа, Дзилин 132013, Китай
Свързани данни
Данните, използвани в подкрепа на констатациите от това проучване, са включени в статията.
Резюме
1. Въведение
2. Материали и методи
2.1. Експериментални животни
Четиридесет мъжки плъхове SPF Wistar (210 g – 250 g) са закупени от Changchun Yisi Laboratory Animal Technology Co., Ltd. (Changchun, China; Номер на сертификата: SCXK (Ji) 2016-0003). Плъховете са хранени в продължение на 6 седмици в отделни клетки с добра вентилация, при постоянна температура (21–23 ° C), постоянна влажност (45% –65%) и при светли и тъмни цикли по 12 часа всяка. Експериментите с животни бяха одобрени от Институционалния комитет за грижи и употреба на животните (IACUC) на университета в Бейхуа с номера на разрешителното CPBHU IACUC2019-006 и всички експериментални процедури бяха проведени в съответствие с Насоките за етика и използване на лабораторните животни от университета в Бейхуа.
2.2. Инструменти
ELISA с пълна дължина на вълната (EPOCH, BIOTEX, САЩ); електронен баланс (LD310-2, Шенян, Китай); високоефективна течна хроматография (LC-2010A, SHIMADZU, Япония); хемилуминесцентна гел система за изображения (Surwit Technology Inc., Пекин, Китай); автоматичен биохимичен анализатор (Tecan Group, Швейцария); лабораторен рН метър (Metler-Toledo Instrument Co., Ltd., Китай); нискоскоростна центрофуга (Xinsheng Biotechnology Co., Ltd., Ningbo, China); оптичен микроскоп (OLYMPUS, Япония); Ултравиолетов видим спектрофотометър (Пекин Purkinje General Instrument Co., Ltd, Пекин, Китай).
2.3. Химикали и реактиви
Schisandra chinensis е получена от разсадната база Jian Schisandra в провинция Дзилин. SV (Schisandra Development and Industrialization Engineering Research Center на провинция Дзилин, Дзилин, Китай); Комплекти за откриване на TG, TC, FFA, HDL-C, LDL-C, AST, ALT, MDA и SOD (Институт по биоинженерство в Нанкин Jiancheng, Нанкин, Китай); заешки антитела срещу PPAR-α, ACOX1, CPT1, KEAP1, NRF2 и HO-1 (Abetclonal Company, Сан Франциско, САЩ); холестерол, натриев холат, калциев хидроген фосфат и казеин (Anhui Tianqi Chemical Technology Co., Ltd., Anhui, China); яйчен жълтък на прах (лаборатория за размножаване на животни в Нанкин Xiaolongshan, Нанкин, Китай); HFD, съдържащ 20% захароза, 15% свинска мас, 10% казеин, 2% холестерол, 0,6% калциев хидроген фосфат и 0,2% натриев холат; и нормална диета (Changchun Yisi Laboratory Animal Co., Ltd., Changchun, China).
2.4. Подготовка на SV
Сухият зрял плод на шизандра се изплаква с вода и се отцежда. След това чистите и изсушени плодове от шизандра се варят в пара за 1 час. На всеки 1 килограм варени плодове се добавя 1 мл пектиназа и се смесва с дестилирана вода в съотношение 1: 10 при 45 ° С в продължение на 1,5 часа, за да се получи сладко от шизандра. Първо, конфитюрът се превръща в плодово вино от шизандра чрез добавяне на 7% течност, активираща дрожди при 28 ° C за 3 дни. След това, плодовото вино от шизандра се коригира до алкохолност от 8% (V/V) и се инокулира с 6% разтвор на оцетна киселина бактерии с ферментационна вентилация от 0,15 L · min -1 при 30 ° C в продължение на 15 дни. Накрая плодовото вино се превръща в SV чрез оцетна киселинна ферментация. Този плодов оцет беше филтриран и стерилизиран за експериментална употреба.
2.5. Анализ на киселинността и компонентите на SV
Киселинността на SV се измерва с рН метър. Съдържанието на оцетна киселина се определя чрез киселинно-алкална неутрализация и титруване съгласно Фармакопеята на Китайската народна република. Съдържанието на полизахарид се измерва по метод фенол-сярна киселина. Съдържанието на шизандрин А се определя чрез високоефективна течна хроматография (HPLC) съгласно „Определяне на шизандрин А в здравословна храна на шизандра“ във Фармакопеята на Китайската народна република [8].
2.6. Експериментален протокол
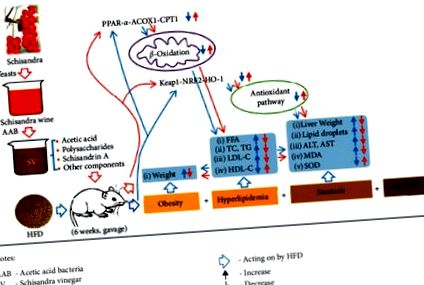
Както е показано на фигура 1, четиридесет мъжки плъхове SPF Wistar бяха произволно и равномерно разделени на пет групи, т.е. празна контролна група (CON, нормална диета, дестилирана вода), моделна група (MOD, HFD, дестилирана вода), ниско- доза SV група (SVL, HFD, 25% SV манипулация), средно дозирана SV група (SVM, HFD, 50% SV манипулация) и висока доза SV група (SVH, HFD, 100% SV манипулация), както е показано в Маса 1 . Всички плъхове са били подложени на съответно приложение в продължение на шест седмици и са претегляни веднъж седмично. След това плъховете бяха гладувани в продължение на 12 часа, но хранени с вода. И накрая, всички плъхове бяха анестезирани с етер и бяха събрани проби от кръв и черен дроб на коремната аорта за откриване или анализ на чернодробни тегла, хистологични промени в чернодробната тъкан, серумни биохимични показатели и относителни антиоксидационни протеини, включително PPAR-α, ACOX1, CPT1, KEAP1, NRF2 и HO-1.
Експериментален протокол. Оцет от шизандра (SV) се прилага чрез сонда на мъжки SPF плъхове Wistar на диета с високо съдържание на мазнини в продължение на 6 седмици. След това бяха измерени чернодробни тегла, хистологични промени в чернодробната тъкан, серумни биохимични показатели и относителни антиоксидационни протеини, включително PPAR-α, ACOX1, CPT1, KEAP1, NRF2 и HO-1.
- Краткосрочната нискокалорична диета ремоделира липидния профил на скелетните мускули и метаболитната генна експресия в
- Препоръчва се диета с наднормено тегло и диабет с ниско съдържание на въглехидрати и мазнини
- Напитката PRIME PubMed Kefir причинява значително, но подобно подобрение в серумния липиден профил,
- Замяната на вкусна диета с високо съдържание на мазнини с храна с ниско съдържание на мазнини причинява симптоми на отнемане при мишки -
- Профил от Sanford Diet Review