Резюме
Заден план
Затлъстяването е основен проблем в световен мащаб и сериозно засяга обществената безопасност. Като метаболит на чревната микробиота, ендогенната маслена киселина участва в енергийния и материалния метаболизъм. Имайки предвид сериозните странични ефекти и възстановяване на теглото, свързани със съществуващите интервенции за отслабване, спешно са необходими нови стратегии за профилактика и лечение на затлъстяването.
Резултати
В настоящото проучване ние проектирахме Bacillus subtilis SCK6 демонстрира засилено производство на маслена киселина. В сравнение с оригинала Bacillus subtilis Щам SCK6, генетично модифицираният щам BsS-RS06550 има по-високо производство на маслена киселина. Мишките бяха разделени на случаен принцип в четири групи: група с нормална диета (С), група с високо съдържание на мазнини (HFD), HFD + Bacillus subtilis SCK6 (HS) група и HFD + BsS-RS06550 (HE) група. Резултатите показаха, че BsS-RS06550 намалява телесното тегло, увеличаването на телесното тегло и приема на храна на HFD мишки. BsS-RS06550 имаше благоприятен ефект върху кръвната глюкоза, инсулиновата резистентност и чернодробната биохимия. След 14-седмичния експеримент се събират фекални проби за нецелеви анализ на течна хроматография-масспектрометрия, за да се идентифицират и определят количествено значимите промени в метаболитите. Бяха скринирани шестнадесет потенциално значими метаболити и беше показано, че BsS-RS06550 потенциално регулира нарушенията в метаболизма на глутатион, метионин, тирозин, фенилаланин и пурин и биосинтеза на вторични жлъчни киселини.
Заключения
В това проучване ние успешно проектирахме Bacillus subtilis SCK6 да има засилено производство на маслена киселина. Резултатите от тази работа разкриха, че генетично модифицираната жива бактерия BsS-RS06550 показва потенциални ефекти срещу затлъстяването, които може да са били свързани с регулирането на нивата на метаболити, свързани със затлъстяването. Тези резултати показват, че използването на BsS-RS06550 може да бъде обещаваща стратегия за отслабване на затлъстяването.
Заден план
Затлъстяването става широко разпространено в световен мащаб и поражда различни хронични заболявания, включително метаболитен синдром, диабет тип 2 и сърдечно-съдови заболявания [1, 2]. По този начин затлъстяването е голямо предизвикателство за общественото здраве, което поставя огромна икономическа тежест както за семействата, така и за обществото [3]. Освен това, разпространението на затлъстяването при юноши и възрастни разкрива спешната нужда от ефективни стратегии за лечение [4, 5].
Проучванията показват, че упражненията и диетичната намеса са ефективни начини за контрол и облекчаване на наддаването на тегло [6, 7]. Въпреки това е трудно да се поддържат дългосрочни упражнения или разумни и здравословни хранителни навици за повечето пациенти [8]. Медицинската терапия и хирургията също са възможности, въпреки че тези подходи също имат сериозни странични ефекти [9, 10]. Следователно са необходими нови подходи за смекчаване на затлъстяването.
Метаболитните нарушения са една от най-важните характеристики на затлъстяването, а метаболитите и метаболитните пътища са тясно свързани с появата и развитието на затлъстяването [11,12,13,14]. През последните години изследователите показаха, че като метаболити на чревната микробиота, късоверижните мастни киселини (SCFA) влияят върху физиологичните процеси на заболяването, като влияят на енергийното снабдяване и имунната регулация [15], особено маслената киселина (BA), която може да облекчи затлъстяване и инсулинова резистентност при мишки, хранени с високомаслена диета (HFD) [16]. В допълнение, BA може да намали апетита и да предотврати затлъстяването на черния дроб чрез невронната верига на червата и мозъка [17]. Нивата на BA и микробиотата, които го произвеждат, са значително намалени при затлъстели индивиди в сравнение със здрави индивиди, а снабдяването с BA може да бъде потенциална стратегия за лечение на затлъстяването [18, 19].
Понастоящем пероралният бутират е често използвана добавка BA, но има ниска бионаличност. В допълнение, повечето микробиоти, произвеждащи BA, са анаеробни бактерии, които могат да ограничат производствения капацитет на BA, особено при обсебени индивиди [20]. Пробиотиците обикновено се използват като носители на лекарства [21, 22]. Bacillus subtilis (B. subtilis) е хранителен пробиотик с ясен генетичен произход и също е използван като добавка за животни за подобряване на растежа и имунитета [23]. Генетично модифицираните пробиотици все повече се използват като терапевтични средства за лечение на затлъстяване [24, 25]. В настоящото изследване, B. subtilis SCK6 (SCK6) е генетично модифициран, за да подобри производството на BA. Целта на това проучване е да изследва потенциалната превенция на генетично модифицираните Bacillus subtilis Щам SCK6 (BsS-RS06550) при мишки, хранени с HFD.
Резултати
Генетична модификация на Bacillus subtilis SCK6 за подобряване на производството на BA
Доказано е, че SCK6 е идеален домакин поради отличната си експресия на протеини и способности за трансформация [26, 27]. Въз основа на данните за секвениране на цели геноми, има само един биосинтетичен път на BA B. subtilis, пътят на киназата BA [28]. През последните години в повечето микробиоти, произвеждащи BA, в червата е идентифициран нов синтетичен път на BA, пътят на бутирил CoA: CoA транс оцета на оцетна киселина (BCoAT) [29]. За да подобрим производството на BA, ние вмъкнахме генното кодиране на BCoAT в генома на SCK6, за да изразим новия път на синтез на BA. Като се има предвид, че бактериалната биомаса може също да бъде фактор за подобряване на производството на BA, генът skfA, кодиращ спорулационен убиващ фактор, беше нарушен, за да се увеличи скоростта на растеж [30]. В сравнение със SCK6, BsS-RS06550 произвежда значително по-голямо количество BA, приблизително 3,80 пъти по-високо (фиг. 1а, 0,238 ± 0,014 g/L срещу 0,984 ± 0,027 g/L, стр Фиг. 1
Благоприятни ефекти на BsS-RS06550 върху HFD-индуцирано затлъстяване при мишки
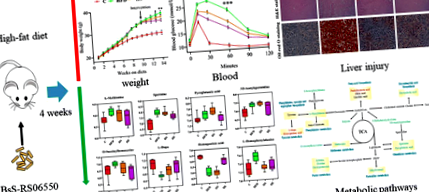
Експерименталният дизайн включваше 4 групи (n = 8 за всяка група): група с нормална диета (C), група с високо съдържание на мазнини (HFD), HFD + Bacillus subtilis SCK6 (HS) група и HFD + BsS-RS06550 (HE). Както е показано на фиг. 2а, телесното тегло на мишки в групите HFD, HS и HE не показва разлики преди интервенцията, докато добавката BsS-RS06550 значително намалява нарастването на телесното тегло при индуцираните от HFD мишки (HE срещу HFD на 14 седмици, 34,60 ± 0,63 g срещу 37,90 ± 0,88 g, стр Фиг. 2
Анализ на серума и увреждане на черния дроб
Проучванията показват, че BA регулира серумните биохимични показатели при HFD мишки, хранени [35, 36]. Диетата с високо съдържание на мазнини значително увеличава нивата на общия холестерол (TC), триглицеридите (TG), липопротеините с висока плътност (HDL) и липопротеините с ниска плътност (LDL) в групата с HFD в сравнение с тези, наблюдавани в групата C (Фиг. 2, 5,30 ± 0,542 mmol/L срещу 2,96 ± 0,224 mmol/L, 2,78 ± 0,249 mmol/L срещу 1,95 ± 0,216 mmol/L, 4,00 ± 0,322 mmol/L срещу 2,36 ± 0,219 mmol/L, 0,678 ± 0,051 mmol/L срещу 0,408 ± 0,061 mmol/L, стр Фиг. 3
Метаболитен отговор на индуцирано от HFD затлъстяване при мишки към BsS-RS06550
Все повече доказателства показват, че BA участва в метаболизма на енергия и материал [37], а физиологичните промени, отбелязани по-горе, може да са причинени от различия в метаболизма. В настоящото проучване събрахме фекални проби от всички групи, за да оценим метаболитните промени. Филтрирани са общо 9726 потенциални биомаркери и са наблюдавани значителни промени сред всички групи (фиг. 4а, б). PCA и ортогонален OPLS-DA бяха извършени върху LC-MS данни и предоставиха общ преглед на клъстерната информация (Фиг. 4в, d). В модела PCA не е имало значително разделение между HFD, HS и HE групите и всички групи са били отделени от C групата. Моделът OPLS-DA обаче, контролиран метод на клъстериране, беше сравнен с PCA, който осигури по-голяма дискриминационна сила. Графиката на резултатите показа, че всички групи са ясно разделени една от друга и тези резултати показват, че BsS-RS06550 променя метаболитните профили на изпражненията от мишки в групата с HFD.
Нецелеви анализ на фекалната метаболомика. а Йерархично групиране на диференциално метаболити във всички групи. б Дървесен анализ на пробите. ° С Графики на резултатите от PCA на фекални метаболитни профили, нормална диетична група (C), диетична група с високо съдържание на мазнини (HFD), HFD + Bacillus subtilis SCK6 група (HS) и HFD + BsS-RE06550 (HE). д Графики за оценка на OPLS-DA на фекално метаболитно профилиране на C, HFD, HS и HE
Анализ на метаболитите и метаболитните пътища
Въз основа на метаболомичните анализи изследователите са възприели интервенционни подходи за лечение на затлъстяване [38]. Консумацията на HFD може да увеличи извличането на енергия и да намали производството на SCFAs, потискащи затлъстяването, което води до затлъстяване и метаболитни нарушения [39]. Освен това е доказано, че се наблюдават отрицателни корелации между BA и някои метаболити в множество метаболитни пътища. Нивата на метаболитите се променят значително според OPLS-DA (VIP резултат> 1) и еднопосочен ANOVA (стр стойност ≤ 0,05) резултати. Всички идентифицирани метаболити са изчислени чрез квазимолекулярна йонна масспектрометрия с масова грешка на l-метионин, спермин, пироглутаминова киселина, O-сукцинилхомосерин, l-хомофенилаланин, l-фенилаланин, гуанин, аденин, дихидроурацил и 5- метилтетрахидрофолатът всички са значително намалени в групата с НЕ в сравнение с тези, наблюдавани в групата с HFD (Фиг. 5, 6, стр Таблица 1 Значимост на метаболитите във фекални проби от HFD, HS и HE
Графики за относително изобилие от значими метаболити в глутатион, метионин, тирозин, фенилаланин метаболизъм и С (контрол), HFD (диета с високо съдържание на мазнини), HFD + Bacillus subtilis SCK6 група (HS) и HFD + BsS-RS06550 (HE) групи (n = 8 за всяка група). Нормализиране на данните за интензивността с преобразуване на лог функцията (въз основа на 10)
Графики за относително изобилие от значими метаболити в метаболизма на пурините и биосинтеза на вторична жлъчна киселина и C (контрол), HFD (диета с високо съдържание на мазнини), HFD + Bacillus subtilis SCK6 група (HS) и HFD + BsS-RS06550 (HE) групи (n = 8 за всяка група). Нормализиране на данните за интензивността с преобразуване на лог функцията (въз основа на 10)
Регулирането на метаболитите нагоре и надолу предвещава промени в метаболитния път. В това проучване ние приехме фекални проби като обект за изследване на промените в метаболитните пътища. Въз основа на значителната разлика метаболити е изградена мрежова диаграма въз основа на пътя на KEGG и литературата за описване на тези потенциални характерни метаболити и техния метаболизъм (Фиг. 7). Идентифицираните метаболити са участвали главно в метаболизма на метионин, пурин, глутатион, тирозин и цистеин и биосинтеза на фенилаланин и вторична жлъчна киселина.
Схематична диаграма на предложените метаболитни пътища във всички фекални проби. Червеното и зеленото представляват съответно нагоре и надолу регулирани метаболити
Дискусия
l-Dopa и хомогентизовата киселина са метаболити, участващи в метаболизма на тирозин. l -Dopa е предшественик на невротрансмитера допамин и неговото използване е потенциална стратегия за контролиране на теглото след хронична двустранна операция за субталамична стимулация [47]. Хомогентизиновата киселина е друг метаболит, участващ в метаболизма на тирозин. Изследване на Nguyen съобщава, че хомогентизовата киселина е ефективен инхибитор на α-глюкозидазата за подобряване на нивата на глюкоза в кръвта [48]. В това проучване нивата на l -Dopa (стр l -Dopa и хомогентизова киселина бяха потвърдени в нашето проучване (фиг. 2б, в). l-хомофенилаланин и l-фенилаланин участват в метаболизма и биосинтезата на фенилаланин. Тези аминокиселини могат да бъдат окислени до тирозин и участват в синтеза на невротрансмитери и хормони. В допълнение, фенилаланинът е идентифициран като потенциален биомаркер при затлъстяване [49]. Нарушенията на глюкозния и липидния метаболизъм, индуцирани от HFD, могат да бъдат облекчени от BsS-RS06550 чрез намалени нива на фенилаланин (Фиг. 6). По този начин тези резултати предполагат, че BsS-RS06550 може да повлияе метаболизма на тирозин и фенилаланин.
Дезоксихолевата киселина (DCA) е жлъчна киселина, която показва значително различни нива между HE и HFD групите (Фиг. 6), а лечението с BsS-RS06550 значително намалява нивото на DCA при мишки в HE групата в сравнение с това, наблюдавано в HFD група (стр
Заключение
Методи
Щамове, среда и условия на растеж
Бактериалните щамове и плазмиди, използвани в това проучване, са изброени Допълнителен файл 1: Таблица S1. Ешерихия коли DH5α се използва за клониране на ДНК и плазмидно изграждане. Bacillus subtilis SCK6 се използва като родителски щам за деформационни конструкции и се трансформира с минималната среда на Spizizen. Всички щамове бяха рутинно култивирани в течна среда Luria-Bertani (LB) и LB агарови плаки при 37 ° С. Канамицин е използван за избор на pCas при крайна концентрация от 100 μg/mL, а Spectinomycin е използван при 100 μg/mL за избор на pTargetF плазмиди.
BsS-RS06550 строителни и ин витро експерименти
Анализ на SCFA
Супернатантите на YCFA среда се събират чрез центрофугиране след 24 h култивиране при 37 ° С. Концентрациите на SCFAs бяха измерени чрез газова хроматография-масспектрометрия (GC-MS). Първо, 0,4 ml от 50% (v/v) сярна киселина и 2 ml диетилов етер се добавят към 2 ml супернатанти за подкисляване и обогатяване на SCFA. Супернатантите се събират след центрофугиране при 4 ° С, центрофугират се при 3000 r/min в продължение на 5 минути и след това се филтрират през 0.22 μm найлонови филтри. За отстраняване на водата се използва калциев хлорид, а супернатантите се използват за откриване на GC-MS. Подробният GC-MS процес е показан в Допълнителен файл 1.
Животни и режим на третиране
32 мъжки мишки C57 BL/6 J (на възраст 3-5 седмици) бяха настанени и поддържани при постоянна температура (22 ± 3 ° C) и влажност (55 ± 10%). Мишките имаха свободен достъп до вода и храна и бяха подложени на 12-часови цикли светлина-тъмнина по време на едноседмично аклиматизиране. 32-те мишки бяха разпределени на случаен принцип в четири групи (n = 8 на група): контролна група (C), група с високо съдържание на мазнини (HFD), HFD + Bacillus subtilis SCK6 (HS) група и HFD + BsS-RS06550 (HE) група. Мишките в HFD, HS и HE се дават чрез сонда веднъж дневно с 200 μL контролни ddH2O, SCK6 (10 8 CFU/mL) и BsS-RS06550 (10 8 CFU/mL), съответно. Всички лечения се провеждат в продължение на 4 седмици и мишките гладуват цяла нощ, преди да бъдат умъртвени в края на проучването. Кръв, черен дроб и тъкани на червата бяха събрани от жертвените животни и съхранявани при - 80 ° C. Телесното тегло и приема на храна се измерват веднъж седмично за всяка мишка.
Чернодробна хистология и серумен анализ
Чернодробните тъкани бяха фиксирани с 4% формалин и обработени за вграждане на парафин. Тъканните срезове бяха нарязани на филийки с дебелина 5 μm и оцветени с хематоксилин и еозин (H&E), използвайки стандартна процедура. Пробите от тъкани бяха наблюдавани и заснети с микроскоп CX31 (Olympus).
Чернодробните тъкани, фиксирани с 10% формалин, бързо се замразяват с течен азот и след това се разделят на филийки с дебелина 5 μm. Разрязаните стъкла на чернодробната тъкан бяха поставени в абсолютен пропилен гликол за 5 минути, за да се избегне пренасянето на вода в Маслено червено О. Слайдовете бяха оцветени с предварително затоплен разтвор на Червено О в продължение на 30 минути при стайна температура и след това оцветени в хематоксилин на Mayer разтвор за 30 s. След оцветяването предметните стъкла се измиват три пъти с вода и след това се наблюдават под микроскоп Zeiss Obverse 7 (Zeiss).
Взети са кръвни проби след 12-часов пост. Серумът/плазмата се отделят, преди да се съхраняват при - 80 ° C. Биохимичните параметри на серума са измерени с помощта на инструмент Mindray BS-2000M (Шенжен, Китай), съгласно указанията на производителя. За тестове за инсулинова толерантност (ITT) мишките получиха интраперитонеална инжекция с човешки инсулин в състояние на хранене ad libitum след гладуване през нощта. За тестове за толерантност към глюкоза (GTT), мишките получават орално приложение на глюкоза след гладуване през нощта. Нивата на кръвната глюкоза бяха измерени с помощта на Roche ACCU-CHEK измервателен уред за активна кръвна захар (Базел, Швейцария) в посочените часови точки. Нивата на свободни от плазма мастни киселини бяха измерени с помощта на набор за количествено определяне (WAKO).
Нецелена LC – MS за измерване на метаболити във фекални проби
Фекални проби (100 mg) и 500 μL ddH2O (4 ° C) се прехвърлят в 2 ml епруветки за центрофуги и се завихря за 60 s. Впоследствие, 1000 μL метанол (предварително охладен при - 20 ° C) се прехвърля в епруветките и се завихря за 30 s. След това разтворите се обработват с ултразвук в продължение на 10 минути при стайна температура и след това се инкубират в продължение на 30 минути върху леда. Супернатантните проби се събират след центрофугиране в продължение на 10 минути при 14 000 об/мин и 4 ° С. Супернатантните проби се изсушават с вакуум чрез концентриране и след това се разтварят в 400 μL 2-хлорбензаламин (4 ppm) метанол воден разтвор (1: 1, 4 ° С). След 0,22 µm мембранна филтрация пробите бяха готови за LC-MS детекция. Конкретните нецелени LC-MS условия са показани в допълнителни материали.
Статистически анализ
Данните за производството на ВА BA се анализират в три екземпляра. Данните бяха изразени като средно ± стандартно отклонение (SD) и бяха подложени на еднопосочен дисперсионен анализ (ANOVA) с тест на Турция и графично представяне, използвайки софтуера GraphPad Prism 8.0 (La Jolla, CA). Нецелевите LC-MS сурови данни бяха обработени от софтуера Proteowizard (v3.0.8789). След това идентификацията на пиковете, филтрирането на пиковете и подравняването на пиковете бяха администрирани от R пакет XCMS (v3.3.2) и матрицата на данните беше установена въз основа на съотношението маса към заряд (m/z), времето на задържане (rt) и интензивността. Анализът на основните компоненти (PCA) и ортогоналният частичен дискриминантен анализ на най-малките квадрати (OPLS-DA) бяха администрирани с матрицата на данните, като се използва R пакет ropls. Софтуерът GraphPad Prism 8.0 за ANOVA е използван за статистически анализи между групи. *стр
Наличност на данни и материали
Всички данни, генерирани или анализирани по време на това проучване, са включени в тази публикувана статия.
- Предпазват ли стомашните ви бактерии от затлъстяване ScienceDaily
- Диета-индуцирано затлъстяване и загуба на тегло променят концентрацията на жлъчна киселина и чувствителния на жлъчните киселини ген
- Могат ли бактериите да ви направят дебела психология днес
- Класификация на затлъстяването, насочено към персонализирано диетично управление на загуба на тегло въз основа на
- Чисто постно; Пълноценно хранене - висококачествени витамини и добавки, формулирани от лекар