Резюме
Поддържането на загуба на тегло често е неуспешно поради метаболитни адаптации, които пестят енергия. Изследванията върху гризачи показват, че намаляването на нивото на лептин по време на загуба на тегло сигнализира на мозъка за увеличаване на храненето и намаляване на енергийните разходи. В този брой на JCI Rosenbaum et al. изследва тази концепция при пациенти със затлъстяване, които са отслабнали и са били поддържани с 10% под първоначалното си тегло (вж. свързаната статия, започваща на страница 2583). Реакциите на мозъчната активност на визуални хранителни стимули бяха визуализирани с помощта на функционална ЯМР. Нивата на лептин са намалели по време на загуба на тегло и повишена мозъчна активност в области, участващи в емоционален, когнитивен и сензорен контрол на приема на храна. Възстановяването на нивата на лептин поддържа загуба на тегло и обръща промените в мозъчната активност. По този начин лептинът е критичен фактор, свързващ намалените енергийни запаси с хранителното поведение. Потенциално терапията с лептин може да поддържа загуба на тегло, като отменя тенденцията към енергоспестяване.
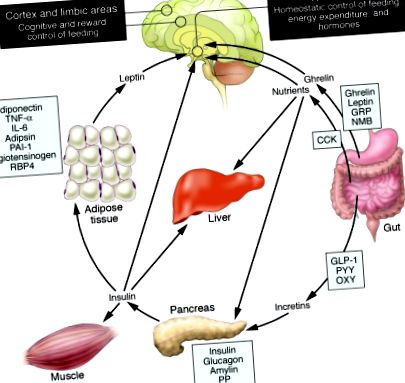
Затлъстяването е резултат от дисбаланс между приема на храна и енергийните разходи, което завършва с прекомерно натрупване на мазнини в мастната тъкан, черния дроб, мускулите, панкреатичните островчета и други органи, участващи в метаболизма. Затлъстяването увеличава риска от диабет, коронарна артериална болест, затлъстяване на черния дроб, камъни в жлъчката, сънна апнея, артрит и рак и може да съкрати продължителността на живота (1). Нашите познания за невробиологията на храненето и енергийната хомеостаза са се възползвали от откриването на хормони, получени от мазнини и черва и техните цели в хипоталамуса (2, 3) (Фигура (Фигура 1). 1). Яденето обаче е сложно поведение, което се определя не само от съзнателното вземане на решения, но също така е подчинено на фактори на околната среда като наличието и свойствата на храната и социалните и културни норми. По-доброто разбиране на това как мозъчните области, участващи в възнаграждение, познание и изпълнителен контрол на храненето, могат да отменят метаболитната регулация, ще улесни профилактиката и лечението на затлъстяването.
Грелинът се произвежда в стомаха и е мощен стимулатор на апетита в мозъка. В допълнение към увеличаването на усвояването на хранителни вещества от мускулите, черния дроб и мазнините, инсулинът действа в мозъка, за да потисне приема на храна. Получените от червата пептиди като GLP-1 увеличават освобождаването на инсулин от панкреаса. Нивата на лептин намаляват по време на загуба на тегло и сигнализират на хипоталамуса за стимулиране на храненето, намаляване на енергийните разходи и насърчаване на възстановяването на теглото. Както Rosenbaum et al. демонстрират в този брой на JCI (4), ниските нива на лептин по време на загуба на тегло също увеличават активността на мозъчните зони, участващи във вземането на решения и възнаграждават аспектите на хранителното поведение. По този начин предотвратяването на спада на нивата на лептин по време на загуба на тегло чрез заместване на хормони може да бъде средство за преодоляване на хомеостатичните и поведенчески тенденции към запазване на енергията и възстановяване на теглото по време на диета. Изображение, променено с разрешение от гастроентерология (23). CCK, холецистокинин; GLP-1, глюкагоноподобен пептид – 1; GRP, пептид, освобождаващ гастрин; NMB, невромедин В; OXY, оксинтомодулин; PAI-1, инхибитор на активатора на плазминоген 1; PP, панкреатичен полипептид; PYY, пептид YY; RBP4, ретинол-свързващ протеин – 4.
Ограничаването на калориите е логична стратегия за намаляване на теглото, но не може да се поддържа в дългосрочен план, отчасти поради повишения глад и намаляването на метаболизма, които насърчават енергоспестяването и възстановяването на теглото. В настоящия брой на JCI Rosenbaum et al. описват специфични модели на мозъчна активност в мозъчната кора, лимбичните области и хипоталамуса, когато пациентите с намалено тегло са били представени с визуални хранителни стимули (4). Интересното е, че възстановяването на лептина до нивата преди загуба на тегло обърна промените в мозъчната дейност, като същевременно предотврати възстановяването на теглото. По този начин, в допълнение към контрола на хипоталамусните невронални вериги, метаболитни сигнали като лептин могат да увлекат възприемането на храната чрез неочаквани ефекти върху обработката на визуалната и друга сензорна информация.
Възходи и падения на Лептин
Нивата на лептин бързо падат в отговор на гладно и предизвикват дълбоки промени в енергийния баланс и нивата на хормоните (5, 6). Ниските нива на лептин предизвикват прехранване и потискат енергийните разходи, щитовидната жлеза и репродуктивните хормони и имунитета (5, 8–10). При гризачите ниските нива на лептин увеличават нивата на орексигенните пептиди и намаляват нивата на анорексигенните пептиди (3, 5). Заместването на лептин обръща тези промени в метаболизма, имунитета и нивата на хормоните и хипоталамусните невропептиди (5, 8–10). Освен това възстановяването на лептин при пациенти без мастни клетки (липодистрофия) подобрява репродуктивната функция и обръща ненормалния метаболизъм на липидите и глюкозата (11, 12). Заедно тези изследвания показват, че доминиращата роля на лептина е да сигнализира за енергиен дефицит в мозъка (6). Телеологично, адаптациите, медиирани от намалените нива на лептин, може да са се развили като защита срещу заплахата от глад, като ограничат използването на енергия и подобрят съхранението на енергия под формата на мазнини (5, 6). В съвременната среда, където храната е в изобилие и упражненията са оскъдни, тази метаболитна ефективност предразполага към затлъстяване.
В по-ранни проучвания Rosenbaum et al. изследва концепцията, че лептинът е критичен сигнал за метаболитни промени, предизвикани от ограничаване на калориите при хората (13, 14). Затлъстелите лица са били хранени с течна диета, за да поддържат обичайното си тегло в продължение на няколко седмици, или са били хранени с нискокалорична течна диета, за да поддържат 10% намаление на теглото. Хипотезата беше, че намаляването на нивата на лептин в състоянието с намалено тегло ще намали енергийните разходи и ще насърчи възстановяването на теглото. Заместването на лептинов хормон предотвратява спада в нивото на лептин в плазмата и възстановява енергийните разходи, като увеличава ефективността на работата на скелетните мускули, тонуса на симпатиковата нервна система и хормона на щитовидната жлеза до нивата преди загуба на тегло (13, 14). Тези промени са свързани с поддържане на намаляване на теглото (13, 14).
Образна активност на лептин в човешкия мозък
Въпреки че проучванията върху животни имат разплетени вериги в хипоталамуса и мозъчния ствол, които са повлияни от пептиди, получени от червата и мазнините, тези проучвания не разглеждат когнитивните и емоционалните аспекти на хранителното поведение (3, 5, 6). Апетитът е субективно усещане за мотивация за ядене. Гладът, ситостта и засищането могат да бъдат преодолени от желанието. Предпочитанията ни за хранене и начина на хранене са оформени от минали преживявания, а също така се влияят от усещанията за зрение, мирис и вкус. Хранителното поведение включва сложно взаимодействие между психологически и физиологични процеси, които не могат да бъдат изследвани адекватно в животински модели. Хората предоставят подходящия модел за справяне с това как сензорните и хормоналните сигнали взаимодействат, за да предизвикат субективни и физиологични промени в енергийния метаболизъм.
Rosenbaum et al. представят подробно описание на мозъчната дейност при различни условия на тегло и нива на лептин (4). При първоначалното тегло, визуалните хранителни стимули предизвикват активност в мозъчните области, участващи в енергийната хомеостаза, автономната и хормоналната регулация, както и емоционален и изпълнителен контрол на хранителното поведение. Хипоталамусът, амигдалата, хипокампусът, парахипокампалният и цингуларният вир и челната и теменната кора са показали повишена активност. За разлика от това, състоянието с намалено тегло е свързано с повишена активност в мозъчния ствол, парахипокампалната извивка, гърбицата и globus pallidus, както и зоните във фронталната и темпоралната кора, участващи във функциите за вземане на решения. Както беше предсказано, заместването на лептин в състояние с намалено тегло обърна мозъчната активност към модела, наблюдаван при първоначалното тегло. Тези констатации биха могли да бъдат засилени чрез включване на субективни оценки на апетита и измерване на други метаболитни фактори в циркулацията, освен лептина. Освен това, BOLD сигналите не установяват дали мозъчните области, засегнати от лептина, са насочени директно или индиректно.
Независимо от това, проучването разширява скорошното картографиране на мозъчните реакции при пациенти с вроден дефицит на лептин (15, 16). Farooqi et al. установи, че в състояние на недостиг на лептин, изображенията на харесвана храна предизвикват желание за ядене, дори когато субектите току-що са яли (15). За разлика от това, след лечение с лептин, изображенията на харесвана храна предизвикват желание да се яде само по време на гладуване (15). Последното е подобно на нормалните субекти и е свързано със способността на лептина да потиска активността в стриатума, регион, участващ в отговорите на удоволствието и възнаграждението към храната (15). Бейси и др. наблюдава, че заместването на лептин намалява приема на храна и теглото и това е свързано с намалена мозъчна активност в региони, свързани с глада (16). От друга страна, лептинът повишава мозъчната активност в области, свързани със ситост (16).
Последици за терапията със затлъстяване
По-ранните проучвания на Rosenbaum et al. разкри, че липсата на лептин насърчава възстановяването на теглото чрез стимулиране на апетита и намаляване на енергийната продукция (13, 14). В настоящото проучване спадът на лептина служи като ключов метаболитен сигнал за модулиране на наградата и изпълнителен контрол на визуалните хранителни стимули (4) (Фигура (Фигура 1). 1). Способността на лептиновия заместител да обърне тези промени предполага, че самият лептин или лекарства, които стимулират сигнализирането за лептин, могат да улеснят поддържането на загуба на тегло. Всъщност заместването на лептин усилва ефекта на лекарството за отслабване, сибутрамин, при индуцирани от диета плъхове със затлъстяване, като допълнително намалява приема на храна и стимулира окисляването на мастните киселини (17). По същия начин е възможно предотвратяването на спада в нивото на лептин чрез заместване на хормона да поддържа ефектите от диетата или медикаментозното лечение при пациенти със затлъстяване.
Друга област, която заслужава по-нататъшно проучване, е дали затлъстелите лица с несъразмерно ниски нива на лептин могат да се възползват от терапията с лептин. Тази стратегия е подобна на лечението с инсулин при пациенти с диабет тип 2, характеризиращ се с относителна инсулинова недостатъчност в резултат на панкреатична β клетъчна недостатъчност. Изследванията на населението показват, че приблизително 10% от затлъстелите индивиди имат ниски плазмени нива на лептин (6). Наистина ли тези хора със затлъстяване имат недостиг на лептин? Ниското ниво на лептин предвещава ли затлъстяване по-късно в живота? Всъщност хората и гризачите с хетерозиготна мутация на гена, кодиращ лептина, проявяват частичен дефицит на лептин, повишена телесна мазнина и абнормен метаболизъм на глюкоза и липиди (18, 19). Намалените нива на лептин могат да предшестват затлъстяването и да предсказват лош резултат до загуба на тегло (20, 21). По този начин, скринингът за частичен лептинов дефицит може да идентифицира индивиди със затлъстяване, нуждаещи се от заместителна терапия с лептин. Картографирането на структурата, химията и електрическата активност на човешкия мозък може също да даде представа за терапевтичните стратегии, насочени към централната обработка на хранителни стимули.
На мишки и хора
Тези елегантни и по своята същност трудни изследвания от Rosenbaum et al. а други подчертават потенциала на клиничното изследване (4, 13, 14-16). Повече от десетилетие след откриването на лептин (2), сега имаме проучвания, изследващи активността на този метаболитен хормон в човешкия мозък. Има тенденция клиничните проучвания да се обозначават като „описателни“ или „липсващи в механизъм“. Напротив, описаните по-горе експерименти се основават на добре обмислени хипотези, гениална методология и убедителна интерпретация на данните. Преди всичко резултатите са приложими при хората. Няма съмнение, че животинските модели, по-специално мишките, са усъвършенствали нашите познания по молекулярна генетика и са улеснили предклиничните експерименти. Но за да не забравим, мишките не са хора! Всъщност има многобройни случаи, при които животински модели, основани на неподходящи концептуални парадигми, са довели до зрелищни провали и всъщност са възпрепятствали медицинските открития. Като се има предвид неотдавнашното искане за разследване „от лег до легло“, радващо е да се види заслужената публикация на клинично/пациентски ориентирани изследвания (4, 15, 16, 22). Тази тенденция несъмнено ще насърчи по-нататъшни изследвания върху затлъстяването и метаболитните нарушения.
Бележки под линия
Използвани нестандартни съкращения: СМЕЛО, зависи от нивото на кислорода в кръвта.
Конфликт на интереси: Авторът е получил изследователска подкрепа от Biomeasure/Ipsen Inc. и е участвал в научни консултативни съвети на Bristol-Myers Squibb Co., Biomeasure/Ipsen Inc. и Ethicon Endo-Surgery (Johnson & Johnson).
Позоваване на тази статия: J. Clin. Инвестирам. 118: 2380–2383 (2008). doi: 10.1172/JCI36284.
Вижте свързаната статия, започваща на страница 2583.
- Санаториуми за отслабване в Русия лечение на затлъстяване
- P519 Психологически интервенции и мотивация за отслабване при момичета с андроидно затлъстяване
- No 10 планира шофиране за отслабване до готовност за Обединеното кралство за очакваното затлъстяване The Guardian от Covid-19
- Намалете теглото за една седмица, аюрведа начин Над тегло затлъстяване загуба на тегло Аюрведа масаж
- Хранене при затлъстяване Целеви критерии и мониторинг на отслабването - PubMed