Барбара М. Грюнер и
Търсете този автор в:
Сара-Мария Фенд
Търсете този автор в:
Разпространението на рака в отдалечени части на тялото, като например в отделение на лимфната система, наречено лимфен възел, показва лоша прогноза за много видове болести. Въпреки това, за някои тумори, като меланом на рак на кожата, отстраняването на лимфни възли, за да се предотврати това разпространение, не увеличава времето за оцеляване 1, 2. Това откритие може да се обясни с наблюдения, които показват, че лимфната система (която помага да се поддържа баланс на течностите и осигурява имунните клетки път за тяхното движение) снабдява съдове, които предлагат входна точка, през която разпространяващите се ракови клетки могат да достигнат до кръвоносните съдове 3, 4 пътят им до далечни органи. След като са пътували там, раковите клетки засяват и образуват вторични тумори, наречени метастази. По този начин инфилтрацията в лимфните възли не е непременно крайна точка, а по-скоро междинна спирка при пътуването на клетките другаде. И все пак предимството на това отклонение е неясно. Писане в Природата, Ubellacker и др. 5 разкриват усилването, което раковите клетки получават транзитно през лимфната система.
Разпространението на рака или метастазирането е неефективен процес 6, 7 и много ракови клетки умират в кръвта. Основен допринасящ фактор е оксидативният стрес в туморните клетки. Изследванията са установили, че антиоксидантното лечение за блокиране на такъв стрес причинява увеличаване на броя на туморните клетки в кръвния поток и увеличаване на разпространението на рака в отдалечени места 8, 9. Оксидативният стрес може да индуцира няколко вида клетъчна смърт, но Ubellacker и колеги показват при мишки, че човешки или миши меланомни клетки в кръвния поток са убити от ферроптоза (фиг. 1), механизъм на клетъчна смърт, който зависи от липидното окисление 10 .
Фигура 1 | Пътуване през лимфните съдове увеличава раковите клетки. Ubellacker и др. 5 докладват проучвания при мишки, показващи, че ако раковите клетки излязат от основното място на туморен растеж чрез кръвния поток, оксидативният стрес, който срещат, ги прави склонни да претърпят вид клетъчна смърт, наречена ферроптоза. Този процес изисква желязо, което присъства при високи нива в кръвта; полиненаситените липиди (тези с повече от една двойна връзка въглерод-въглерод) в мембраната на раковите клетки се окисляват по време на ферроптозата. Смъртта на тези клетки ограничава образуването на отдалечени метастази (тумори, разположени далеч от първичния тумор). За разлика от това, Ubellacker и колеги разкриват, че ако раковите клетки излязат от първичния тумор през лимфните съдове, те поемат липидите, съдържащи олеат, мононенаситения липид (който съдържа само една двойна връзка въглерод-въглерод), от лимфната течност. Когато такива ракови клетки след това навлязат в кръвния поток от лимфни възли, този липид помага на клетките да избегнат ферроптозата, увеличавайки образуването на метастази в сравнение със случая на ракови клетки, които не навлизат в лимфните съдове.
Авторите съобщават, че предварителната обработка на меланомните клетки с молекулата на инхибитора на ферроптозата липроксстатин-1 води до повече метастази, когато клетките се инжектират в кръвния поток на животните, отколкото когато клетките не са били предварително третирани. За разлика от това, меланомните клетки, които се разпространяват през лимфната система, произвеждат еднаква степен на метастази, независимо от лечението с липроксстатин-1, което предполага, че такива клетки не са претърпели ферроптоза. Това откритие показва, че докато са в лимфната система, раковите клетки придобиват способността да осуетяват механизма за клетъчна смърт, който обикновено възпрепятства напредъка им, ако се преместят директно в кръвния поток. Нещо повече, Ubellacker и др. установи, че броят на меланомните клетки в лимфната течност на животните е по-висок от броя в кръвния поток и че клетките, които се разпространяват през лимфната система, са по-склонни да образуват метастази, отколкото тези, които не са. Тази констатация е забележителна, тъй като показва, че само определени среди индуцират ферроптоза и предполага, че меланомните клетки, които се движат през лимфната система и след това излизат в кръвния поток, са по-склонни да оцелеят, отколкото клетките, които не преминават през лимфата.
Фероптозата изисква фосфолипидите в мембраните на раковите клетки да бъдат ненаситени (което означава, че молекулите съдържат двойни връзки въглерод-въглерод, които могат да бъдат окислени) и този вид клетъчна смърт също изисква желязо 10. Колкото по-ненаситен е фосфолипидът (колкото повече двойни връзки има), толкова по-склонен е да се подложи на окисляване. По този начин клетъчните мембрани, обогатени с наситени фосфолипиди (липсващи двойни връзки) или мононенаситени такива (имащи само една двойна връзка), са по-малко вероятно да бъдат достатъчно окислени, за да предизвикат ферроптоза, отколкото мембраните, обогатени с полиненаситени липиди.
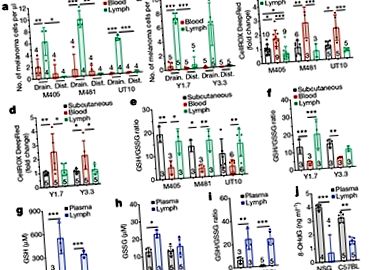
Много клетки придобиват полиненаситени липиди и желязо от заобикалящата ги среда. Ubellacker и колеги анализираха кръвта и лимфата от мишките си, за да открият как лимфната среда може да предпази меланомните клетки от ферроптоза. Те открили, че основните липиди в лимфата са триглицериди, много от които съдържат олеатни групи (които произлизат от олеинова киселина, мононенаситена мастна киселина) и че липидите, съдържащи олеат, обикновено са по-богати на лимфа, отколкото в кръвта. Авторите също така отбелязват, че кръвта на животните съдържа над 100 пъти повече желязо, отколкото лимфата им.
Ubellacker и др. възприемат двоен подход за проверка на значимостта на своите констатации. Първо, при мишки, в които човешките меланомни клетки са имплантирани под кожата си, авторите изолират меланомни клетки, които са мигрирали от тези подкожни тумори към кръвта и към лимфата. Те използваха масова спектрометрия, за да анализират молекулите, участващи в метаболизма на туморните клетки (метаболомичен анализ). В съответствие с разликите в нивото на съдържащите олеат липиди между лимфата и кръвта, авторите установяват, че от 57-те типа липиди, открити в техните експерименти, най-голямата разлика между меланомните клетки от кръвта и лимфата е в нивата им на олеинова киселина. Нещо повече, меланомните клетки, предварително обработени с олеинова киселина, оцеляват по-добре в кръвта след интравенозно инжектиране в мишки, отколкото нелекуваните меланомни клетки.
Второ, ако желязото беше отстранено от носителите, отглеждани меланомни клетки инвитро, използвайки желязо-хелаторното съединение дефероксамин, това намаляване на наличността на желязо беше достатъчно, за да блокира ферроптозата. Заедно тези открития са в съответствие с идеята, че средата на лимфата, обогатена с липиди, съдържащи олеат, предпазва меланомните клетки от ферроптоза, докато обогатената с желязо среда на кръвния поток допринася за нейното индуциране.
Тези резултати предоставят първа стъпка към разбирането на защитната среда на лимфата, но все пак възникват някои въпроси. Например до каква степен други наситени и мононенаситени мастни киселини защитават меланомните клетки в лимфата? Какъв е източникът на съдържащите олеат триглицериди в лимфната течност? Променен ли е липидният състав на лимфата, например чрез клинично лечение или в резултат на диета или при затлъстяване?
И накрая, авторите се обърнаха към въпроса дали метастазите в лимфните възли се появяват преди това на други места, тъй като излагането на лимфа предизвиква защитен метаболитен състав, който позволява на меланомните клетки да се разпространяват. За да разследват това, Ubellacker и колеги изолираха клетки на меланоми на мишки от подкожни тумори и от тумори в лимфните възли и инжектираха тези клетки в кръвния поток на мишки. Те открили, че меланомните клетки от лимфните възли са по-склонни да образуват метастатични тумори, отколкото клетките от подкожните тумори. Освен това раковите клетки от лимфните възли са по-малко чувствителни към лечението с индуциращата ферроптоза молекула ерастин, отколкото клетките от подкожните тумори.
Необходими са по-нататъшни проучвания, за да се потвърди тази интригуваща възможност за метаболитно праймиране на раковите клетки в лимфата. Например, би било полезно да се потвърди допълнително този модел чрез извършване на метаболомичен анализ, сравняващ меланомни клетки, инжектирани в лимфния възел и след това изолирани от лимфа и кръв.
До каква степен констатациите на Ubellacker и колегите се отнасят за видове тумори, различни от меланома, и за хората, предстои да се определи. Ако резултатите са от значение за човешките заболявания, трябва да се намерят новаторски начини те да имат терапевтично въздействие. Например могат да бъдат разработени подходи за манипулиране на способността на метастазирането на раковите клетки да включват и използват тези липиди за защита от ферроптоза или за повишаване на чувствителността на туморните клетки към фероптоза, дори в защитна среда като лимфната система.
- Раковите клетки умират за 42 дни Този известен австрийски сок излекува над 45 000 души от рак и
- Раковите клетки умират за 42 дни Този известен австрийски сок излекува над 45 000 души от рак и
- Защитата от рак са вашите естествени клетки-убийци в Active Duty Lifewood Lifestyle Center
- Автоложни дендритни клетки и активирани цитотоксични Т-клетки като комбинирана терапия за рак на гърдата
- Целина, артишок съдържа флавоноиди, които убиват човешки ракови клетки на панкреаса в колеж от