Резюме
Заден план
Чревният ендотоксин и последващата ендотоксемия могат да се считат за основни фактори, предразполагащи към заболявания като атеросклероза, сепсис, затлъстяване и диабет. Доказано е, че хранителните мазнини повишават постпрандиалната ендотоксемия. Следователно целта на това проучване е да се оценят ефектите на различни диетични масла върху чревния транспорт на ендотоксини и постпрандиалната ендотоксемия, като се използват свине като модел. Ние предположихме, че маслата, богати на наситени мастни киселини (SFA), ще увеличат, докато маслата, богати на n-3 полиненаситени мастни киселини (PUFA), ще намалят чревния транспорт на ендотоксини и циркулиращите концентрации.
Методи
Ендотоксемията след хранене е измерена при двадесет и четири прасета след каша, приготвена с вода (Control), рибено масло (FO), растително масло (VO) или кокосово масло (CO). Кръв се събира на 0, 1, 2, 3 и 5 часа след хранене и се измерва за ендотоксин. Освен това, ex vivo транспортирането на ендотоксин на илеума се оценява, като се използват модифицирани камери на Ussing, а червата се третират или без масло, или с 12,5% (v/v) VO, FO, масло от черен дроб на треска (CLO), CO или зехтин (OO). След това е измервана пропускливостта на транспорта на лигавицата до серозалния ендотоксин (Papp) чрез добавяне на флуоресцентен белязан липополизахарид.
Резултати
Постпрандиалните серумни концентрации на ендотоксин се повишават след хранене, богато на наситени мастни киселини и намаляват с по-висок прием на n-3 PUFA. В сравнение с контрола без масло, рибеното масло и CLO, които са богати на n-3 мастни киселини, намаляват ex vivo ендотоксина Papp с 50% (P
Заден план
Връзката между хранителните мазнини и ендогенния кръвен ендотоксин привлича повишен медицински и биомедицински интерес през последните няколко години. Освен това, хиперфагия, повишено затлъстяване и метаболитни промени, свързани с хранене с високо съдържание на мазнини, могат да бъдат рекапитулирани при мишки, хронично инфузирани с LPS в продължение на четири седмици [1]. Съобщава се, че структурата на консумираните мазнини (емулсия срещу свободно масло) променя степента на ендотоксемия и че промяната на състава, структурата и качеството на хранителните мазнини може да подобри здравето [2]. При здрави хора, постпрандиалните плазмени концентрации на ендотоксин се увеличават средно с 18% след хранене с високо съдържание на мазнини (приблизително 380 kcal от мазнини, 42% от общата енергия) в сравнение със състоянието на гладно [3]. Тези автори заключават, че увеличеният LPS след хранене може да допринесе за развитието на постпрандиално възпаление и заболяване. Ghanim et al. [4, 5] също показват, че при здрави възрастни, храна с високо съдържание на мазнини и високо съдържание на въглехидрати (
900 kcal) увеличава плазмените концентрации на LPS след хранене със 70%. Въпреки това, Laugerette et al. [6] наскоро съобщи, че съставът на диетичното масло диференцирано модулира възпалението на мишките и транспорта на ендотоксини. Тези автори също така показаха, че съставът на мазнините, а не количеството в диетата (22 срещу 3%) е от решаващо значение за модулирането на плазмената ендотоксемия. Като цяло тези данни показват, че приемът и съставът на хранителните мазнини са в състояние да модулират ендотоксина в кръвта и че това е свързано с остро възпаление и метаболитни заболявания на затлъстяването и диабета.
Следователно целта на това проучване е да се оценят ефектите на различни хранителни мазнини върху in vivo и ex vivo чревния транспорт на ендотоксини и концентрациите в циркулацията, като се използва прасето като биомедицински модел. Предполагаме, че маслата, богати на наситени мастни киселини (SFA), биха увеличили, докато маслата, съдържащи n-3 PUFA (докозахексаенова киселина [DHA] и ейкозапентаенова киселина [EPA]), биха намалили, транспорта на чревен ендотоксин и постпрандиалната ендотоксемия.
Методи
Материали и животни
Всички химикали, използвани за това проучване, са закупени от Sigma-Aldrich (Сейнт Луис, Мисури), освен ако не е посочено друго. Всички употреби и процедури за животни са одобрени от Институционалния комитет за грижа и употреба на животните в Университета на Айова.
Ефект на диетичното масло върху постпрандиалната серумна концентрация на ендотоксин
Двадесет и четири прасета (49 ± 7 kg телесно тегло) са отгледани на типична царевично-соева диета, която отговаря или надвишава техните хранителни нужди [21] и разпределени на случаен принцип за една от четирите обработки. Обработките се състоят от 500 g смляно тесто от царевично-соево брашно (2,145 kcal ME), приготвено с 1) 50 ml вода (Control); 2) 50 ml рибено масло (FO) (Spring Valley Inc., UT); 3) 50 ml растително масло (VO) (Hy-Vee Inc., IA); или 4) 50 ml кокосово масло (CO) (Spectrum Naturals Inc., NY). След пост през нощта шест прасета са хранени с по едно от всяко ястие с каша. Прасетата консумират доброволно цялото ястие с каша за десет минути след предлагането на ястието. Кръв се събира на 0, 1, 2, 3 и 5 часа след хранене чрез венепункция, като се използват вакуумни епруветки без пироген и стерилни игли. Взети са подходящи предпазни мерки за предотвратяване на външно замърсяване на кръвта с ендотоксини. Серумът се отделя чрез центрофугиране при 2000 × g и 4 ° С. След това серумът се съхранява в епруветки без пироген при -80 ° C до по-нататъшен анализ.
Концентрацията на циркулиращия серумен ендотоксин беше измерена, като се използва флуоресцентен анализ на крайната точка, като се използва системата на рекомбинантен фактор C (rFC) (Lonza ™, Швейцария). Накратко, серумните проби бяха разредени 1000 пъти и 100 μl от пробите или стандартите бяха добавени към 96-ямкова плака и инкубирани при 37 ° С за 10 минути. След това към плаката се добавят 100 μL rFC ензим, rFC пробен буфер и rFC субстрат и се вземат първоначални показания, последвани от 1 h инкубация при 37 ° С. Определя се относителната флуоресцентна единица (RFU) за всяка ямка (възбуждане 380 nm и емисия 440 nm). Използван е положителен контролен стандарт от комплекта за анализ, за да се установи валидността на анализа и концентрацията на ендотоксина е интерполирана от стандартната крива, изградена от стандартите и коригирана за разреждане на пробата.
Ex vivo интестинална цялост и транспорт на ендотоксини
Прясно изолирани сегменти на илеума от единадесет прасета (на възраст 21-28 дни) бяха поставени в охладен буфер на Krebs-Henseleit (състоящ се в mmol/L: 25 NaHCO3, 120 NaCl, 1 MgSO4, 6.3 KCl, 2 CaCl2, 0.32 NaH2PO4; pH 7.4) за транспорт до лабораторията при непрекъсната аерация. След това чревните тъкани бяха отстранени от външния им серозален слой и незабавно монтирани в модифицирани камери на Ussing (Physiologic Instruments Inc., San Diego, CA и World Precision Instruments Inc., New Haven, CT). Всяка камера и чревен сегмент (0.71 cm 2) се къпе от лигавицата и серозалната му страна с 5 ml буфер Krebs-Henseleit и постоянно се обгазява със смес от 95% O2-5% CO2. Камерите бяха свързани към двойка двуканални електроди за ток и напрежение, съдържащи 3% благородни агарови мостове и пълни с 3 М калиев хлорид за измерване на електрофизиологични параметри на чревните мембрани или за измерване на лигавичния до серозалния транспорт на ендотоксин. Трансепителната резистентност (TER) не се различава при прасетата, което показва липса на разлики в парацелуларната пропускливост или пропускливостта на червата (данните не са показани).
За да се изключи каквото и да е влияние, което жлъчните киселини могат да окажат върху интестиналната цялост, TER и макромолекулната пропускливост първо бяха тествани върху изолирани илеумни проби, които бяха инкубирани със свински жлъчни киселини (0, 3, 6 и 9 mg/ml) в продължение на тридесет минути. След това бе измерен FITC-белязан декстран (FITC-Dextran, 4.4 kDa) мукозен до серозален транспорт, както е описано по-рано [22]. Накратко, камерите на лигавицата бяха предизвикани с 2,2 mg/ml FITC-Dextran и проби от камерите от двете страни бяха събрани на всеки 10-15 минути в продължение на осемдесет минути. След това се определя относителната флуоресценция, като се използва флуоресцентен четец за плочи (Bio-Tek, САЩ) с дължини на вълната на възбуждане и излъчване съответно 485 и 520 nm. След това се изчислява явен коефициент на пропускливост (Papp) за всяко третиране:
Където: dQ/dt = скорост на транспортиране (μg/min); C0 = начална концентрация в донорната камера (μg/ml); A = площ на мембраната (cm 2).
Ефектът на хранителните мазнини върху транспорта на ендотоксини е изследван, като се използва пропускливост ex vivo на флуоресцеин изотиоцианат (FITC) с етикет LPS (Escherichia coli 055: B5), монтиран в модифицирани камери на Ussing. Накратко, сегменти от чревни тъкани на свинете бяха третирани с 12,5% (v/v) буфериран физиологичен разтвор (CON), рибено масло или масло от черен дроб на треска (CLO), произведено от Spring Valley Inc., UT) или растително масло, кокосово масло или зехтин (OO), закупен от Hy-Vee Supermarkets Inc., IA). Всички масла се предлагат на дребно и след това се смесват с 20 mM натриев тауродеоксихолат (жлъчна киселина) за образуване на мицела, за да се симулира чревната среда. След това всяка мукозна камера се предизвиква с 20 μg/mL FITC-LPS и пробите от камерата се събират на всеки 10-15 минути в продължение на осемдесет минути. След това се определя относителната флуоресценция на всяка проба, като се използва флуоресцентен четец за плочи (Bio-Tek, САЩ) с дължини на вълната на възбуждане и излъчване съответно 485 и 520 nm. След това се изчислява коефициентът на явна пропускливост, подобен на описания по-горе за FITC-Dextran.
Липидни салове, диетично масло и ех vivo транспорт на чревния ендотоксин
За да се изследва ролята на липидните салове в чревния транспорт на ендотоксини, илеумни сегменти от 16 прасета (на възраст 56 ± 4 дни) са монтирани в камерите на Ussing, както е описано по-горе. Сегментите бяха предварително обработени със или без 25 mM метил-р-цикло декстрин (MβCD, модификатор на синтетичен липиден сал) в продължение на 30 минути. След това мукозната камера се добавя или с физиологично-жлъчна киселина (CON), или с кокосово масло-жлъчна киселина (12,5% v/v) и се изчислява коефициентът на явна пропускливост на FITC-LPS за всяка тъкан.
Анализ на мастни киселини
Профилите на мастните киселини на диетичните масла, използвани за приготвяне на кашата, бяха определени и анализирани чрез GC-MS [23, 24]. Един ml масло се смесва с 0,5 ml 4: 1 хексан и 125 μg/L хептадеканова киселина се добавя към всяка проба като вътрешен стандарт. FAME бяха анализирани чрез GC върху Hewlett-Packard модел 6890, снабден с капилярна колона Omegawax 320 (30 m × 0,32 mm i.id. 0,25 um). Водородът е газ-носител. Температурната програма варира от 80 до 250 ° C с повишаване на температурата от 5 ° C/min. Температурите на инжектора и детектора са 250 ° C и 1 μL проба се инжектира и се разделя. Метиловите естери на мастни киселини са идентифицирани чрез относителното им време на задържане на колоната по отношение на подходящите стандарти и хептадеканова киселина.
Анализ на данни
Резултатите са представени като средни стойности ± S.E.M и са анализирани с Proc Mixed процедура на SAS (Cary, NC). В модела повторението или денят на бягане на камерата на Усинг е използван като случаен ефект. Статистическата значимост на разликата беше анализирана чрез дисперсионен анализ (ANOVA), последван от тест на обхвата на Tukey за двойно сравнение на всички средства за лечение. Разликите се считат за значими при P ≤ 0.05 и тенденция при P ≤ 0.10.
Резултати
Профили на мастни киселини в диетичното масло
Съставът на мастните киселини на маслата, използвани за приготвяне на каша и/или в проучването за транспортиране ex vivo, са представени в таблица 1. Кокосовото масло съдържа високи концентрации на наситени мастни киселини (89%), особено лауринова, миристинова, палмитинова киселини . Зехтинът съдържа много високо съдържание на мононенаситена олеинова киселина и умерено количество палмитинова киселина, със съдържание на наситени мазнини 29%. Растителното масло, използвано в това проучване, съдържа голямо количество (50%) арахидонова киселина (20: 4n6), 32% олеинова киселина и 13% палмитинова киселина. Използваното рибено масло се състои от 35% докозахексаенова киселина (DHA) и 19% ейкозапентаенова киселина (EPA), докато маслото от черен дроб на треска съдържа 32% палмитинова киселина, 25% арахидонова киселина, 8,6% EPA и 4,3% DHA. Съотношението n6: n3 е най-високо в зехтина> растително масло> масло от черен дроб на треска> рибено масло> кокосово масло.
Ефект на диетичното масло върху постпрандиалната серумна концентрация на ендотоксин
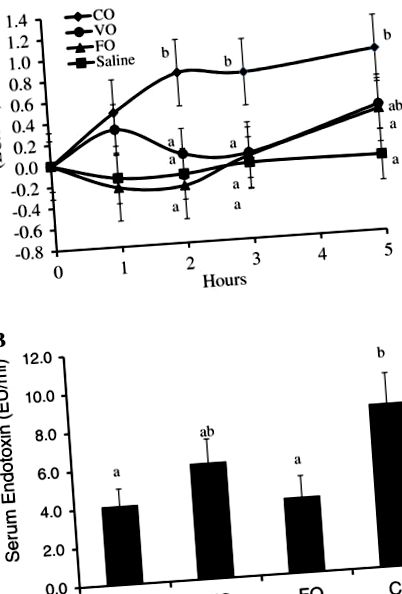
За да се оцени ефектът от диетичните липиди върху постпрандиалните серумни концентрации на ендотоксини, прасетата получават каша, съдържаща или 50 ml физиологичен разтвор, CO, VO или FO. Концентрацията на ендотоксини в различните използвани масла не се различава (данните не са показани). Промяната в серумната концентрация на ендотоксини след хранене поради различни лечения е представена на фигура 1А. Общите концентрации на серумен ендотоксин след хранене са значително по-ниски в храненията, представляващи физиологичен разтвор или FO, като средната обща концентрация на серумен ендотоксин се увеличава двукратно в сравнение с лечението с наситено кокосово масло (P Фигура 1
Ефект на екзогенната свинска жлъчна киселина върху интестиналната цялост ex vivo
Доказано е, че жлъчните киселини повишават чревната пропускливост в култивираните клетъчни линии Caco-2 [25]. За да се изключи ефектът, че екзогенната жлъчна киселина може да намали интестиналността на червата, бяха използвани прясно изолирани сегменти от свинско илеум за измерване на TER (Фигура 2А) и FITC-Dextran пропускливост (Фигура 2B). Тъй като тези сегменти са били изложени на нарастващи концентрации на свиня жлъчка ex vivo, не са наблюдавани разлики в интестиналната цялост (P> 0,10, Фигура 2). Това може да се дължи на толерантността на чревните тъкани към жлъчна киселина поради предишно излагане in vivo, за разлика от клетъчните култури, при които клетките не са били изложени на жлъчните киселини преди.
Ефект на диетичното масло върху ex vivo транспорта на чревния ендотоксин
Транспортът на ендотоксин на лигавицата ex vivo до серозален илеум се оценява, като се използват модифицирани камери на Ussing и анализ на пропускливостта на FITC-LPS (Фигура 3). В сравнение с лечението с физиологичен разтвор без контрол, ендотоксинът Papp е значително по-нисък както при лечението с FO, така и при CLO (P 0,05), но въпреки това е намален ендотоксин Papp спрямо лечението с кокосово масло (P Фигура 3
Ефект на модификация на липидния сал върху индуциран от наситени мазнини транспорт на ендотоксин
За да се провери хипотезата, че дестабилизацията на чревните липидни салове би намалила индуцираната от наситени мазнини пропускливост на ендотоксини, пробите на илеума бяха предварително обработени с модификатора на липидния сал метил-β-циклодекстрин (MβCD) и кокосово масло ex vivo. След това беше измерена FITC-LPS пропускливостта на ендотоксин за транспорт (Фигура 4А). Както се очаква, лечението със CO значително увеличи илеумния ендотоксин Papp в сравнение с контрола на физиологичния разтвор (P Фигура 4
Дискусия
Ние предположихме, че приемът на храни с масла, богати на DHA и EPA, ще отслаби чревния транспорт на ендотоксини и постпрандиалния циркулиращ ендотоксин. Установихме, че диетичният дроб на треска и рибеното масло намаляват серумните концентрации на ендотоксин в сравнение с кокосовото масло и нивата на ендотоксин при тези свине са подобни на контролната група (Фигура 1). Доколкото ни е известно, няма други проучвания, които да показват този ефект на DHA и EPA върху транспорта на ендотоксини и кръвната ендотоксемия.
По време на чревен стрес, исхемия, възпаление и заболявания, парацелуларният транспорт се осъществява през стегнатия възел, известен като „течаща черва“ [39]. Като алтернатива може да възникне трансцелуларен или вътреклетъчен транспорт, особено при здрави индивиди [40]. Доказано е, че трансклетъчният ендотоксин, транспортиран през клетъчна мембрана, се появява чрез TLR4 и разтворим GPI закотвен рецептор CD14 в механизъм, опосредстван от липиден сал [41, 42]. Освен това се предполага, че свързаният с хиломикрон LPS транспорт също играе ключова роля в чревния LPS транспорт от чревната епителна клетка [11, 43, 44]. Важното е, че не наблюдавахме намаляване на интестиналната цялост, което може да повиши парацелуларната пропускливост, оценено чрез трансепителна резистентност или FITC-декстранова пропускливост поради лечение или краткосрочна дестабилизация на салове (Фигура 4В). Тези данни предполагат, че при здрави чревни епителни условия, ендотоксинът най-вероятно се транспортира чрез ендоцитоза, медиирана от липиден сал.
Експериментите in vitro показват ясно, че n-3 PUFA нарушават сигнализирането на TLR4 и активирането на NFκB от LPS в миша моноцитна клетъчна линия [50]. Освен това, DHA модулира сигнала за TLR4 in vitro в RAW 264,7 макрофаги и 293 Т клетки [49], човешки моноцити и дендритни клетки [51] и мастна тъкан. По-рано показахме при прасета, че хранителните EPA и DHA са ефективно средство за въздействие върху възпалителния статус и пътищата, повлияни от сигнализирането на TLR4, индуцирано от LPS [52], и за промяна на чревната функция [24, 53]. Следователно би могло да се предположи, че антагонизирането на набирането на TLR4 до липидни салове и сигнализирането му от DHA и EPA или стимулирането на тези процеси с наситени мастни киселини, би променило транспорта на ендотоксини и циркулиращия ендотоксин след хранене.
Друг механизъм, чрез който ендотоксинът може да влезе в кръвообращението, е чрез мицели. Тъй като страничните вериги на ендотоксините са изградени от мастни киселини, ендотоксините могат да бъдат включени в мицелите и транспортирани в чревната епителна клетка [54]. В чревните епителни клетки хиломикроните транспортират абсорбираните липиди в различни части на тялото. Доказано е, че прилагането на високо съдържание на мазнини пропорционално увеличава съдържанието на ендотоксини в хиломикрона, което показва, че високата консумация на мазнини наистина подобрява по-високия транспорт на ендотоксин в чревната епителна клетка и включването в хиломикрон [11, 28]. Освен това, въпреки че механизмът не е ясен, е доказано, че високият прием на мазнини причинява интернализация на протеините с плътно свързване и увеличава парацелуларната пропускливост за макромолекули, включително ендотоксин [30]. Въпреки че този начин на транспорт на ендотоксини не може да бъде изключен, предполагаме, че скоростта на включване на мастни киселини в мицелите няма да варира поради състава на маслото. Следователно ние предполагаме, че разликата в транспорта на чревния ендотоксин, който наблюдаваме, е предимно трансцелуларен транспорт, който включва липидни салове и ендоцитоза, медиирана от рецептори [42].
В заключение, тези данни предполагат, че диетичните масла могат диференцирано да променят чревния транспорт на ендотоксини. Маслата, богати на DHA и EPA, намаляват транспорта на ендотоксини, докато маслата с високо съдържание на наситени мастни киселини увеличават транспорта на ендотоксини. Освен това, транспортът на чревния ендотоксин при здрави индивиди може да се регулира чрез механизъм, медииран от липиден сал. Наситените мастни киселини може да стабилизират липидните салове, което позволява по-голям транспорт на ендотоксини.
- Диетичните навици на 2- до 9-годишните американски деца са свързани със състава на микробиомите в червата
- Диетични модели, свързани с различен състав на микробиота при деца Катедра по хранителни науки
- Диетичната фруктоза и глюкоза диференциално влияят върху липидната и глюкозната хомеостаза
- Сравняване на четири популярни диетични тенденции Paleo срещу Keto срещу 5 2 срещу Dukan - Моят блог
- Диета и първична профилактика на инсулт Систематичен преглед и диетични препоръки от ad hoc