Субекти
Резюме
Оптогенетичното заглушаване позволява разрешено във времето функционално разпитване на определени невронални популации. Ограниченията на инхибиторните оптогенетични инструменти обаче налагат строги ограничения върху експерименталните парадигми. Изискването за висока мощност на светлината на управляваните от светлина йонни помпи и техните ефекти върху вътреклетъчната йонна хомеостаза създават уникални предизвикателства, особено при експерименти, които изискват инхибиране на широко разпространена невронална популация in vivo. Гилардия тита анион-проводящи каналродопсини (GtACRs) са обещаващи в това отношение, поради тяхната висока едноканална проводимост и благоприятна фотон-йонна стехиометрия. GtACRs обаче показват лошо насочване към мембраната в клетките на бозайници и активността на такива канали може да причини преходно възбуждане в аксона поради потенциал за обръщане на възбуждащ хлорид в това отделение. Тук ние се занимаваме с тези проблеми чрез подобряване на мембранното насочване и субклетъчната компартментализация на GtACR. Получените сома-насочени GtACRs показват подобрени фототокове, намалено аксоново възбуждане и висока чувствителност към светлина, позволяващи високоефективно инхибиране на невроналната активност в мозъка на бозайниците.
Въведение
Резултати
GtACR2 превъзхожда eACRs, но предизвиква антидромни скокове
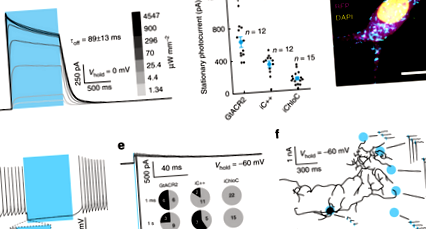
За да сравним полезността на nACRs с eACRs за заглушаване на невроните, първо изразихме три описани по-рано ACR със синя светлина, GtACR2 16, iC ++ 17 и iChloC 15, в култивирани неврони на хипокампални плъхове от аденоасоцииран вирус (AAV) - медииран трансфер на ген. Записите на целите клетъчни скоби от експресиращи GtACR2 неврони показват надеждни външни фототокове (фиг. 1а) в отговор на 470 nm светлинни импулси в пълно поле. Фототокът след 1 s непрекъснато осветяване (стационарен фототок) на GtACR2-експресиращи неврони, притиснати до -35 mV, е значително по-голям от този на конструираните ACR (eACRs) iC ++ и iChloC (628,5 ± 61,8 pA, 330,2 ± 37,9 pA и 136,3 ± 21,4 pA, съответно; Фиг. 1б). Като се има предвид лошото насочване към мембраната и вътреклетъчното натрупване на GtACR2 (фиг. 1в), високата едноканална проводимост на GtACR2 16 вероятно е причината за високите фототокове, наблюдавани в записите на цялата клетка.
GtACR2-медиираните антидромни пикове се намаляват от KCC2
Сома насочването на GtACR2 намалява аксоналното възбуждане
Само подобреното насочване към мембраната силно повишава вероятността за генериране на антидромни скокове (eGtACR2; фиг. 4а), докато насочването към сома не само увеличава фототоковете (фиг. 3ж), но също така намалява вероятността от индуциране на антидромни пикове в култивираните хипокампални неврони (фиг. 4а) . Дестабилизирането на stGtACR2 с помощта на PEST последователността доведе до по-слабо изразено намаляване на генерирането на антидромни пикове в сравнение със stGtACR2 (фиг. 4а). За да потвърдим, че намалената вероятност за генериране на антидромни пикове не се дължи на разликите в пиковите фототокове на различните конструкции в култивирани неврони, ние определихме количествено фототоковете в същите неврони (Фиг. 4b). За разлика от стационарните фототокове в експерименти с остри мозъчни срезове (фиг. 3g), пиковите фототокове в култивираните неврони не се различават значително между конструкциите, което показва по-ниска ефективност на насочване към мембраната в култивирани неврони или влияние на по-краткото време на инкубация на вируса. Въпреки това, следва, че драстичното намаляване на антидромния пик за stGtACR2 не се дължи на по-ниски фототокове.
Насочването на сома подобрява медиираното от GtACR2 заглушаване in vivo
Насочването на сома на GtACR2 намалява антидромния пик in vivo
Пространствена степен на заглушаване, медиирано от GtACR
Инхибирането на BLA с помощта на stGtACR2 уврежда страха от изчезване
Дискусия
За да определим дали повишената концентрация на хлорид в аксона наистина може да доведе до GtACR2-медиирано аксоново възбуждане, ние съвместно експресирахме транспортера KCC2 с GtACR2 в култивирани неврони. Ендогенният KCC2 транспортер, който се експресира в зрели неврони и е известно, че е отговорен за екструдирането на хлорид от соматодендритното отделение 51, отсъства от аксона 27,28,29, което потенциално позволява по-висока концентрация на хлорид в това отделение. Нашата констатация, че свръхекспресията на KCC2 е довела до значително намаляване на индуцираното от светлина антидромно пикиране, показва, че медиирано от ACR антидромно пикиране наистина може да бъде резултат от по-малък хлориден градиент в аксона, дори при възрастни неврони. Докато този антидромен фенотип с шипове вероятно няма да повлияе на дългосрочни експерименти с инхибиране (секунди и нагоре), може да е объркващ фактор, когато се изисква инхибиране в милисекунди. Бъдещата работа може да комбинира активирането на GtACR2 с изместените в червено хлоридни индикатори, за да се изследват директно промените в нивата на хлоридите в аксоналното отделение по време на ACR-медиирана хлоридна проводимост.
Точните параметри за невронално заглушаване зависят от експерименталната парадигма, включително вида на насочения неврон, нивото на експресия и метода на доставяне на светлина. Протоколите за доставка на светлина в идеалния случай трябва да се определят чрез електрофизиологична верификация. Когато преходните светлинни появяващи се антидромни пикове не са приемливи, използваната мощност на светлината трябва да бъде сведена до минимум. Това обаче води до ограничаване на адресируемия обем на мозъка, когато светлината се доставя с помощта на класически подход с оптични влакна. Новите методи за доставяне на светлина, които намаляват максималната плътност на мощността на местната светлина, могат да помогнат за преодоляване на това ограничение (конусно влакно 62). Възвратното възбуждане, потенциално поради освобождаването на синаптична депресия след продължително инхибиране, е потенциална забележка при всеки експеримент за оптогенетично заглушаване и трябва да се вземе предвид по време на експерименталното планиране и интерпретация на данните.
В обобщение, ние показахме, че насочването към мембраната и соматодендритното ограничение на естествено срещащия се анион-проводящ GtACR2 се справя с две важни ограничения на този родопсин, подобрявайки значително фототока и минимизирайки потенциала на антидромното действие в дисталните аксони. Успяхме да постигнем високоефективно оптогенетично заглушаване с оптимизираните варианти на stGtACR и демонстрирахме тяхната ефективност за временно прецизно in vivo заглушаване на невроналната активност в мозъка на мишката.
Методи
Производство на рекомбинантни AAV вектори
В това проучване са използвани следните вирусни вектори:
AAV2/1 & 2.hSyn1.GtACR2-eGFP.WPRE, AAV2/1 & 2.CamKIIα.GtACR2-ts-Fred-Kv2.1.WPRE, AAV2/1 & 2.CamKIIα.GtACR2-ts-Fred-ER.WPRE, AAV2/1 & 2. CamKIIα.GtACR2-ts-Fred-Kv2.1-PEST.WPRE, AAV2/1 & 2.CamKIIα.TagRFP-T.WPRE, AAV2/1 & 2.CamKIIα.eYFP.WPRE, AAV2/1 & 2.CamKIIα.iC ++ - eYFP.W AAV2/1 & 2.hSyn.iChlOC-eGFP.WPRE.
Първична хипокампална невронна култура
Първично култивирани хипокампални неврони са получени от мъжки и женски P0 Sprague-Dawley кученца (Envigo). CA1 и CA3 бяха изолирани, усвоени с 0,4 mg ml -1 папаин (Worthington) и поставени върху стъклени покривни стъкла, предварително покрити с 1:30 Matrigel (Corning). Култивираните неврони се поддържат в 5% CO2 овлажнен инкубатор със среда Neurobasal-A (Invitrogen), съдържаща 1,25% фетален говежди серум (FBS, Biological Industries), 4% добавка B-27 (Gibco), 2 mM глутамакс (Gibco) и се посяват върху покривни стъкла в плоча с 24 ямки с плътност от 65 000 клетки на ямка. За да се инхибира глиалният свръхрастеж, 200 µM флуородеоксиуридин (FUDR, Sigma) се добавя след 4 дни in vitro култура (DIV).
Трансфекция на калциев фосфат на култивирани неврони
Невроните бяха трансфектирани по метода на калциевия фосфат 64. Накратко, средата на първичните хипокампални неврони, култивирани в 24-ямкова плака, беше събрана и заменена с 400 µl безсерумна MEM среда (ThermoFisher научен). Тридесет микролитра трансфекционна смес (2 ug плазмидна ДНК и 250 цМ CaCl2 в HBS при рН 7.05) бяха добавени на гнездо. След 1 h инкубация клетките се промиват два пъти с MEM и средата се сменя обратно до събраната оригинална среда. Култивираните неврони са били използвани между 14-17 DIV за експерименти.
В това проучване са използвани следните плазмиди:
pAAV_hSyn1_GtACR2-eGFP_WPRE (на базата на подарък от Peter Hegemann, Addgene плазмид # 85463), pAAV_CamKIIα_mNeonGreen_WPRE, pAAV_CamKIIα (0.4kb) _mScarlet_WPRE_, p2IT ccm # tg.
Животни
Всички експериментални процедури бяха одобрени от Институционалния комитет по грижа и употреба на животните към Научния институт Weizmann. Шестседмични мишки C57BL/6 (P35-45) са получени от Envigo. До 5 мъжки или женски мишки C57BL/6 бяха настанени в клетка в светло-тъмно (12 h – 12 h) цикъл с храна и вода ad libitum. В зависимост от експеримента, мишките бяха настанени в продължение на 3–12 седмици след операцията, за да се даде възможност за възстановяване и експресия на вируса.
Стереотаксично инжектиране на вирусни вектори
Шестседмични мишки C57BL/6 (P35–45) първоначално бяха индуцирани с кетамин (80 mg kg -1) и ксилазин (10 mg kg -1) и поставени в стереотаксична рамка (David Kopf Instruments), преди изофлуран анестезия (
1% в O2, v/v). Направена е краниотомия (∼ 1 mm в диаметър) над мястото на инжектиране. Вирусните суспензии се инжектират бавно (100 nl min –1) с помощта на 34 G скосена игла (спринцовка Nanofil, World Precision Instruments). След инжектиране иглата се оставя на място за още 5 минути и след това бавно се изтегля. Хирургичната процедура или е продължена с имплантации на оптични влакна или оптично задвижване (описано по-долу), или хирургичният разрез е затворен с тъканно лепило и 0,05 mg kg -1 бупренорфин е инжектиран подкожно за следхирургична аналгезия. Инжекциите, насочени към медиалната префронтална кора (mPFC), са направени 1,8 mm отпред, 0,3 mm странично и 2,53 mm вентрално спрямо брегмата. Координатите на инжектиране на базолатерална амигдала (BLA) са 1,15 mm отзад, 3,0 mm странично и 5,0 mm вентрално спрямо брегмата. За mPFC инжекции се инжектира 1 µl от посочения вирус. За експерименти с изчезване на страх мишките бяха двустранно инжектирани с 500 nl AAV2/1 & 2.CamKIIα.stGtACR2-Fred.WPRE или AAV2/1 & 2.CamKIIα.eYFP.WPRE с геномен титър в диапазона 2–3 x 10 11 vp ml −1 .
Имплантация на оптични влакна и оптично задвижване
За фиброоптична имплантация беше направена краниотомия (∼ 1 mm в диаметър) над мястото на имплантиране и оптичното влакно с край на ферула (ThorLabs) беше поставено в желаните координати, използвайки стереотаксична рамка (David Kopf Instruments). За двустранно насочване на BLA върхът на влакното беше поставен 1,15 mm отзад, 3,0 mm странично и 4,8 mm вентрално спрямо брегмата. За ядрото на ядрото влакното е имплантирано под ъгъл 45 ° с накрайник, насочен отзад, за да се даде възможност за поставяне на оптично задвижване над mPFC при същите животни. Върхът на влакното беше насочен към край на 1,42 mm отпред, 1 mm странично и 5 mm вентрално към брегма. Оптичното влакно беше закрепено към черепа с помощта на Metabond (Parkell) и зъбен акрил. Контролните мишки не се инжектират с AAV, а се имплантират с оптродно устройство в mPFC и единично оптично влакно в ядрото accumbens. При мишки, обучени за страх от изчезване, се прилага допълнителен зъбен акрил във втората сесия под изофлуранова анестезия (
1% в O2, v/v) след изучаване на страха (ден 2). За имплантиране на оптично задвижващо устройство подвижното задвижване беше спуснато до първоначална позиция за запис над PL (AP: 1,8 mm, ML: 0,3 mm, DV: –2,3 mm). Преди трайното закрепване на оптрода към черепа, водачът на оптродите беше защитен със силиконов еластомер Kwik-Kast (World Precision Instruments) и закрепен с помощта на зъбен акрил. Мишките бяха оставени да се възстановят най-малко 6 седмици преди експериментите. Местоположенията на имплантирани оптични влакна и оптроди бяха валидирани хистологично за всички експериментални мишки.
Остра подготовка на мозъчен резен
Мишките се инжектират интраперитонеално с пентобарбитал (130 mg kg -1, ip) и се перфузират с карбонизиран (95% O2, 5% CO2) ледено студен разтвор за нарязване ([mM] 2,5 KCl, 11 глюкоза, 234 захароза, 26 NaHCO3, 1,25 NaH2PO4, 10 MgS04, 2 CaCl2; 340 mOsm). След обезглавяване, 300 µm коронални mPFC филийки се приготвят в карбонизиран ледено студен разтвор за нарязване с помощта на вибратом (Leica VT 1200 s) и се оставят да се възстановят в продължение на 20 минути при 33 ° C в газирана изкуствена цереброспинална течност с висока осмоларност (ACSF с висок Osm; [mM] 3.2 KCl, 11.8 глюкоза, 132 NaCl, 27.9 NaHCO3, 1.34 NaH2PO4, 1.07 MgCl2, 2.14 CaCl2; 320 mOsm), последвано от 40-минутна инкубация при 33 ° C в карбонизиран ACSF ([mM] 3 KCl, 11 глюкоза, 123 NaCl, 26 NaHCO3, 1,25 NaH2PO4, 1 MgCl2, 2 CaCl2; 300 mOsm). Впоследствие резените се държат при стайна температура (RT) в карбонизиран ACSF до употреба. Записващата камера беше перфузирана с карбонизиран ACSF със скорост 2 ml min –1 и поддържана при 32 ° C.
Електрофизиологични методи за in vitro записи
In vivo електрофизиология
Оптично заглушаване in vivo по време на обучение за изчезване
Оптогенетично заглушаване по време на ново изследване на околната среда
За всички условия, с изключение на състоянието „без светлина“, мишките са лишени от храна в продължение на 18 часа и след това са свързани към хордата на оптичния пластир и са въведени в обогатена среда за 75 минути Светлина (6 mW на върха на влакното) е непрекъснато доставяна към mPFC през това време. Околната среда се състоеше от кръгла арена (50 см в диаметър), съдържаща разпръснати хранителни пелети и беше слабо осветена (38–44 lux), за да се сведе до минимум стресът. След това мишките бяха отстранени от новата арена и умъртвени след допълнителни 15 минути. Мишките в групата без светлина не са имплантирани с оптични влакна.
Имунофлуоресценция и микроскопия
In vitro осветление и приложение на наркотици
Осветлението в цялото поле in vitro се извършва с помощта на 470 nm диод, излъчващ светлина (светодиод с честотна лента 29 nm; M470L2-C2; Thorlabs), доставен през пътя на осветяване на микроскопа, включително персонализиран дихроен, за да отрази дължината на вълната на активиране от 470 nm. Плътностите на мощността на светлината се изчисляват чрез измерване на светлината, пропусната през обектива с помощта на измервател на мощност (Thorlabs PM100A със сензор S146C) и разделяне на площта на осветеност, изчислена от номера на полето на обекта на микроскопа и увеличението 66. D-AP5 (25 цМ; ab120003; Abcam) и CNQX (10 цМ; C-141, аломон) се прилагат във вана по време на всички експерименти с култура. За пространствено ограничено осветяване на невронални соми или неврити, 473 nm диоден лазер (Bruker) е насочен към равнината на изобразяване с галванометрични огледала, като се получава дифракционно ограничено светлинно петно, което осигурява кратки светлинни импулси (1 ms) на всяко място, с Интервали между импулсите от 500 ms между несъседни места.
Анализ на данни и статистически методи
Наличност на данни
Данните, представени в това проучване, и персонализирани писмени кодове за анализ са достъпни от съответните автори при поискване. ДНК последователностите се депозират върху Addgene (ID 105669 и 105679).
- Билкова формула за отслабване със зелен чай и билки; Керстин; s Природни продукти за хора и домашни любимци
- Хуминова киселина - Най-добре пазената тайна на природата!
- Японска водна диета - Едно с природата
- Нарушен естествен имунитет, зависим от мастоцитите при комплементарни мишки с дефицит на С3
- Лида Отслабване - Доверие в природата