1 отдел по ендокринология, Политехнически университет в Марке, през Conca 71, 60126 Анкона, Италия
Резюме
Метаболитният синдром е комплекс от клинични характеристики, водещи до повишен риск от сърдечно-съдови заболявания и захарен диабет тип 2 и при двата пола. Висцералното затлъстяване и инсулиновата резистентност се считат за основните характеристики, определящи отрицателния сърдечно-съдов профил при метаболитен синдром. Целта на настоящата статия е да подчертае централната роля на затлъстяването в развитието на хронично нискостепенно възпалително състояние, което води до инсулинова резистентност, ендотелни и микроваскуларни дисфункции. Смята се, че началният сигнал за това възпаление е прехранването и началото на пътя във всички метаболитни клетки; последващото увеличаване на производството на цитокини набира имунни клетки в извънклетъчната среда, предизвиквайки цялостно системно възпаление. Тази статия се фокусира върху молекулярните и клетъчните възпалителни механизми, изследвани досега.
1. Въведение
Метаболитният синдром представлява едно от основните предизвикателства за общественото здраве в световен мащаб. Налични са различни дефиниции, описващи припокриващи се, но не идентични популации [1]. Първото описание датира от 1988 г., когато Ривън описва синдрома X като асоциация на инсулинова резистентност, повишена глюкоза, хипертония, нисък HDL холестерол и увеличени VLDL триглицериди [2]. Той обаче не включва затлъстяването, което сега е определено като един от основните критерии, особено висцералното затлъстяване [1].
Към момента наднорменото тегло и затлъстяването преминават към метаболитен синдром чрез патофизиологични механизми до голяма степен неясни. Предполага се, че състоянието на хронично нискостепенно възпаление, свързано с излишната мастна тъкан, може да обясни развитието на патологии, свързани със затлъстяването, като захарен диабет тип 2 и сърдечно-съдови заболявания. Тази възпалителна реакция се различава от класическата реакция, дефинирана от основните признаци на зачервяване, подуване, топлина и болка [3, 4]. Освен това, той играе важна роля в развитието на инсулинова резистентност, която предизвиква свързаните съпътстващи заболявания на метаболитния синдром, като атеросклероза, дислипидемия, хипертония, протромботично състояние и хипергликемия [5-8].
2. Метаболитен синдром
2.1. Разпространение и определение
Метаболитният синдром се идентифицира като състояние на повишен риск от сърдечно-съдови заболявания (ССЗ) и захарен диабет тип 2 (T2DM) и при двата пола. Субектите с метаболитен синдром имат три пъти риск да получат инфаркт или инсулт, два пъти да умрат от такова събитие и пет пъти по-голям риск от развитие на захарен диабет тип 2 в сравнение с хората без метаболитен синдром [9].
За първи път е описано през 1920 г., когато Kylin, шведски лекар, демонстрира връзката на високо кръвно налягане (хипертония), висока кръвна глюкоза (хипергликемия) и подагра [10]. По-късно през 1947 г. Vague описва, че висцералното затлъстяване често се свързва с метаболитните аномалии, открити при ССЗ и T2DM [11].
Разпространението на метаболитния синдром варира в зависимост от приложената дефиниция, етническата принадлежност и възрастта на изследваната популация. Двете използвани понастоящем дефиниции са тази на Американската асоциация по сърдечни заболявания/Национален институт за сърцето, белите дробове и кръвта (AHA/NHLBI), а другата - на Международната федерация по диабет (IDF). Те описват припокриващи се, но не идентични популации. Основната разлика е, че първият определя присъствието на три от пет възможни компонента, докато вторият определя в обиколката на талията и следователно в коремното затлъстяване задължителния диагностичен критерий (Таблица 1) [12, 13].
Както AHA/NHLBI, така и IDF признават необходимостта от променлива дефиниция на повишена обиколка на талията сред различните популации. IDF предлага за Europids праг за увеличена обиколка на талията от поне 94 см при мъжете и 80 см при жените; като има предвид, че AHA/NHLBI определя за населението на САЩ границата от най-малко 102 cm за мъжете и 88 cm за жените (Таблица 1) [12, 13]. Две важни проучвания показват обосновката за използването на различни гранични точки на обиколката на талията при хора с азиатски добив [14, 15]. Популациите от Източна Азия и Южна Азия могат да имат значителни разлики в липидните индекси, мастната маса като процент от ИТМ и сърдечно-съдовата заболеваемост. Необходими са повече проучвания, за да се изяснят тези различия, преди да се установи консенсус относно отделните отсечки за обиколката на талията за тези етнически групи [16].
3. Метаболитният синдром като състояние на риск
Очевидно е, че състояние, характеризиращо се с множество рискови фактори, ще носи по-голям риск за неблагоприятни клинични резултати.
Така наречените класически рискови фактори за сърдечно-съдови заболявания (ССЗ) и коронарна болест на сърцето (ИБС) включват много от компонентите на метаболитния синдром. Най-широко прилаганото уравнение за прогнозиране е оценката на риска на Framingham, по-малко валидирана за лица с T2DM, а не без T2DM [17]. Съвсем наскоро изследователите от Оксфорд разработиха механизъм за риск, базиран на голямата база данни на UK Prospective Diabetes Study (UKPDS) с валидирана оценка на риска от ССЗ за хора с T2DM [18–20]. И двата метода вземат предвид клиничните параметри, както и възрастта, тютюнопушенето, кръвното налягане и серумните нива на липидите. Рисковият механизъм UKPDS включва също продължителност на диабета и нивата на глюкоза в плазмата.
4. Затлъстяване
4.1. Разпространение и определение
Затлъстяването е метаболитно заболяване с пандемичен дял. Световната здравна организация изчислява, че 300 милиона възрастни в цял свят са с наднормено тегло и повече от 1 милиард са с наднормено тегло [21].
Затлъстяването обикновено се класифицира в подгрупи в зависимост от подозираната етиология: моногенно затлъстяване, синдромно затлъстяване и полигенно или често затлъстяване [22].
Моногенното затлъстяване е автозомна форма, характеризираща се с изключително тежко затлъстяване при липса на забавяне в развитието; има около 20 единични генни смущения, които водят до автозомна форма на затлъстяване [23]. Интересното е, че всички тези мутации позиционират пътя на лептина/меланокортина в централната нервна система (ЦНС) като критичен при регулирането на енергийната хомеостаза на цялото тяло, а затлъстяването в тези случаи изглежда е резултат от повишен апетит и намалена ситост [24].
Синдромното затлъстяване възниква от дискретни генетични дефекти или хромозомни аномалии на няколко гена и може да бъде автозомно или X-свързано. Те са клинично затлъстели субекти, допълнително отличаващи се с умствена изостаналост, дисморфични черти и специфични за органа аномалии в развитието; една от най-известните форми на синдромно затлъстяване е синдромът на Prader-Willi [22].
Най-често срещаната форма на затлъстяване, която засяга общата популация, е полигенната форма, получена в резултат на дългосрочен положителен енергиен баланс; излишъкът от енергия се съхранява в мастната тъкан и ако този процес се удължи, се развива затлъстяване. Балансът между енергийния прием и разход се влияе от сложното взаимодействие на генетични, екологични и социални фактори. При често затлъстяване някои все още неясни сигнали водят до инсулинова резистентност и до рискове за здравето, като повишен риск от ССЗ [25].
Положителният енергиен баланс или затлъстяването също могат да бъдат вторични за системните нарушения: хипотиреоидизмът намалява енергийната нужда, инсулиномът причинява затлъстяване чрез насърчаване на енергийния прием чрез повтаряща се хипогликемия, а болестта на Кушинг е свързана със затлъстяването от класическия центростремителен тип. Други етиологични фактори на затлъстяването включват разстройство на преяждането, високогликемична диета, заседнал начин на живот и употреба на някои лекарства като психотропни лекарства [26].
Затлъстяването е мощен рисков фактор за метаболитни и сърдечно-съдови заболявания на популационно ниво. На ниво индивидуален пациент обаче корелациите между индекса на телесна маса и сърдечно-съдовите заболявания не винаги са ясни, отчасти поради разликите между депата на мастната тъкан по отношение на общия процент на дисфункция на адипоцитите, васкуларизация на тъканите и локална степен на възпаление. Мастната тъкан се развива в няколко различни анатомични депа в тялото и диференциалното разширяване на тези депа е от голямо значение. Разширяването на висцералната или коремната бяла мастна тъкан (WAT) е най-силно свързано с инсулиновата резистентност и сърдечно-съдовите заболявания при хора и животни. Няколко проучвания са документирали, че периферното затлъстяване (особено мазнините в краката) може да предпази от сърдечно-съдов риск [27, 28].
5. Затлъстяване и възпаление
Един аспект на предизвикателството на метаболитния синдром е разбирането на клетъчните механизми, които свързват метаболитните аномалии с патофизиологичните ефекти, които по-късно генерират клинично заболяване.
Връзката между затлъстяването и възпалението е получена от констатацията, че проинфламаторните цитокини са свръхекспресирани при затлъстяване [29].
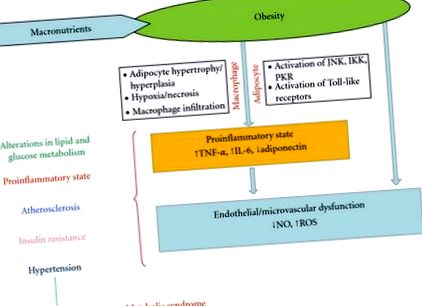
Мастната тъкан е хетерогенна смес от адипоцити, стромални преадипоцити, имунни клетки и ендотел и може да реагира бързо и динамично на промени в излишъка на хранителни вещества чрез хипертрофия на адипоцитите и хиперплазия [30]. При затлъстяване и прогресивно увеличаване на адипоцитите, кръвоснабдяването на адипоцитите може да бъде намалено с последваща хипоксия [31]. Предполага се, че хипоксията е подбуждаща етиология на некроза и инфилтрация на макрофаги в мастната тъкан, която води до свръхпроизводство на възпалителни фактори като възпалителни хемокини. Това води до локализирано възпаление в мастната тъкан, което разпространява цялостно системно възпаление, свързано с развитието на съпътстващи заболявания, свързани със затлъстяването [32]. Тази статия ще се фокусира върху три адипокина, произведени от макрофаги: фактор на туморна некроза-алфа (TNF-α), интерлевкин-6 (IL-6) и адипонектин [33].
TNF-α. Това е проинфламаторен цитокин, който оказва многобройни ефекти в мастната тъкан, включително липиден метаболизъм и инсулинова сигнализация, чиито нива на циркулация се увеличават при затлъстяване и намаляват с отслабване. Увеличение на TNF-α насърчава секрецията на други провъзпалителни цитокини IL-6 и TNF-α, и намалява противовъзпалителните цитокини като адипонектин [34]. Доказателствата сочат, че TNF-α индуцира апоптоза на адипоцитите [35] и насърчава инсулиновата резистентност чрез инхибиране на сигналния път на инсулиновия рецептор субстрат 1 [36].
IL-6.Основният източник на циркулиращ IL-6 са макрофаги, които са проникнали в WAT; IL-6 има важна роля в регулирането на енергийната хомеостаза и възпаление на цялото тяло. Както in vitro, така и in vivo проучванията потвърждават, че IL-6 е способен да потиска липопротеин липазната активност. IL-6 рецепторът се експресира и в няколко области на мозъка, като хипоталамуса, в който контролира апетита и приема на енергия [37].
Адипонектин. Доказано е, че загубата на тегло повишава нивата на адипонектин; при животински модели на затлъстяване и инсулинова резистентност нивата му са намалени. Адипонектинът регулира метаболизма на липидите и глюкозата, повишава чувствителността към инсулин, регулира приема на храна и телесното тегло и предпазва от хронично възпаление [38]. Проучванията при хора показват, че хипоадипонектинемията е свързана с инсулинова резистентност, хиперинсулинемия и възможността за развитие на диабет тип 2, независимо от мастната маса [39].
Хипотезата е, че хранителните вещества са не себе си и следователно предизвикват имунен отговор, когато се метаболизират, или те са естествено свързани с възпалителни молекули, освободени в циркулацията [47, 48]. При слаби здрави животни по време на храненето възниква слаб пулсиращ възпалителен отговор и отзвучава след метаболизирането на хранителните вещества [40, 41]. При затлъстяване или при прехранване реакциите стават по-интензивни, а разтварянето по-малко ефективно. Тези сигнали се натрупват с течение на времето и могат да достигнат ниво, при което професионалните имунни клетки се набират и активират, което води до неразрешен възпалителен отговор в тъканта [43, 45]. Качеството на диетата може да доведе до различни реакции: съобщава се, че диета, богата на плодове и фибри, не предизвиква значително възпаление в сравнение с еднокалоричната диета с високо съдържание на мазнини [49].
6. Инсулинова резистентност и ендотелна/микроваскуларна дисфункция
Възпалението при затлъстяване води до инхибиране на сигналната каскада на инсулиновия рецептор: трите описани по-горе кинази, JNK-IKK-PKR, могат да се насочат към инсулиновия рецепторен субстрат 1 (IRS-1) за сериново фосфорилиране и разграждане [6–8].
Инсулинът има важни ефекти върху ендотела, като увеличава наличността на азотен оксид (NO) и стимулира вазодилатацията [50]. За разлика от тях, инсулиновата резистентност е свързана с ендотелна дисфункция. [51, 52].
Ендотелната и микроваскуларната дисфункция присъстват при затлъстели лица и представляват важни фактори в метаболитните нарушения, тъй като те могат да повлияят както на съдовата резистентност, така и на изхвърлянето на глюкоза, медиирана от инсулин, допринасяйки за хипертония и инсулинова резистентност при затлъстяване [52, 53].
Ендотелната дисфункция е ранен процес при затлъстяване: налице е дори при липса на хипертония или хипергликемия и е свързана с висцерално затлъстяване, което предполага, че затлъстяването е независим рисков фактор. Характеризира се с нарушена ендотелиозависима вазодилатация, намалено артериално съответствие и ускорен процес на атеросклероза [54].
Предполага се, че има възпалителна етиология както за затлъстяването, така и за атеросклерозата [55-57]. Имунните клетки играят важна роля във всички етапи на атеросклеротичния процес [58]; при пристрастяване, намаляването на NO, ключов регулатор на ендотелната хомеостаза и увеличаването на активните видове кислород водят до ендотелна дисфункция и проатерогенно съдово легло [59].
Следователно, Gavin и колеги демонстрират микроваскуларна дисфункция при затлъстели лица, което води до намаляване на капилярната плътност в скелетните мускули и кожата в сравнение с слабите индивиди. Това води до притъпен отговор на вазодилатация, предизвикан от орално натоварване с глюкоза, вероятно поради нарушено капилярно набиране в отговор на повишено ниво на плазмен инсулин. Наблюдава се и намаляване на транскапилярното доставяне на инсулин до мускулите при затлъстели пациенти [60].
7. Ефектът на различните терапевтични подходи върху възпалителните маркери
Като се има предвид възпалителното състояние, предизвикано от затлъстяването, проучвания от литературата оценяват терапевтичните интервенции чрез намеса в възпалителните медиатори.
При пациенти със захарен диабет тип 2 експресията на панкреатичния IL1-рецепторен антагонист (IL-1Ra) е намалена и високите концентрации на глюкоза индуцират производството на IL-1 в β-клетки, водещи до нарушена секреция на инсулин, намалена клетъчна пролиферация и апоптоза. Larsen et al., Използвайки анакинра, рекомбинантен човешки IL-1Ra, при 70 пациенти със захарен диабет тип 2, наблюдават след 13 седмици подобрено β-клетъчна секреторна функция (намалено ниво на гликиран хемоглобин, повишена секреция на С-пептид, намалено съотношение на проинсулин към инсулин) и намаляване на IL-6 и С-реактивен протеин, маркери на системно възпаление [61]. Същите автори в 39-седмично проследяващо проучване изследват трайността на тези отговори: поддържат се намаленото съотношение проинсулин/инсулин и серумните нива на CRP и IL-6. Подобрението в β-клетъчната функция може да бъде следствие от инхибирано сигнализиране за IL-1, а не само от подобрена гликемия per se [62].
При затлъстели хора се наблюдават повишени циркулиращи нива на TNF-α; предлага се това събитие да бъде причинително свързано с развитието на инсулиновата резистентност, диабет тип 2 и неговите усложнения.
Проучвания върху животни, които показват, че намесата в TNF-α сигнализирането предпазва от развитие на метаболитен синдром при затлъстяване и проучвания при пациенти с хронични възпалителни състояния, като ревматоиден артрит и псориазис, ясно показват, че гасенето на TNF-α активност подобрява инсулиновата чувствителност [63, 64].
Като алтернатива са проведени някои проучвания, за да се демонстрира ефектът от TNF-α неутрализиране на инсулиновата чувствителност при пациенти с диабет тип 2: повечето от тях не показват осезаем ефект на TNF-α неутрализация на инсулиновата чувствителност [65–67]. Основата за този спор е неясна, но може да се отнася до изследваните популации пациенти или продължителността на клиничните изпитвания; всички тези проучвания потенциално не позволяват достатъчно време за нормализиране на метаболитните нарушения. Всъщност по-скоро, дългосрочно проучване, проведено при затлъстели лица с промени в глюкозата и субклинично възпаление, лекувани с етанерцепт, TNF-α антагонист, откри подобрена глюкоза на гладно, повишено съотношение на адипонектин с високо молекулно тегло (HMW) към общ адипонектин и намалена разтворима вътреклетъчна адхезионна молекула-1 (sICAM) [68].
Тези доказателства обаче поставят под въпрос дали в TNF-α е причинно-следствена връзка между затлъстяването и инсулиновата резистентност [69].
Тиазолидиндионите (TZD), клас мощни агонисти на активирания от пероксизома пролифератор рецептор-γ (PPARγ), увеличавайки активирането на този транскрипционен фактор в мастната тъкан, възстановява липогенната функция и намалява възпалението [70]. TZD също блокират способността на TNF-α за промяна на най-проксималните стъпки на инсулиновата сигнализация чрез сериново фосфорилиране на инсулиновия рецептор и увеличаване на експресията на адипонектин [71]. Едно проучване in vitro демонстрира, че адипонектинът проявява мощни имуносупресивни свойства, индуцирайки производството на противовъзпалителни медиатори IL-10 и IL-1 рецепторен антагонист (IL-1Ra) в различни видове миелоидни клетки. IL-10 може да инхибира производството на много други възпалителни цитокини, включително IL-1, IL-2, INFγ, и TNF-α и уврежда фагоцитния и изцяло стимулиращ капацитет на макрофагите [72].
В допълнение, адипонектинът чрез регулирането на IL-10 повишава нивата на тъканния инхибитор металопротеиназа-1 (TIMP-1) в човешки макрофаги, предотвратявайки извънклетъчната деградация [73].
8. Заключения
Връзката между висцералното затлъстяване и метаболитния синдром е добре известна, но патофизиологичните механизми, които обясняват тази връзка, не са напълно изяснени. Метаболитният синдром е комплекс от клинични характеристики, най-важният от които е повишено депо на висцералните мазнини. Затлъстяването води до провъзпалително състояние, започващо в метаболитните клетки (адипоцити, хепатоцити или миоцити) и също така набира имунни клетки с последващо освобождаване на възпалителни цитокини (TNF-α, IL-6, адипонектин и др.). Предполага се, че индуцираният от затлъстяването възпалителен процес може да доведе до усложнения като хипертония, атеросклероза, дислипидемия, инсулинова резистентност и захарен диабет, които характеризират метаболитния синдром (Фигура 1), но са необходими и други изследвания, за да се съсредоточи върху ролята на мастната тъкан в патогенезата на захарен диабет и сърдечно-съдови заболявания.
Препратки
- Изчистването на чернодробния инсулин е тясно свързано с компонентите на метаболитния синдром Диабетна грижа
- Връзка между чревните бактерии, затлъстяването и откритата имунна система; Интелигентен живот
- Малко известният протеин играе важна роля при затлъстяването и метаболитните заболявания Наскоро
- JCI - Възпалителни механизми, свързващи затлъстяването и метаболитните заболявания
- Тук; s какво трябва да знаете за връзката между затлъстяването и индекса на телесна маса PhillyVoice