Аника Кучманнова
1 Катедра по фармакогнозия и ботаника, Фармацевтичен факултет, Университет Коменски, Odbojárov 10, Братислава 83232, Словакия; ks.abinu.mrahpf@avonnamzcuk (A.K.); ks.abinu.mrahpf@avokinemak (M.K.); ks.abinu.mrahpf@avolaif (S.F.); ks.abinu.mrahpf@ygan (M.N.)
Андреа Балажова
2 Катедра по клетъчна и молекулярна биология на лекарствата, Фармацевтичен факултет, Университет Коменски, Kalinčiakova 8, Братислава 83232, Словакия; ks.abinu.mrahpf@avozalab
Ева Рачанска
3 Катедра по фармакология и токсикология, Фармацевтичен факултет, Университет Коменски, Odbojárov 10, Братислава 83232, Словакия; ks.abinu.mrahpf@aksnacar
Мирослава Каменикова
1 Катедра по фармакогнозия и ботаника, Фармацевтичен факултет, Университет Коменски, Odbojárov 10, Братислава 83232, Словакия; ks.abinu.mrahpf@avonnamzcuk (A.K.); ks.abinu.mrahpf@avokinemak (M.K.); ks.abinu.mrahpf@avolaif (S.F.); ks.abinu.mrahpf@ygan (M.N.)
Силвия Фиалова
1 Катедра по фармакогнозия и ботаника, Фармацевтичен факултет, Университет Коменски, Odbojárov 10, Братислава 83232, Словакия; ks.abinu.mrahpf@avonnamzcuk (A.K.); ks.abinu.mrahpf@avokinemak (M.K.); ks.abinu.mrahpf@avolaif (S.F.); ks.abinu.mrahpf@ygan (M.N.)
Ярослав Майерник
4 Катедра по медицинска информатика, Медицински факултет, Университет Pavol Jozef Šafárik, Trieda SNP 1, Košice 04011, Словакия; [email protected]
Милан Наги
1 Катедра по фармакогнозия и ботаника, Фармацевтичен факултет, Университет Коменски, Odbojárov 10, Братислава 83232, Словакия; ks.abinu.mrahpf@avonnamzcuk (A.K.); ks.abinu.mrahpf@avokinemak (M.K.); ks.abinu.mrahpf@avolaif (S.F.); ks.abinu.mrahpf@ygan (M.N.)
Питър Гал
1 Катедра по фармакогнозия и ботаника, Фармацевтичен факултет, Университет Коменски, Odbojárov 10, Братислава 83232, Словакия; ks.abinu.mrahpf@avonnamzcuk (A.K.); ks.abinu.mrahpf@avokinemak (M.K.); ks.abinu.mrahpf@avolaif (S.F.); ks.abinu.mrahpf@ygan (M.N.)
5 Катедра по фармакология, Медицински факултет, Университет Pavol Jozef Šafárik, Trieda SNP 1, Кошице 04011, Словакия
6 Отдел за биомедицински изследвания, Източно-словашки институт за сърдечно-съдови заболявания, Inc., Ondavská 8, Кошице 04011, Словакия
Павел Мучаджи
1 Катедра по фармакогнозия и ботаника, Фармацевтичен факултет, Университет Коменски, Odbojárov 10, Братислава 83232, Словакия; ks.abinu.mrahpf@avonnamzcuk (A.K.); ks.abinu.mrahpf@avokinemak (M.K.); ks.abinu.mrahpf@avolaif (S.F.); ks.abinu.mrahpf@ygan (M.N.)
Резюме
Захарният диабет (СД) често се диагностицира в момент, когато пациентите вече страдат от няколко сърдечно-съдови усложнения. Нашите предварително публикувани данни (Molecules 201520 (11): 20538-50) за антиоксидантните свойства на Agrimonia eupatoria L. (AE) и Cynara cardunculus L. (CC) ни подтикнаха да разширим наличните доказателства за възможните им защитни дейности върху избрани параметри, свързани с DM, в стрептозотоцин-индуциран модел на DM плъх и в поредица от експерименти in vitro. Мъжките плъхове бяха разделени на четири групи: контролна група, нелекувана група с диабет, AE и CC, лекувани с диабет. По време на петседмичен период се проследяват промените в кръвната захар и телесното тегло. След това плъховете бяха умъртвени и подложени на оценка на промените в реактивността на аортите и измерване на активността на бутирилхолинестеразата. За да завърши панела от експерименти, активността на α-глюкозидазата се оценява in vitro. Нашите резултати показват, че и двата тествани екстракта проявяват подобни антидиабетни дейности. По-добрата антиоксидантна активност на екстракта от A. eupatoria обаче показва неговия по-висок клиничен потенциал в профилактиката и/или адювантната терапия при развитие на сърдечно-съдови усложнения, свързани с DM и заболявания, свързани с оксидативен стрес.
1. Въведение
Захарният диабет (СД) е хронично метаболитно заболяване с огромни социални, здравни и икономически последици [1]. Съответно, DM принадлежи към водещите глобални рискове за смъртност в световен мащаб, тъй като заболяването води до повече смъртни случаи на пациенти, отколкото например ХИВ/СПИН [1]. DM намалява способността на организма да регулира ефективно нивата на кръвната захар, което води до развитие на усложнения, свързани с диабета. Диабетните съдови усложнения (DVC) са свързани с най-важните животозастрашаващи, придружаващи DM. Трябва да се отбележи, че приблизително 25% от новодиагностицираните пациенти със ЗД тип 2 вече страдат от DVC, което вероятно означава, че те са недиагностицирани СД в продължение на поне пет години [2]. От друга страна, пациентите с ДМ тип 1 често се диагностицират с наличие на кетоацидоза [3].
Терапията DM, тип 1 и 2, има за цел да контролира и възстанови глюкозната хомеостаза както в постпрандиалното, така и в гладно състояние [4,5]. Първата стъпка в управлението на тип 2 DM представлява промени в начина на живот и диетата, които трябва да предшестват фармакологичния подход [2]. Вече е известно, че нивата на глюкозата могат да се контролират по различни пътища, а именно чрез намаляване на абсорбцията на глюкоза и отделянето на глюкоза от черния дроб, повишаване на секрецията на инсулин от панкреаса, чувствителност към инсулин и използване на периферна глюкоза [4]. В този контекст в клиничната практика са използвани няколко вида антидиабетици. Пероралните антидиабетни средства, използвани като лечение на тип 2 DM, включват бигуаниди, сулфонилурейни продукти, тиазолидиндиони и инхибитори на α-глюкозидазата [6,7]. Когато пероралната терапия се провали, лечението се основава на прилагането на инкретинови миметици и техните подобрители, както и на инсулиноподобен растежен фактор, и накрая на прилагането на човешки рекомбинантен инсулин, който е най-добрата терапевтична възможност за тип 1 DM [7] . В допълнение към неблагоприятните ефекти, медикаментозното лечение не винаги е ефективно за поддържане на евгликемия и избягване на късни стадии на усложненията на СД [8], които често са по-лоши при СД тип 1.
Въпреки че известната употреба на растително лечение на DM е датирана още през 1550 г. пр. Н. Е., Антидиабетната фитотерапия е драстично намалена след въвеждането на съвременните фармакотерапевтични средства [9]. В предишното ни проучване стандартизирахме съдържанието на полифенол в Agrimonia eupatoria L. и Cynara cardunculus L. и сравнихме техните антиоксидантни свойства. Показахме, че екстрактите от A. eupatoria и C. cardunculus съдържат близо 8% от общите полифеноли и са в състояние да защитят клетките и тъканите срещу окислителни увреждания, действащи както като радикални чистачи, така и чрез повишаване на антиоксидантната активност [10]. Демонстрирано е също така, че водните екстракти на A. eupatoria проявяват „подобна на инсулина“ активност, което също подтиква нашето текущо проучване [11,12,13]. Тъй като екстрактите от C. cardunculus намаляват нивата на глюкоза след хранене при плъхове с диабет [14,15,16], ние поставяме това растение за сравнение с A. eupatoria и в това проучване.
За да оценим потенциалната антидиабетна активност на растенията, споменати по-горе, определихме инхибиторния ефект на нивата на α-глюкозидаза и серумна глюкоза. За завършване на панела от експерименти бяха използвани инхибиране на напредналите крайни продукти за гликиране (AGEs), активността на бутирилхолинестеразата (BuChE), реактивността на аортите и измерването на телесното тегло за оценка на защитните свойства на растенията срещу развитието на DVC.
2. Резултати и дискусия
2.1. Инхибиране на активността на α-глюкозидазата
Инхибиторите на α-глюкозидазата са специално разработени, за да забавят разцепването на олиго- и полизахаридите до монозахариди и по този начин да намалят постпрандиалната хипергликемия [6]. Няколко растения са добре известни със своите инхибиращи активността на α-глюкозидазата. По-специално се предполага, че флавоноидите и терпеноидите са активните съединения, отговорни за тези инхибиторни дейности [17]. Нашите резултати показват, че водният екстракт от A. eupatoria е отличен инхибитор на α-глюкозидазата с IC50 = 46,31 ± 8,76 μg/mL (Фигура 1), което е в съгласие с предварително публикувани данни [11]. За съжаление, тестваният воден екстракт от C. cardunculus не надвишава 50% от инхибирането (Фигура 1), поради което IC50 не е определен. Две хипотези могат да обяснят наблюдаваната неефективност на екстракта. Първо, протоколът за екстракция, описан във Pharmacopoeia Bohemoslovaca, не ни позволява да постигнем ефективна концентрация на съединение, сравнима с други проучвания [15,17]. На второ място, може също да се предположи, че екстрактните съединения, инхибиращи активността на α-глюкозидазата, не присъстват в тестваните екстракти.
Инхибиране на α-глюкозидазата от водни екстракти от A. eupatoria (IC50 = 46.31 ± 8.76 μg/ml) и C. cardunculus (не е постигната IC50). Данните са показани като средна стойност ± SD и са сравнени с помощта на еднопосочен ANOVA, последван от тест на Tukey-Kramer post-hoc.
Преди това бяха изследвани антиоксидантни и α-глюкозидазни инхибиторни дейности на избрани съединения, изолирани от Agrimonia pilosa [17]. Тук флавоноидните и тритерпеноидните съединения се оказаха ефективни инхибитори на α-глюкозидазата в зависимост от дозата (IC50 = 1,67–41,67 μg/ml) [17]. Този инхибиторен ефект на α-глюкозидазата е регистриран и по време на няколко експеримента, проведени с пет различни растителни екстракта от рода Agrimonia (Agrimonia eupatoria L., Agrimonia procera Wallr., Agrimonia leucantha Kze., Agrimonia japonica (Miq.) Koidz. И Agrimonia coreana Nak.) [11].
От клинична гледна точка основното предимство на ежедневната употреба на α-глюкозидазни инхибитори е относително ниската честота на хипогликемия [6]. От друга страна, неблагоприятните ефекти на α-глюкозидазните инхибитори (напр. Акарбоза, миглитол) са стомашно-чревни оплаквания, включително метеоризъм и дискомфорт в корема, в резултат на малабсорбция и следователно повишена ферментация на въглехидрати [6,7]. Общоприето е обаче, че бавното увеличаване на дозата подобрява стомашно-чревната поносимост.
2.2. Инхибиране на формирането на AGE
Терапевтичните стратегии, предотвратяващи развитието на DVC, включват прилагане на инхибитори на гликиране, формиране на AGE, активиране на RAGE (рецептори за AGE) и протеинови инхибитори на кръстосано свързване, както и противовъзпалителни и антиоксидативни агенти [4,18]. Настоящият експеримент разкрива висока антигликационна активност на двата екстракта в модела BSA-GLC (говежди серумен албумин-глюкоза) (ранен етап на гликиране) (Фигура 2). IC50 на A. eupatoria се определя при 156.48 ± 70.75 μg/mL, а този на C. cardunculus при 223.61 ± 36.33 μg/mL.
Инхибиране на образуването на AGE (крайни продукти за гликиране) от водни екстракти на A. eupatoria и C. cardunculus в модела BSA-GLC (говежди серумен албумин-глюкоза). Данните са показани като средна стойност ± SD и са сравнени с помощта на еднопосочен ANOVA, последван от тест на Tukey-Kramer post-hoc.
Различни растителни екстракти, богати на полифеноли, показват антиоксидантни и антигликационни дейности, сравними с A. eupatoria и/или C. cardunculus [19,20,21]. Преди това съобщавахме за високо съдържание на полифенол и в двата водни екстракта [10], което може да представлява начина, по който тези растения инхибират развитието на DVC.
2.3. Ефект на A. eupatoria и C. cardunculus върху нивата на серумна глюкоза и телесното тегло
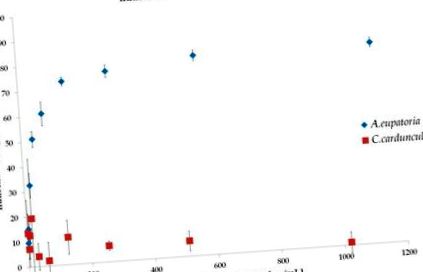
В настоящото проучване се интересувахме дали протоколът за екстракция, описан във Pharmacopoeia Bohemoslovaca [22], притежава значителни антидиабетни свойства, както е описано по-рано [9,12,13,14,15,16,23,24]. Ние показахме, че ежедневното перорално приложение на екстракт от C. cardunculus значително намалява гликемията след приложение на стрептозотоцин (STZ), но екстрактът от A. eupatoria няма антигликемичен ефект (Фигура 3 а). Въпреки че в настоящото проучване ефектът на A. eupatoria (0,2 mg/ml) не е бил значителен, няколко проучвания са доказали, че водният екстракт от растението (1 mg/ml) упражнява „инсулиноподобна“ активност чрез поне три потенциални механизма, т.е. стимулиране на транспорта на 2-дезокси-глюкоза, окисляване на глюкоза и включване на глюкоза в гликоген [12,13]. Доказано е също така, че водният екстракт от A. eupatoria стимулира глюкозо-независимата секреция на инсулин в β-клетките на панкреаса BRIN-BD11 [12,13,23,24]. По-нататъшното изследване на потенциалните механизми също разкрива, че A. eupatoria намалява загубата на тегло, полидипсията и хиперфагията при плъхове с диабет [9,12,23,24]. Следователно, нашите резултати показват, че процедурата за екстракция, използвана в настоящия експеримент, не е достатъчна за постигане на необходимата концентрация на съединение със значителни антидиабетни свойства.
Ефект на водни екстракти от A. eupatoria и C. cardunculus върху плазмените нива на глюкоза (а) и телесно тегло при плъхове (° С). Статистическо сравнение на нивата на глюкозата (б) и телесно тегло (д) между отделни групи (CI - 95% поверителен интервал, C - контролна група, UD - нелекувана диабетна група, AED - A. диабетна група, лекувана с евпатория, CCD - C. диабетна група, лекувана с кардункул) Данните са показани като средна стойност ± SD и са сравнени, като се използва двупосочен ANOVA, последван от Tukey post-hoc тест.
Друг потенциален механизъм, чрез който C. cardunculus може да участва в регулацията на гликемията, представлява нейният антихипергликемичен ефект [14,15,16]. Предполага се, че препаратите от C. cardunculus са способни да намалят нивата на кръвната захар на гладно и след хранене при нормални и затлъстели плъхове [14], както и при избрани индивиди с тип 2 DM [16]. От тази гледна точка естествените лекарства, съдържащи C. cardunculus, се препоръчват като хранителни добавки за пациенти с ДМ тип 2 [16]. Точният антихипергликемичен механизъм на C. cardunculus обаче все още е неизвестен. Може да се предположи, че високото съдържание на груб фураж в артишок подобрява ситостта и по този начин индиректно намалява гликемията [14,15,16,25].
Симптомите на изразена хипергликемия често включват полиурия, полидипсия, замъглено зрение, умора, гадене, световъртеж, нарушено зарастване на рани и загуба на тегло [6]. Тъй като загубата на тегло принадлежи към типичната проява на DM тип 1 [26], телесното тегло беше измерено в началото на експеримента, както и една и пет седмици след приложението на STZ. Няколко проучвания върху животни са забелязали, че растителните екстракти и/или изолирани растителни съединения са способни да минимизират загубата на телесно тегло в индуцирания от STZ модел на DM [26,27]. Независимо от това, в настоящия експеримент, продължителното приложение нито на A. eupatoria, нито на C. cardunculus обръща отрицателното влияние на приложението на STZ върху телесното тегло (Фигура 3 в).
2.4. Определяне на активността на BuChE
Общоприето е, че BuChE се е превърнал в терапевтична цел и ефективен маркер, предсказващ ранното развитие на тип 2 DM [28]. Следователно, в настоящия експеримент, активността на BuChE също се определя от всяка чернодробна проба (Фигура 4). Най-ниската измерена активност на BuChE е регистрирана в нелекуваната диабетна група. Лечението с двата тествани растителни екстракта значително повишава активността на BuChE, но все пак остава значително по-ниско, отколкото в контролната група.
- Билка Agrimony, прах, 1 унция (Agrimonia eupatoria) - Penn Herb Co
- Люцерна (Agrimonia Eupatoria) 60 VCap; Хранене
- Билка Agrimonia eupatoria билка за здравето
- Африканско манго за отслабване Не толкова бързо! Журнал за хранителни вещества
- Есенна тема за отслабване на света за поддръжка 2019 - MoneySavingExpert Forum