Фолатните антагонисти са служили добре на медицинската наука и трябва да продължат да го правят като биохимични сонди, като същевременно остават клинично важни лекарства при лечението на пациенти с неопластични и не-неопластични заболявания.
Свързани термини:
- Ензим
- Протеин
- Диария
- Метотрексат
- Токсичност
- Гадене
- Дихидрофолатна редуктаза
- Фолиева киселина
Изтеглете като PDF
За тази страница
Взаимодействие на химиотерапия и лъчение
Кристофър Дъглас Уили,. Джеймс А. Бонър, в Клинична радиационна онкология (Четвърто издание), 2016
Антифолати: метотрексат, триметрексат и пеметрексед
Антифолатът, метотрексат, здраво свързва дихидрофолат редуктазата (DHFR), като по този начин инхибира метаболизма на фолатите. Чрез това инхибиране се блокира синтеза на тимидилат и по този начин биосинтезата на пурин. В допълнение, някои аминокиселинни синтези са нарушени чрез блокада на този ензим, което води до цитотоксичност. 43 Пеметрексед е пиролопиримидин, който функционира като антифолат, който инхибира множество ензими, включително тимидилат синтаза, дихидрофолат редуктаза, глицинамид рибонуклеотид формил-трансфераза и аминоимидазол карбоксамид формил-трансфераза по независим от клетъчния цикъл начин. Пеметрексед е ефективен срещу много солидни тумори и е показал радиосенсибилизация, подобрена в предклинични системи. 44,45,46
Нарушения на развитието
Антагонисти на фолиевата киселина
Преди това антагонистите на фолиевата киселина, за които е известно, че са силно ембриолетални, са били използвани в клинични изпитвания като аборти (агенти, причиняващи аборт). Въпреки че три четвърти от бременността са прекъснати, почти една четвърт от ембрионите, които са оцелели до изтичане, са били сериозно деформирани. Класически пример за ембриотоксичен антагонист на фолиевата киселина е аминоптерин, което произвежда множество тежки аномалии като аненцефалия, забавяне на растежа, цепнатина на устната и небцето, хидроцефалия, хипопластична долна челюст и ниско поставени уши. Тези драматични ефекти на антагонистите на фолиевата киселина подчертават важността на адекватните количества фолиева киселина в диетата за насърчаване на нормалното развитие.
Насочване на тимидилат синтазата от антифолатни лекарства за лечение на рак
АН Л. ДЖАКМАН,. МАТЮ НГ, в Проектиране и откриване на лекарства за рак, 2008 г.
9.7.1 Предклинична
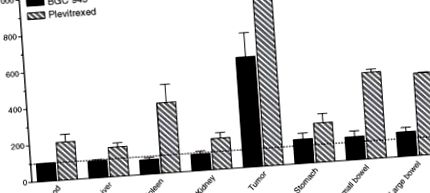
В KB клетките BGC 945 IC50 за инхибиране на растежа е ∼3 nM и това се увеличава до ∼5 μM, когато се добави 1 μM фолиева киселина, за да инхибира конкурентно свързването на BGC 945 с α-FR. Фолиевата киселина има много нисък афинитет към RFC (> 100 μM), така че 1 μM не инхибира медиираното от RFC поглъщане на стандартните антифолатни лекарства. Сравнителните данни в Таблица 9.1 показват колко значително по-насочен е BGC 945 към α-FR-положителните KB клетки в сравнение с другите антифолати. Подобен опит е намерен в клетки A431, трансфектирани с α-FR (A431-FBP) (Таблица 9.1, Фигура 9.3). Туморните клетки, експресиращи по-ниски нива на α-FR, също са чувствителни към BGC 945, въпреки че много ниски експресиращи линии се възползват от продължителното излагане на лекарството, за да се увеличи броят на кръговете на рецептор-медиирана ендоцитоза и натрупване на лекарство (Gibbs et al., 2005 ).
ФИГУРА 9.4. Ефект на BGC 945 и плевитрексед върху биоразпределението на [125 I] dUrd при KB мишки, носещи тумор. [125 I] dUrd е Thd аналог и е включен в ДНК чрез активността на TK. Повишеното включване е маркер за инхибиране на TS (подробности в Gibbs et al., 2005). [125 I] dUrd се инжектира в мишки 24 часа след 100 mg/kg 6R, S-BGC 945 (твърда лента) или 100 mg/kg плевитрексед (райета). Тъканите бяха отстранени за преброяване на гама 24 часа по-късно и резултатите са представени като процентни контролни стойности.
Въпреки предупрежденията относно нивата на Thd в плазмата при мишки, бяха проведени антитуморни проучвания при KB мишки, носещи тумор. Ежедневното приложение в продължение на 14 дни (100 mg/kg) предизвика приблизително 5-дневно забавяне на растежа в два независими експеримента (непубликувани данни). В момента BGC 945 е в предклинично развитие.
Патогенеза на ускорена атеросклероза и съдови наранявания при системен лупус еритематозус
Метотрексат
Антагонистът на фолиевата киселина метотрексат (MTX) проявява различни противовъзпалителни ефекти и се е доказал като ефективен при лечението на редица автоимунни заболявания, включително RA, псориазис и SLE. Доказано е, че 163 MTX инхибира пролиферацията на Т-клетките, понижава регулирането на експресията на адхезионните молекули и модулира производството на цитокини и MMPs, 164 предполагайки, че може да показва кардиопротективни ефекти. 165 При миши модел на възпалителна васкулопатия, приложението на MTX значително намалява интрамиокардната васкулопатия и отслабва увреждането на крайните органи. 166 MTX също демонстрира кардиопротективни ефекти при пациенти с автоимунни заболявания. 167 Въпреки това, ролята на MTX за предотвратяване на ССЗ при пациенти със СЛЕ остава да бъде определена.
Нуклеотиден метаболизъм
Инхибиране на биосинтеза на фолати
Синтетичните антифолатни лекарства като триметоприм са токсични за много бактерии и се използват за лечение на бактериални инфекции. Аналозите са мощни инхибитори на дихидрофолат редуктазата, ензимът, който катализира редукцията на дихидрофолат до тетрахидрофолат. Тази реакция е единствената, чрез която дихидрофолатът, образуван при синтеза на тимидилат, може да бъде превърнат в тетрахидрофолат. Микроорганизмите, устойчиви на триметоприм, свръхпродуцират тимидилат синтаза или дихидрофолат редуктаза. Комбинация от сулфонамид (напр. Сулфаметоксазол), структурен аналог на р-аминобензоена киселина и триметоприм или сродни аналози са мощни инхибитори на бактериалния растеж и се използват при лечението на инфекции с бактерии като Е. coli и салмонела. Заедно тези съединения действат чрез изчерпване на вътреклетъчното ниво на тетрахидрофолатни производни, което води до недостиг на нуклеотиди.
Резистентност към лекарства
Лори Хейзлхърст, Майлс Хакър, по фармакология, 2009 г.
15.2.1.2 Протеини за приемане на наркотици в лекарствена резистентност
Класическият антифолатен метотрексат МТХ продължава да бъде важен компонент на химиотерапевтичния армаментариум за различни видове рак, включително детски ALL, остеогенен сарком, лимфом и рак на гърдата. Ралтитрексед, друг антифолат, се използва в голяма част от света извън САЩ за напреднал колоректален рак. И накрая, Пеметрексед е одобрен през 2004 г. за лечение на плеврален мезотелиом и малко след това като лечение от втора линия за недребноклетъчен рак на белия дроб. Тези лекарства имитират естествената фолатна молекула и по този начин използват мембранно свързаната протеинова система с редуциран фолат (RFC), за да получат влизане в клетката.
RFC трябва активно да транспортира достатъчно нива на несвързано лекарство, за да осигури вътреклетъчни концентрации на лекарства, достатъчни да поддържат инхибирането на целевия ензим дихидрофолат редуктаза (DHFR) и за синтеза на полиглутаматизирани антифолати, формата за съхранение на тези лекарства. Всъщност антифолатната резистентност поради намалената експресия на RFC е цитирана в литературата от 1962 г. и оттогава се очертава като важен механизъм на резистентност към класическите антифолати.
Загубата на RFC функция може да възникне чрез намалена експресия на протеина и по този начин намалени нива на мембранно свързан RFC. След като RFC беше клониран, стана очевидно, че дълбоките загуби на RFC транспорт и антифолатна устойчивост са свързани с мутации в RFC. Тези мутации доведоха до намален транспорт на лекарството или без загуба на транспортиране на наркотици и огромно увеличение на транспорта на фолиева киселина. Тъй като антифолатите се конкурират за свързването на DHFR с нормални редуцирани фолати, увеличеният транспорт на фолати осигурява на клетките толкова голяма полза, колкото и намаленият антифолатен транспорт.
Индукция на автофагична клетъчна смърт от противоракови агенти
Антиметаболити
Антифолатният и антиметаболитовият пеметрексед вече се използва клинично за лечение на недребноклетъчен белодробен карцином (NSCLC). Пеметрексед пречи на клетъчния метаболизъм и води до повишени нива на 5-аминоимидазол-4-карбоксамид-1-b-D-рибофуранозил монофосфат (ZMP), което води до активиране на AMPK, който от своя страна инактивира mTORC1. Крайният резултат е повишена автофагия. Доказано е, че лечението с пеметрексед на ракови клетки на гърдата води до намаляване на жизнеспособността на клетките, ефект, блокиран от 3-МА или от нокдаун на BECN1 (Bareford et al., 2011). Комбинация на пеметрексед с друг индуктор на автофагия, рапамицин, допълнително повишена токсичност на пеметрексед при множество видове туморни клетки.
Друг модулатор на метаболизма е 3-бромопируват (3-BP). При поглъщане в клетките чрез семейство 16 разтворени носители (SLC16), 3-BP инхибира комплекс II на митохондриалната дихателна система (сукцинат дехидрогеназа) чрез заместване на нейния нормален субстрат пируват. 3-BP лечението води до намаляване на нивата на ATP, образуване на реактивни кислородни форми (ROS) и метаболитен оксидативен стрес, водещ до клетъчна смърт. Този ефект може дори да бъде засилен чрез предварително гладуминово гладуване на раковите клетки, като по този начин улеснява клетъчното усвояване на 3-BP. При отнемане на глутамин, 3-BP-индуцирана карциномна клетъчна смърт не е извършена чрез апоптоза, но показва особености на ACD, както е видно от нарастването на автофагичния поток и значително намаляване на клетъчната смърт чрез химически (3-MA) или генетични (siRNA- медиирано Atg5 нокдаун) инхибиране на автофагичната машина (Cardaci et al., 2012). Предполага се, че кандидатите за медитация за ACD, стимулирани от 3-BP и ROS, са митоген-активирана протеин киназа 8 (MAPK8/JNK), AMPK и свързаната със смъртта протеин киназа (DAPK1).
Съвременни медицински терапии за улцерозен колит
Матю Чеа, доктор по медицина, Reena Khanna, магистър по болести на Pouchitis и Ileal Pouch, 2019
Метотрексат
Антагонист на фолиевата киселина, MTX действа предимно чрез инхибиране на дихидрофолат редуктазата, ключов ензим в синтетичния път за производство на пурини и пиримидини [72]. Като се има предвид, че до една трета от пациентите не реагират на тиопурини, като до 15% не могат да понасят тези агенти от странични ефекти, MTX се използва като алтернативно стероидно щадящо средство [73]. В единственото досега контролирано плацебо проучване, Oren et al. завърши ретроспектива, сравнявайки MTX с плацебо в UC. След 9 месеца няма значителна разлика в индукцията и поддържането на ремисия [74]. Има ограничени данни в подкрепа на MTX като ефективно спомагателно средство при зависими от стероиди индивиди. Малко проучване установи, че оралното MTX в доза от 15 mg/седмица дава възможност за остро намаляване на употребата на кортикостероиди, въпреки че това не се поддържа до края на 76-седмичното проследяване. Както бе споменато по-горе, Maté-Jiménez et al. сравнени 6-MP, MTX и 5-ASA за индукция и поддържане на ремисия при стероидно-зависими пациенти с UC. Тук те съобщават 6-MP като по-ефективно средство от MTX и 5-ASA както при индукция, така и при поддържане на ремисия при тези пациенти [64] .
Като се имат предвид относително ниските дози, използвани в ранните опити на MTX, Carbonnel et al. в проучването METEOR се търси да се установи дали по-висока доза парентерално MTX (25 mg/седмица) е ефективна от плацебо при индуциране на ремисия без стероиди на 16 седмици при 111 пациенти, зависими от стероиди с UC. За съжаление, проучването не достига статистическа значимост в основната си крайна точка (MTX 31,7% спрямо плацебо 19,6%, P = .15), въпреки че анализ на подгрупа отбелязва, че групата на MTX има по-голям процент от пациентите, постигнали ремисия без стероиди, което води до по-малко оттегляния от терапията (41,7% срещу 23,5%, P = .04) [75]. Понастоящем се провеждат редица опити за по-нататъшно изследване на ефикасността на парентералния MTX за постигане на ремисия без стероиди [76, 77] .
- Тежест на затлъстяването - общ преглед на ScienceDirect теми
- Антиалергични - общ преглед на ScienceDirect теми
- Аскорбинова киселина - общ преглед на ScienceDirect теми
- Дискинезия на жлъчните пътища - общ преглед на темите ScienceDirect
- Фиброаденома на гърдата - общ преглед на ScienceDirect теми