Резюме
Заден план
Царевично изсушените дестилатори на зърна с разтворими вещества (cDDGS) са страничен продукт от производството на биогорива и алкохол. cDDGS се използват от много години във фуражите за свине, тъй като са лесно достъпни и богати на протеини, фибри, ненаситени мастни киселини и фитостероли. Въпреки това, фуражните смеси, твърде високи в cDDGS, водят до влошаване на качеството на задните мазнини. Извършихме РНК-секвениращ анализ на задните мазнини от кръстосани свине, хранени с различни диети. Диетите бяха изоенергични, но съдържаха различни количества cDDGS и различни източници на мазнини. Животните бяха разделени на четири диетични групи през двата месеца на експерименти: група I (контрол (-cDDGS + рапично масло)), група II (+ cDDGS + рапично масло), група III (+ cDDGS + говежди лой) и група IV (+ cDDGS + кокосово масло). Целта на настоящия експеримент беше да се оценят промените в гръбначния транскриптом на прасета, хранени с изоенергични диети, които се различават в присъствието на cDDGS.
Резултати
Чрез софтуера DESeq2 идентифицирахме 93 диференциално експресирани гена (DEG) между групи I и II, 13 между групи I и III и 125 между групи I и IV. DEG, идентифицирани между група I (-cDDGS + рапично масло) и група II (+ cDDGS + рапично масло), бяха силно представени в няколко KEGG пътища: метаболитни пътища (FDR)
Заден план
Оптималната стратегия за хранене на селскостопански животни е един от основните фактори, определящи рентабилността на производството на месо. cDDGS (зърнени дестилатори с царевица с разтворими вещества) често се използва като заместител на соевото брашно в фуражите поради високото съдържание на протеини и фибри, разумна цена и наличност. Въпреки това задните мазнини от животни, хранени с диети, съдържащи cDDGS, са меки и склонни към окисляване [1]. Мазнини, съдържащи големи количества наситени мастни киселини, като телешки лой или кокосово масло, се добавят към фуража, за да се противодейства на това влошаване на качеството на задните мазнини. Такива cDDGS също са предложени за използване при диети при хора, особено при пациенти с диабет и целиакия [1]. Интересното е, че преди десетилетие благоприятният ефект на DDGS върху исхемичната болест на сърцето беше постулиран и патентован от Службата за патенти и търговски марки на САЩ (патент на САЩ № 2004/0234630) [2]. В момента с нарастващото производство на биогорива наличността на cDDGS е висока; употребата му при човешките диети обаче остава незначителна. Разбирането на молекулярните процеси, които се случват в животинските тъкани след консумацията на cDDGS и различни мазнини, би могло да разреши съмненията около употребата на тези съединения като фураж и като част от придружаващото хранене на животни и хора.
Към днешна дата няколко експеримента разкриха, че храненето може да предизвика промени в транскриптома и специфичните метаболитни пътища [3]. Peñagaricano et al. (2014) наблюдават забележими различия в генната експресия в мастната тъкан между фетусите на овцете, чиито майки са били хранени с диети с cDDGS и тези, чиито майки са били хранени с други изоенергетични диети по време на бременност [4]. Много от тези гени са участвали в адипогенезата, липогенезата и развитието на мастната тъкан. Предполагаме, че тези наблюдения може да са от значение за други видове бозайници. Следователно, ние имахме за цел да оценим дали добавянето на cDDGS към диетата на прасетата променя транскриптома на задните мазнини. Напоследък прасетата се превърнаха в обещаваща алтернатива на моделите на гризачи поради прилики с хората по отношение на размера на органите и физиологията [5]; следователно резултатите от нашето проучване могат да предоставят информация относно възможността за използване на cDDGS като добавка за здравето в диетата на човека.
Целите на настоящото проучване бяха да се оценят промените в гръбначния транскриптом на прасета, хранени с изоенергични диети, които се различават по съдържанието на cDDGS и източниците на мазнини. Освен това възнамерявахме да оценим потенциалните взаимодействия между cDDGS и съставите на мастните киселини в диетата.
Резултати
Ефективността и качеството на подкожната подкожна мазнина на животните след различни диетични процедури
Ефективността на животните и качеството на задните мазнини са описани подробно другаде за следните диетични лечения: контрол - група I (-cDDGS + рапично масло), група II (+ cDDGS + рапично масло), група III (+ cDDGS + говежди лой) и група IV (+ cDDGS + кокосово масло) [6, 7]. Накратко, различните диетични лечения не повлияват наддаването на тегло, използването на фуража, дебелината на задните мазнини или месото на трупа. Обратната мазнина от животни, получаващи cDDGS и рапично масло в тяхната фуражна смес (група II), показва най-ниското съотношение на сумата на наситените мастни киселини към сумата на ненаситените мастни киселини (SFA: UFA) и най-високото C18: 2 линолова киселина съдържание и йодна стойност (стр 1 беше между 13 148–14 391 в зависимост от пробата.
Диференциално експресирани гени (DEG), идентифицирани чрез RNA-seq анализ
В настоящото проучване класифицирахме гените като диференциално изразени, когато промяната на гънките беше> ± 1,3 и коригирана стр-Стойността беше Таблица 1 Избрани параметри на производителност и качество на обратната мазнина
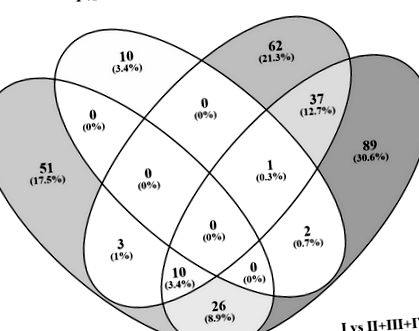
Сравнението на DEG списъците с интегриращия инструмент на Venny (http://bioinfogp.cnb.csic.es/tools/venny/index.html) разкри 39 (13,3%) общи гена между (група I срещу група II) и (група I срещу II + III + IV), 48 (16,4%) общи гена между (група I срещу група IV) и (група I срещу група II + III + IV) и само 3 (1%) общи гени между (група I срещу група III) и (група I срещу група II + III + IV) (Фиг. 1).
Диаграмата на Venn показва общи DEG сред четири сравнения: (група I срещу група II), (група I срещу група III), (група I срещу група IV) и (група I срещу II + III + IV)
Функционален анализ на идентифицирани DEG
За да направим правилни изводи за ефекта на всеки хранителен фактор върху биологичните процеси, молекулярните функции и пътищата, ние анализирахме всеки набор от данни на DEG поотделно и не анализирахме DEG от сравнение (група I срещу група II + III + IV). Направихме няколко анализа, за да идентифицираме свръхпредставени DEG, използвайки системата за класификация PANTHER. Най-интересните резултати бяха получени, когато DEGs свръхекспресирани в група I (-cDDGS + рапично масло) бяха сравнени с тези от група II (+ cDDGS + рапично масло) (47 картографирани гена от 49 DEG). DEGs са участвали главно в следните пътища: метаболитни процеси, биосинтетичен процес на мастни киселини, метаболитен процес на липиди и метаболитен процес на коензими (Таблица 3). Много от тези гени кодират ензими, които катализират метаболитните процеси; следователно каталитичната активност и лигазната активност бяха свръхпредставени сред молекулните функции. Свръхекспресираните гени бяха свръхпредставени в няколко пътища на Reactome, от които най-значим беше ChREBP, който активира метаболитната генна експресия (FDR Фиг. 2
Мрежа от взаимодействащи протеини, получени след анализ на софтуер за биоинформатика String 10.0 (http://string-db.org) на DEG при (–cDDGS + рапично масло) спрямо (+ cDDGS + рапично масло) сравнение. а DEGs регулирани в (+ cDDGS + рапично масло), б DEGs, регулирани в (+ cDDGS + гени от рапично масло)
За по-нататъшен анализ на функцията на гените, регулирани от cDDGS, ние предложихме набор от гени с висока увереност, които бяха диференцирано изразени и в двата анализа DESeq2 (група I срещу група II и група I срещу група II + III + IV) (Таблица 4) и забелязва, че според литературата много от тях са потенциални терапевтични цели при затлъстяване, диабет и сърдечно-съдови и невродегенеративни заболявания.
Валидиране на RNA-seq анализ чрез qPCR
Извършихме qPCR анализ на осем гена, пет от които бяха регулирани надолу (ACACA, ACLY, FASN, FITM2, и АЛАС) и три от които бяха регулирани (VSIG4, C5AR1, и MS4A2) в група II (+ cDDGS + рапично масло) (Допълнителен файл 1: Таблица S1). Резултатите от qPCR анализ за всяка диетична група са представени на фиг. 3. Статистическият анализ с GLM процедура разкрива значението на диетата за ACACA, FITM2, ALAS1, MS4A2 и VSIG4 израз, докато за ACLY, FASN и C5AR1 се наблюдават тенденции (стр 2 = 0,99) между резултатите от qPCR и RNA-seq е много значим, при стр Фиг. 3
Резултати от qPCR анализ на избрани гени във всяка диетична група: група I (-cDDGS + рапично масло), група II (+ cDDGS + рапично масло), група III (+ cDDGS + говежди лой), група IV (+ cDDGS + кокосово масло ) след GLM процедура с диета и секс като фиксирани фактори. *стр-стойност 0,1
Дискусия
Биосинтезата на мастни киселини се регулира от cDDGS
Окислителното фосфорилиране се регулира от cDDGS
Имаше няколко регулирани гена (ALAS1, CYB5B, PDHX, и ТОЧНО) (Фиг. 3б), които са свързани и с двата гореспоменати процеса: метаболизъм на мастните киселини и клетъчно дишане. ТОЧНО катализира синтеза на ацетилкоензим А, който е основният субстрат в биосинтеза на мастни киселини, както и в TCA цикъла, докато АЛАС 1 катализира биосинтеза на хем за цитохром Р450, крайният оксидазен ензим във веригата на електронен трансфер. Наскоро беше предложено биосинтезата на хема да е свързана с адипогенезата чрез митохондриална дихателна активност [34]. Изследователите предполагат, че биосинтезата на хема е необходима за постигане на оптимална диференциация на адипоцитите чрез поддържане на митохондриалната функция.
Каскадата на комплемента и коагулацията се регулира от cDDGS
В случай на cDDGS, факторът, който може да активира комплементната система, може да бъде бета-глюкан, който е елемент от диетични фибри от зърнен произход, който може да присъства и в клетъчните стени на дрождите. Повишено регулиране на гените на възпалението и имунитета се наблюдава при прасета, хранени с диета с високо съдържание на мазнини и богата на мазнини [15]. Изследователите заключават, че хранителните мазнини и фибри могат да имат антагонистичен ефект върху провъзпалителните и противовъзпалителните сигнални пътища. Въпреки това, противно на нашите резултати, тези изследователи наблюдават имунната генна модулация само в периреналната мазнина, но не и в подкожната мастна тъкан. Възможно е cDDGS да има много по-силни ефекти от фибрите от слама, което да доведе до модулация на генната експресия и в подкожната мастна тъкан. От друга страна, такава реакция може да бъде резултат от присъствието на микотоксини в cDDGS. Биохимичният анализ не откри такова замърсяване в храната ни; поради широкия набор от замърсители на фуражите обаче не може да се изключи напълно.
Ограничението на нашето проучване е, че нашето наблюдение не е доказано при използване на in vitro култивирани свински адипоцити; обаче този експеримент за целия геном потвърди няколко предишни доклада за in vitro и in silico взаимодействия между регулаторни гени на биосинтеза на мастни киселини и гени, кодиращи ензими, участващи в този процес в човешки и миши клетки [16, 17]. Включването на двата пола в експеримента също може да се счита за ограничение; обаче, за да оценим възможното пристрастие, направихме DESeq2 анализ на 6 проби от група I срещу 6 проби от група II с балансирани полове и установихме, че разликите са незначителни. Идентифицираните ключови гени са сред статистически значимите гени и в двата анализа (Допълнителен файл 4: Таблица S4). Освен това функционалният анализ със софтуера String показа, че гените, ангажирани в обсъжданите пътища (биосинтез на мастни киселини, окислително фосфорилиране и каскада на комплемента и коагулацията), са свръхпредставени в този набор от данни (Допълнителен файл 4: Таблица S4). Някои съмнения могат да възникнат от факта, че диетите, съдържащи cDDGS, са имали малко по-високо съдържание на мазнини от останалите диети, но разликата е била само
4%, което не е достатъчно, за да предизвика индивидуално такива промени в транскриптома.
Заключения
В момента затлъстяването, сърдечно-съдовите и невродегенеративните заболявания са едни от основните причини за смърт във високо развитите страни. Този проблем също започва да включва домашни животни като кучета или котки и cDDGS изглежда е продукт, който може да противодейства на тези нарушения. Резултатите от нашето изследване показват, че добавянето на cDDGS към диетата води до намаляване на експресията на гени, участващи в липогенезата и клетъчните дихателни процеси, като същевременно стимулира гените на имунната система. Използването на този продукт в диети за добитък в продължение на много години показва относителната безопасност на cDDGS; необходими са обаче допълнителни проучвания върху лабораторни животни и in vitro култури, за да се разберат напълно молекулярните механизми, които се активират след добавянето на cDDGS. Освен това изолирането на биологично активни компоненти на cDDGS и изследването на тяхната активност би било полезно при оценката на потенциала на cDDGS като здравословен компонент на диетата.
Материали и методи
Животни и диети
Всички процедури, включени в това проучване, свързани с употребата на живи животни, бяха съгласувани с местната Етична комисия за експерименти с животни в Краков (Резолюция № 912, от 26.04.2012 г.).
РНК изолация, RNA-seq и qPCR процедури
Валидирането на резултатите от RNA-seq беше извършено за 8 гена (ACACA, ACLY, FASN, ALAS1, FITM2, C5AR1, VSIG4, MS4A2) чрез количествена PCR в реално време (qPCR). CDNA е синтезирана с cDNA Archive Kit (Thermo Fisher Scientific, Waltham, MA). QPCR се извършва в два екземпляра на инструмент QuantStudio 7 Flex (Thermo Fisher Scientific, Waltham, MA) под бързия термичен профил. Реакционната смес съдържа 1 μl cDNA, 5 μl GoTaq® qPCR Master Mix (Promega Corporation, Madison, WI), 0,1 μl CXR багрило, 3,23 μl вода, 0,17 μl 60 × TaqMan анализ за OAZ1 (ендогенен контрол) усилване (Идентификационен номер на анализа: Ss03397505_u1) и 0,5 μl от 20 × тест за експресия на TaqMan ген за амплификация на целевия ген (ACACA ID за анализ: Ss03389963_m1, ACLY ID за анализ: Ss03389566_m1, FASN ID за анализ: Ss03386194_u1, ALAS1 за анализ ID: Ss04652684_m1, FITM2 за анализ ID: Ss03267236_m1, MS4A2 S1 за ID3 S4 ID4 S03, и C5AR1 ID за анализ: Ss03375530_u1). Относителното количествено определяне (RQ) на всяка проба се изчислява въз основа на метода ΔΔCt с помощта на QuantStudio PCR софтуер в реално време.
- Променете живота си за 60 минути; Семинари за здраве, начин на живот и подобряване на диетата за служители
- Сменете диетата, добавете първо леща; ЕДИНСТВЕНО Естествена енергия
- Замразени; Замразена суха диета за сурова храна за котки Северозападни натурали
- Глава 5 Перфектната диета от палеофантазия, месо, зърнени храни и готвене; Палеофантазия
- Хранене на висококонцентрирана диета от царевичен слама, предизвикана от епигенетични промени в млечната тъкан на