Нарастващата честота на захарен диабет тип 1 (T1DM) при деца представлява един от основните здравословни проблеми в световен мащаб. Широко разпространено е мнението, че T1DM се причинява от автоимунното разрушаване на β-клетките, произвеждащи инсулин в панкреаса, поради отклонен имунен отговор на Т-клетките. Към днешна дата няма ефективни терапевтични стратегии за предотвратяване на T1DM, тъй като клиничните му симптоми стават очевидни едва когато повечето β клетки вече са унищожени. Освен това, клиничните изпитвания за превенция на T1DM при деца в риск досега са били неуспешни. Интригуващо е, че последните проучвания включват промени в чревната микробна флора (т.е. микробиота) като потенциален етиологичен фактор за T1DM, повишавайки възможността намесата в микробите, населяващи нашето тяло, да представлява обещаващ подход за предотвратяване или управление на T1DM. Нови доказателства, силно подкрепящи тази хипотеза, идват от ключово проучване на Мариньо и др., 1, който показва, че диета, способна да модулира активността на чревната микробиота, наистина може да инхибира появата на заболяването в миши модел на T1DM. Като цяло тези открития проправят пътя за разработване на хранителни диетични подходи за предотвратяване на деца с висок риск от развитие на T1DM.
T1DM е многофакторно заболяване, което се предизвиква от фактори на околната среда, действащи върху сложен, предразполагащ генетичен фон, който включва сътрудничеството на множество гени, сред които алелите на човешкия левкоцитен антиген (HLA) изглежда играят основна роля. През последните две десетилетия честотата на T1DM непрекъснато нараства със скорост от
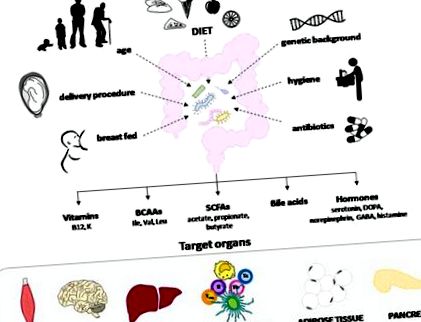
2–4% годишно в световен мащаб. Съвсем наскоро се съобщава за увеличаване на честотата на T1DM при деца на възраст под 5 години както в Европа, така и в САЩ, тенденция, която корелира с нарастващия брой индивиди, които нямат предразполагащите HLA алели. 2, 3 В този сценарий наблюдението, че мигрантите са склонни да придобият същия риск от развитие на T1DM като този на дългосрочните жители, доведе до хипотезата, че околната среда и начинът на живот са ключови фактори за развитието на T1DM. По този начин през последните години се провеждат непрекъснати изследователски усилия, насочени към определяне кои фактори на околната среда, влияещи на пренаталния и ранен живот на индивида, наистина участват в патогенезата на T1DM. Интригуващо е, че редица майчини и хигиенни фактори, както и антибиотично лечение, оказват влияние върху състава и активността на чревната микробиота при кърмачета и деца, което предполага, че развитието на T1DM може да възникне поради промяна на чревната флора (Фигура 1).
Чревната микробиота се влияе от няколко фактора, включително храненето на майката, вида на раждането, възрастта, генетичния произход, хигиенните условия, антибиотичното лечение и факторите за ранна диета. Той влияе върху имунния отговор на лигавицата и целостта на лигавичната бариера, с ефекти върху системния имунитет и възпалението. Това отчасти се дължи на производството на сигнални метаболити, насочени към ендокринните, невроналните и имунните клетки на червата и черния дроб и влиянието на метаболизма на липидите и глюкозата. BCAA, аминокиселини с разклонена верига; SCFAs, късоверижни мастни киселини.
Чревната микробиота представлява сложна, симбиотична екологична общност, която участва в няколко физиологични дейности, които се споделят с гостоприемника. Освен това, той може да повлияе на метаболизма на липидите и глюкозата и имунния отговор на лигавицата, както и на целостта на лигавичната бариера, като по този начин повлиява системния имунитет и възпалението. Това отчасти се дължи на производството на сигнални метаболити, насочени към ендокринните, невроналните и имунните клетки на червата и черния дроб. Те могат да включват късоверижни мастни киселини (SCFA), витамини, аминокиселини, жлъчни киселини и хормони. 5, 6 Въпреки че няколко скорошни проучвания предполагат, че промените в коменсалната микробиота (т.е. дисбиозата) могат да модулират риска от T1DM, те не са успели да открият участващите механизми.
В статия, публикувана в майския брой на Природна имунология, Мариньо и колеги демонстрират, че това може да бъде постигнато чрез диетичен подход при мишки без затлъстяване (NOD), често срещан животински модел на T1DM. Тези мишки развиват T1DM на 10–20-седмична възраст, с по-висока честота при жените (60–80%), отколкото при мъжете (20–30%), а появата на заболяването се предшества от абнормна лимфоцитна инфилтрация на панкреатичните островчета (т.е., инсулит). Въпросната статия показва, че храненето на тези мишки с диети, съдържащи големи количества от две SCFA, а именно ацетат и бутират, значително инхибира началото на заболяването, като максималният ефект се получава, когато двете добавки се дават едновременно.
Мишките с диабет без затлъстяване (NOD) са животински модел на T1DM. Болестта се влияе от чревната микробиота. Началото на заболяването се предшества от развитието на възпалителна инфилтрация, която е богата на Т-клетки, в панкреатичните островчета (инсулит). Диетите, които освобождават големи количества от два SCFAs, ацетат (FED-A) или бутират (FED-B), в червата значително предотвратяват появата на заболяване при NOD мишки. Обогатената с ацетат диета действа предимно чрез намаляване на активирането на автоимунните ефекторни Т клетки и е свързана с увеличаване на Bacteroides. Горните ефекти са минимални или липсват при FED-B мишките. За разлика от тях, тези мишки показват експанзия на Treg клетки, които защитават целостта на лигавичната бариера, като увеличават експресията на оклудин в плътни кръстовища в дебелото черво.
Въпреки че констатациите на Мариньо и др. отварят вълнуващи нови перспективи по отношение на превенцията на T1DM, по-нататъшен анализ на данни и нови маркери са явно необходими, за да се определи дали диетичният подход може да бъде ефективен през ранния живот, когато чревната микробиота силно влияе върху имунната хомеостаза на червата. 12, 13 През следващите години, независимо от полезните му ефекти срещу T1DM, лекарствената храна има потенциала да се превърне в революционен подход без лекарства, с който да модулира имунната система на децата, за които съображенията за безопасност на лекарствата са задължителни. И така, момчета, готови ли сте за здравословно хранене?
Препратки
Mariño E, Richards JL, McLeod KH, Stanley D, Yap YA, Knight J и др. Чревните микробни метаболити ограничават честотата на автоимунните Т-клетки и предпазват от диабет тип 1. Nat Immunol 2017; 18.: 552–562.
Patterson CC, Dahlquist GG, Gyürüs E, Green A, Soltész G, EURODIAB Study Group. Тенденции на заболеваемост при детски диабет тип 1 в Европа през 1989–2003 г. и прогнозирани нови случаи 2005–20: многоцентрово проспективно проучване за регистрация. Лансет 2009; 373: 2027–2033.
Insel R, Dunne JL. Визията и стратегията на JDRF за профилактика на диабет тип 1. Педиатър Диабет 2016 г .; 17 (Suppl 22): 87–92.
Rewers M, Ludvigsson J. Екологични рискови фактори за диабет тип 1. Лансет 2016 г .; 387: 2340–2348.
Clarke G, Stilling RM, Kennedy PJ, Stanton C, Cryan JF, Dinan TG. Миниревю: чревна микробиота: пренебрегваният ендокринен орган. Mol Endocrinol 2014; 28: 1221–1238.
Husted AS, Trauelsen M, Rudenko O, Hjorth SA, Schwartz TW. GPCR-медиирано сигнализиране на метаболити. Cell Metab 2017; 25: 777–796.
Dianzani U, Chiocchetti A, Ramenghi U. Роля на наследствените дефекти, намаляващи Fas функция при автоимунитет. Life Sci 2003; 72: 2803–2824.
DeFranco S, Bonissoni S, Cerutti F, Bona G, Bottarel F, Cadario F и др. Дефектна функция на Fas при пациенти с диабет тип 1, свързани с други автоимунни заболявания. Диабет 2001; 50: 483–488.
Comi C, Fleetwood T, Dianzani U. Ролята на апоптозата на Т-клетките в автоимунитета на нервната система. Autoimmun Rev 2012; 12: 150–156.
Lee YK, Menezes JS, Umesaki Y, Mazmanian SK. Провъзпалителните Т-клетъчни отговори на чревната микробиота насърчават експерименталния автоимунен енцефаломиелит. Proc Natl Acad Sci САЩ 2011; 108 (Suppl 1): 4615–4622.
Dunne JL, Triplett EW, Gevers D, Xavier R, Insel R, Danska J и др. Чревният микробиом при диабет тип 1. Clin Exp Immunol 2014; 177: 30–37.
Nishio J, Honda K. Имунорегулация от чревната микробиота. Cell Mol Life Sci 2012; 69: 3635–3650.
Zheng Y, Wang Z, Zhou Z. miRNAs: нови регулатори на автоимунно-медиирано панкреатично разрушаване на β-клетки при диабет тип 1. Cell Mol Immunol 2017; 14.: 488–496.
Информация за автора
Принадлежности
Департамент по здравни науки, Università del Piemonte Orientale, Novara, 28100, Италия
Флавия Продам, Аналиса Чиокети и Умберто Дианзани
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
- Диета, хипотиреоидизъм и диабет тип 2
- За хората в риск от развитие на захарен диабет тип 2, как метформинът се сравнява с диетата
- Клинично изпитване за въглехидратни диети при захарен диабет тип 2
- Диабет тип 2 и диета Здраве 24
- Комбинирани програми за насърчаване на диетата и физическата активност за превенция на диабета