Сара Томас Бабу
1 Отдел по неонатална перинатална медицина, Катедра по педиатрия, и
Синин Ниу
1 Отдел по неонатална перинатална медицина, Катедра по педиатрия, и
Меган Раец
2 Катедра по имунология, Тексаски университет, Югозапад, Далас, Тексас, САЩ.
Рашмин С. Савани
1 Отдел по неонатална перинатална медицина, Катедра по педиатрия, и
Лора В. Хупър
2 Катедра по имунология, Тексаски университет, Югозапад, Далас, Тексас, САЩ.
Джули Мирпури
1 Отдел по неонатална перинатална медицина, Катедра по педиатрия, и
Свързани данни
Резюме
Затлъстяването на майките и диетата с високо съдържание на мазнини (HFD) през перинаталния период са документирали краткосрочни и дългосрочни неблагоприятни резултати за потомството. Механизмите на HFD ефектите на майката върху новороденото потомство обаче са неясни. Докато ефектите от експозицията на HFD при майката по време на потомството се оценяват все по-често, ние не знаем дали HFD на майката променя микробиотата или влияе на новородената податливост към възпалителни състояния, нито механизмите. В това проучване ние показваме, че потомството на майки, изложени на HFD, развива уникална микробиота, белязана от разширяване на Firmicutes и увеличаване на IL-17, произвеждащи вродени лимфоидни клетки тип 3 (ILC3s). Разширяването на ILC3s беше рекапитулирано чрез неоколонизация само с HFD микробиота. Освен това, потомството на HFD е податливо на неонатален модел на възпаление, който е обратим с IL-17 блокада. Колективно тези данни предполагат неизвестна досега и уникална роля на ILC3 в промотирането на ранна възпалителна чувствителност при потомството на майки, изложени на HFD.
Въведение
Средната американска диета, състояща се от над 35% мазнини, е допринесла за епидемията от затлъстяване в САЩ и в други развити страни. Затлъстяването на майката през перинаталния период е документирало краткосрочни и дългосрочни неблагоприятни резултати за потомството (1–3). Над 50% от жените в детеродна възраст в САЩ са или с наднормено тегло, или със затлъстяване, и са изложени на диета с високо съдържание на мазнини (HFD) (4). Консумацията на HFD при възрастни води до промяна на чревния микробиом и податливост на колит (5, 6). Въпреки че ефектите от експозицията на HFD при майката по време на потомството се оценяват все по-често (7, 8), ние не знаем дали HFD на майката променя микробиотата или влияе на новородената чувствителност към възпалителни състояния, нито механизмите. Потенциалните механизми включват промяна на чревната микробиота и диференциални имунни отговори гостоприемник-коменсал. Опитахме се да започнем да разбираме тази връзка, като изследваме как HFD на майката влияе върху развитието на микробиотата при новородени потомци и характеризираме последиците от тази промяна.
Повишеното изобилие от чревни Firmicutes се свързва с няколко заболявания, а именно възпалителни заболявания на червата, затлъстяване и метаболитен синдром (9–12). Интересното е, че членовете на Firmicutes тип, сегментирани нишковидни бактерии (SFB), са показали, че насърчават диференциацията и разширяването на Th17 клетките в червата и допринасят за възпалението, наблюдавано при улцерозен колит при възрастни (13–15). Разширяването на твърдите частици предшества развитието на некротизиращ ентероколит (NEC) (16), опустошително възпалително заболяване на червата при недоносени бебета, което носи значителна заболеваемост и смъртност. Трябва да се отбележи, че мишките са податливи на NEC само преди 2-седмична възраст, което е еквивалентно на по-малко от 30 седмици бременност при хората (17, 18). По този начин предположихме, че излагането на HFD на майката би променило микрофлората на потомството и потенциално изложило потомството на риск за NEC.
IL-17 е цитокин, който играе значителна роля при възпалителни и инфекциозни заболявания на червата. Вродените лимфоидни клетки тип 3 (ILC3) са вроденият аналог на Th17 клетките и могат по същия начин да произвеждат както IL-17, така и IL-22. Те се намират предимно в чревния тракт и в лигавичните тъкани. Те играят решаваща роля в имунната хомеостаза, защитата на гостоприемника и патогенезата на заболяването (19, 20). ILC3 взаимодействат с чревната микробиота и присъстват още през третия триместър на бременността при мишки. ILC3 се намират и в червата на човешките плодове (21, 22). Съвременните данни показват, че коменсалните бактерии могат да имат способността да регулират функционалните отговори на ILC3 чрез TLR сигнализиране (23, 24).
По-рано нашата лаборатория показа, че новородените мишки преди 3-седмична възраст имат уникална микробиота, белязана от експанзия на протеобактерии (25). Тези мишки също имат повишаване на изходната експресия на възпалителни цитокини и са податливи на неонатален модел на възпаление (липополизахарид и тромбоцитно-активиращ фактор [LPS/PAF] експозиция). В следващите експерименти ние изложихме разплодни мишки на HFD и изследвахме чревната микробиота и податливостта към възпаление при потомството. Също така използвахме поточни цитометрични техники и експерименти за неоколонизация, за да определим връзката между популациите на имунни клетки от микробиота и ламина проприа (LP).
Резултати
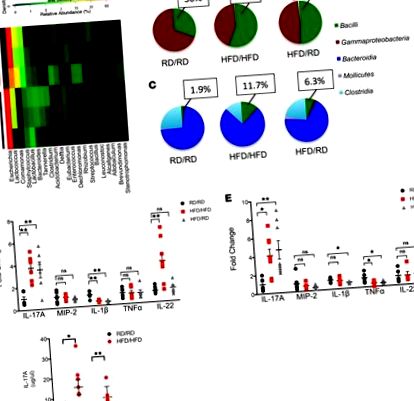
Излагането на майката на HFD променя чревната микробиота и увеличава IL-17 на изходно ниво при потомството.
Популацията на ILC3 е разширена в LP на потомство с HFD.
След това се опитахме да определим дали IL-17-продуциращите клетки са резултат от специфично увеличение на ILC3s, а не на Th17 клетки. Използвахме Rag1 -/- мишки, които имат дефицит на зрели Т и В клетки, но все още имат ILC. След излагане на размножаващи се Rag1 -/- мишки или на HFD, или на RD, потомството на HFD имаше увеличение на IL-17, продуциращи ILC3 (Фигура 3, A и B), както и разширяване на Firmicutes в тяхната микробиота на дебелото черво (Фигура 3С). Проточното цитометрично оцветяване потвърждава, че това са ILC от тип 3 (Rorγt +, CD127 +, CD117 +, NKp46 +, CD4 -). Тези данни показват, че потомството на HFD развива уникална микробиота, свързана със специфично увеличение на ILC3.
Потомството на майки, изложени на HFD, има повишена податливост на чревни увреждания, което се обръща чрез блокиране на IL-17.
Наблюдението, че новородените потомци на майки, изложени на HFD, са по-податливи на IL-17-медиирано възпаление на червата може да даде представа за факторите на околната среда, които стимулират развитието на NEC при недоносени бебета. Нашето проучване показва съществена роля на ILC3 в чувствителността към възпаление при HFD потомство; обаче не можем да изключим ролята на други IL-17-продуциращи клетки, включително Th17 клетки и IL-17-продуциращи γδ Т клетки. Хистологичните резултати с блокада на IL-17 при мишки от див тип са по-ниски, отколкото при мишки Rag1 -/-, което предполага роля за тези други клетъчни типове. При възрастни мишки е доказано, че IL-17A от γδ Т клетки има независими от IL-23 защитни ефекти чрез намаляване на пропускливостта на червата в червата (43). Неонаталните мишки имат значително повече γδ Т клетки, но са относително хипореагиращи в сравнение с възрастни (44, 45). Остава да се проучи дали HFD при майката при бременност при хора носи повишен риск от NEC при недоносени бебета. Ако се установи, че е така, нашите данни предполагат потенциални терапевтични подходи за NEC при недоносени бебета, чрез модулация на микробиотата, ILC3s или IL-17 продукция.
Установяването на чревната микросреда е уникално и сега се оказва, че се влияе от диетата, излагането на антибиотици и начина на доставяне на антибиотици (46, 47). Нашето проучване предполага роля на майчината диета за промяна на установяването на микробиома при потомството и има значителни последици за общественото здраве. Предаването на възприемчив фенотип, който е склонен към възпаление и дори потенциално затлъстяване или метаболитен синдром, увеличава възможността за ранна намеса при новородени за предотвратяване на бъдещи заболявания. Промяната в диетата по време на бременност също може потенциално да доведе до намаляване на чувствителността към възпалителни реакции на червата при новородени. Необходими са бъдещи проучвания, насочени към разбиране на механизмите, свързани с установяването на фенотипните промени при потомството както при възрастни, така и при новородени.
В обобщение, нашето проучване подчертава ролята на HFD при майката за промяна на микробиотата на потомството с последващо микробиота-зависимо разширяване на IL-17-продуциращи ILC3s и повишена чувствителност към възпаление.
Методи
Модели на мишки и HFD
qRT-PCR
Последователност от следващо поколение
Съдържанието на дебелото черво беше извлечено и геномна ДНК изолирана с помощта на ZR Fecal DNA miniprep (Zymo Research). Бактериално кодирано етикетирано секвениране с използване на йонен торент се извършва с помощта на баркодирани праймери 28F-519R за V1-V3 региона на 16S rRNA гена от изследователската и тестова лаборатория. Бяха получени три хиляди четения на проба. FASTA-форматираните последователности бяха анализирани за качество и последователностите, които имаха нискокачествени тагове, грунд, краища или които не бяха с дължина поне 250 bp, бяха изключени от анализа.
След като FASTA-форматираните последователности преминат контролирани от качеството проверки, както е описано, първо се сортира идентичността на всяка останала последователност, така че форматираният FASTA файл съдържа четения от най-дългото до най-краткото. След това тези последователности бяха групирани в OTU клъстери с 96,5% идентичност (3,5% дивергенция), използвайки USEARCH. За всеки клъстер началната последователност беше поставена във формат на последователност, форматиран от FASTA. След това този файл беше заявен срещу база данни с висококачествени последователности, получени от NCBI, използвайки разпределен.NET алгоритъм, който използва BLASTN + (KrakenBLAST, www.krakenblast.com). Използвайки .NET и C # конвейер за анализ, получените BLASTN + изходи бяха компилирани и извършен анализ на намаляване на данните.
Въз основа на процента на идентичност на последователностите, получен от BLASTn + по-горе, последователностите бяха класифицирани на подходящите таксономични нива въз основа на следните критерии. Поредици с резултати от идентичност (идентичност с добре характеризирани 16S последователности) над 97% (10 CFU веднъж на 3 дни от живота и жертва на 2 седмици. Впоследствие са анализирани мишки на 2 седмична възраст. Проведени са два експеримента с общо 4-8 мишки във всяка група.
Неонатален LPS/PAF модел на чревно увреждане.
Нараняването на лигавицата на червата е предизвикано при 2-седмични кученца на мишки чрез интраперитонеално приложение на LPS (1 mg/kg) и PAF (50 μg/kg). Мишките бяха умъртвени 2 часа след приложението на LPS и PAF и тънките чревни секции бяха фиксирани в фиксатор Carnoy, вградени в парафин и оцветени с хематоксилин и еозин (H&E). Хистологичните препарати бяха прегледани на микроскоп Leica DM2000. Изображенията са получени с увеличение × 20 с помощта на цветна CCD камера Optronics Microfire и софтуер за придобиване на PictureFrame 2.0 (Optronics). Хистологичните промени се анализират по двойно-сляп начин, като се използва 17-степенна скала, както следва. За целостта на криптата: 0, нормално; 1, неправилни крипти; 2, лека загуба на крипта; 3, тежка загуба на крипта; 4, пълна загуба на крипта с непокътнат епителен клетъчен слой; 5, пълна загуба на крипти и повърхностен епител (10 крипти). За инфилтрация на възпалителни клетки в лигавицата: 0, нормално; 1, леко; 2, скромен; и 3, тежко. За инфилтрация на субмукозата: 0, нормално; 1, леко; 2, скромен; и 3, тежко. За инфилтрация на мускула: 0, нормално; 1, леко; 2, скромен; и 3, тежко. Тези резултати бяха добавени, което доведе до общ резултат от 0 до 15. Проведени бяха три експеримента с 4–6 мишки във всяка група.
In vivo блокада на IL-17.
C57BL/6 мишки бяха третирани чрез интраперитонеална инжекция с 30 μg пречистен антимиши IL-17A (TC11-18H10.1, Biolegend) през ден, започвайки от 5 дни от живота. След това мишките бяха изложени на LPS/PAF модел на чревно увреждане на 2 седмици и бяха изследвани, както е описано по-горе. Проведени са два експеримента с 4–6 мишки във всяка група.
Статистика
Данните бяха анализирани чрез еднопосочен ANOVA с post hoc тест на Tukey, двупосочен ANOVA или несдвоен двустранен t-тест на Student, като се използва GraphPad Prism 6. Данните са изразени като средно ± SEM и значимостта е определена като P (393K, pdf )
Благодарности
Това изследване беше подкрепено от NIH K08 (> DK100545), грант за млади изследователи за пробиотични изследвания и грант на Фондация за детски медицински център за JM.
Промени във версията
Версия 1. 04.10.2018
Бележки под линия
Конфликт на интереси: Авторите са декларирали, че не съществува конфликт на интереси.
- Диетата с високо съдържание на мазнини при майките уврежда фоликулярното развитие на потомството чрез интраовариална
- Диета на майката по време на бременност и височина на потомството, височина на седене и дължина на крака
- Ново лекарство предотвратява увреждането на черния дроб, затлъстяването и непоносимостта към глюкоза при мишки на диета с високо съдържание на мазнини
- Ново лекарство предотвратява увреждането на черния дроб, затлъстяването и непоносимостта към глюкоза при мишки на диета с високо съдържание на мазнини
- PLOS Genetics Диетата с високо съдържание на мазнини предизвиква завишено от микробиота увеличение на активността на стволови клетки в