Резюме
Предистория и цели
Дори безалкохолният стеатохепатит (NASH) се превръща в ключова роля в процеса на чернодробна фиброза или цироза, нито един NASH, включващ чернодробна фиброза мишки модел, който е в съответствие с механизмите на разстройство на метаболизма на мастните киселини и глюкозата не е широко приет. Тук установихме миши модел на неалкохолен стеатохепатит (NASH) с чернодробна фиброза, използвайки диета с високо съдържание на мазнини и високо въглехидрати (HFHC) и анализирахме потенциалната патогенеза, използвайки транскриптомен микрочип.
Методи
Петдесет мишки бяха стратифицирани по тегло и произволно разделени на HFHC модел и контролни (Con) групи. Десет мишки бяха умъртвени в началото на експериментите, 10 мишки от HFHC и Con група бяха евтаназирани в края на 20 и 30 седмици. Извършени са следните анализи: биохимичен анализ; хистологична оценка; оценка на чернодробния колаген от тип I (Col-I), α-гладкомускулен актин (α-SMA) и трансформиращ растежен фактор-β1 (TGF-β1) протеин и нива на експресия на иРНК; и транскриптомен анализ на генни чипове.
Резултати
В сравнение с групата Con във всеки момент от време, телесното тегло и теглото на черния дроб в мократа група на HFHC от мишки са значително по-високи. На 30-та седмица нивата или активностите на аланин аминотрансфераза (ALT), аспартат аминотрансфераза (AST), кръвна глюкоза на гладно (FBG) и инсулин на гладно (FINS) и съдържанието на триглицериди (TG) и хидроксипролин (HYP) в групата на модела HFHC бяха значително повишен. Тежка стеатоза присъства в чернодробните тъкани, допринесени от групата на HFHC мишки. Обикновено се наблюдава значителна перисинусоидална фиброза с подобна на клетка структура и мостови образувания в черния дроб на мишките в HFHC група. Нивата на експресия на протеини на Col-I, α-SMA и TGF-β1 в протеини и тРНК в чернодробните тъкани на HFHC мишки драстично се увеличават с течение на времето. В сравнение с групата Con, групата HFHC има 151 диференцирано експресирани гена, които участват в 41 сигнални пътя.
Заключения
След поддържане на 30-седмично диетично лечение с HFHC, мишките показаха значителна чернодробна фиброза, чернодробна стеатоза, балонна дегенерация и възпаление. Въз основа на анализите на транскриптомни микрочипове, експерименталният NASH, включващ чернодробна фиброза, потенциално свързан с драстично променено взаимодействие ECM-рецептор, Toll-подобни рецепторни сигнали и други сигнални пътища.
Ключови точки
Честотата на фиброзните заболявания е висока и няма идеални терапевтични лекарства или идеален животински модел, който да подпомогне разработването на лекарства.
Чрез хранене на мишки с диета с високо съдържание на мазнини и захар в продължение на 30 седмици, бе създаден безалкохолен модел на мишка с фиброза на мастен хепатит.
Черният дроб на този модел мишка е генетично анализиран и скриниран, за да се предскаже възможна патогенеза.
Въведение
Безалкохолната мастна чернодробна болест (NAFLD) се превърна в често срещано хронично чернодробно заболяване в световен мащаб. Спектърът на заболяването на NAFLD включва неалкохолен прост мастен черен дроб (NAFL), неалкохолен стеатохепатит (NASH), мастна чернодробна фиброза и чернодробна цироза [1]. Предишни проучвания показват, че чернодробната фиброза е най-важният индикатор за предсказване, засягащ прогнозата на NAFLD, а фиброзното стадиране също е тясно свързано с дългосрочната обща смъртност, чернодробната трансплантация и свързаните с черния дроб събития [2].
Тук имаме за цел да разработим модел на NASH, който генерира значителна чернодробна фиброза при негенетично модифицирани мишки, индуцирани от комбинирана диета.
Материали и методи
Материали
Животни
Петдесет 6-седмични диви мъжки мишки C57BL/6 SPF с телесна маса 20–22 g бяха закупени от Shanghai SLAC Laboratory Animal Co., Ltd. и държани, моделирани и наблюдавани в защитено от бариери животно стая в центъра за изследвания на животни в Шанхайския университет по традиционна китайска медицина. По време на създаването на модел експерименталните животни имаха свободен достъп до храна и вода (SYXK (Шанхай) 2014–0008).
Диетата за групата на модела HFHC е била 58 kcal% мазнини с захароза Surwit Diet (D12331, партиден номер: 17082101A10, Research Diets, USA), а диетата за контролната (Con) група е била 11 kcal% мазнини w/Corwstarch Surwit Diet (D12328, номер на партида: 17100212A4, Research Diets, USA). Фруктоза и захароза (F0001/S0001) са закупени от Trophic Animal Feed High-Tech Co., Ltd., Китай.
Методи
Групиране на животни и създаване на модели
Всички протоколи за експерименти с животни са одобрени от Комитета за експериментална етика на животните от Шанхайския университет по традиционна китайска медицина. C57Bl/6 мишки бяха настанени в центъра за изследвания на животни в Шанхайския университет по традиционна китайска медицина. След 1 седмица на аклимация, мишките бяха разделени на случаен принцип в групата Con (н = 30) и групата на модела HFHC (н = 20) според телесното им тегло. Мишките от групата на модела HFHC получиха свободен достъп до високо съдържание на мазнини (58% kcal мазнини, 25% kcal въглехидрати и 17% kcal протеин) и високо въглехидрати (питейна вода: 42 g/L, 55% фруктоза и 45% захароза) и мишките бяха разделени по равно на времеви точки от 20 (HFHC 20w) и 30 седмици (HFHC 30w), с по 10 мишки във всяка точка от времето. Мишките от групата Con бяха хранени със съответна диета с ниско съдържание на мазнини (10,5% мазнини, 73,1% kcal въглехидрати и 16,4% kcal протеин) и нормална питейна вода; тези мишки също бяха разделени по равно на времеви точки от 0 (Con 0w), 20 (Con 20w) и 30 седмици (Con 30w), с 10 мишки във всяка точка от времето.
Събиране на проби
В края на седмици 0, 20 и 30, мишките са гладували в продължение на 12 часа и са анестезирани с 2% пентобарбитал натрий в доза 3 ml/kg чрез интраперитонеална инжекция. Очните ябълки бяха отстранени и от всяка мишка бяха събрани 1 ml кръв. Част от чернодробна тъкан беше извлечена от същия лоб и позиция във всяка мишка и фиксирана в 10% неутрален буфериран разтвор на формалин.
Биохимичен анализ
1) Чернодробни ензимни промени: Серумна аланин аминотрансфераза (ALT) и серумна аспартат аминотрансфераза (AST) бяха измерени с помощта на комплекти за анализ на ALT и AST (партиден номер 20180628, Институт по биоинженерство в Нанкин Jiancheng, Нанкин, Китай). 2) Глюкозен метаболизъм: След 12 часа на гладно, от опашната вена се събират приблизително 3 μL кръв и се измерва кръвната глюкоза на гладно (FBG) с помощта на глюкомер Roche (Roche diagnostika GmbH, Германия). Нивата на инсулин на гладно (FINS) в серума на мишки от всяка група бяха измерени с помощта на ензимно-свързан имуносорбентен тест (ELISA) комплект (Ultra Sensitive Mouse Insulin ELISA Kit, партиден номер: 90080, Crystal Chem, USA). Индексът за оценка на хомеостатичния модел-инсулинова резистентност (HOMA-IR) се изчислява със следната формула: FBG (mM) x FIN (IU/L)/22,5. 4) Съдържанието на чернодробни триглицериди (TG) беше измерено с помощта на комплект (Номер на партида: 2018080029, Dong’ou Diagnostic Products Co. Ltd., Zhejiang, Китай). 5) Съдържанието на чернодробен хидроксипролин (HYP) беше измерено с помощта на комплект за анализ на HYP (номер на партида: 20180630, Институт по биоинженерство в Нанкин Jiancheng, Нанкин, Китай).
Хематоксилин и еозин (HE) и червено оцветяване на Sirius
Фиксираната чернодробна тъкан беше дехидратирана и вградена с помощта на тъканен процесор (Leica ASP300) и станция за вграждане на парафин (Leica EG1160). След това срезовете бяха оцветени с помощта на HE комплект за оцветяване (номер на партида 20180530, Нанкинг Jiancheng Bioengineering) и комплект за оцветяване Sirius червен (номер на партида 20180528, Nanjing Jiancheng Bioengineering).
Маслено червено O оцветяване
Чернодробната тъкан се фиксира в течен азот, вгражда се в среда орнитин карбамоил трансфераза (OCT) и се разделя при - 20 ° C с дебелина 10 μm. Секциите бяха оцветени с помощта на комплект за оцветяване с масло в червено O (номер на партида 20180528, биоинженерство в Нанкин Jiancheng).
Western blot анализ
В това проучване са използвани антитела, насочени към следните протеини: α-гладък мускул актин (α-SMA, ab5694, 1: 1000); чернодробен колаген от тип I (Col-I, ab34710, 1: 1000); и трансформиращ растежен фактор -β1 (TGF -β1, Abcam, 1: 1000). Експресията на протеин на глицералдехид-3-фосфат дехидрогеназа (GAPDH, протеинтех, 10 494–1-AP, 1: 10000) се използва като вътрешен контрол.
Имунохистохимия (IHC)
Пробите първо се инкубират в анти-α-SMA антитяло при разреждане 1: 100 (α-SMA, 1: 100, каталожен номер: ab5694, САЩ) през нощта при 4 ° C и след това се инкубират с първично антитяло при разреждане 1: 250. Някои чернодробни секции също бяха оцветени с анти-Col-I антитяло (Col-I, Abcam, 1: 100, ab34710, USA), използвайки същия метод.
Реакция на полимеразна обратна транскрипция (RT-PCR)
Извличане на РНК: РНК се екстрахира с помощта на комплект за извличане на РНК на Trizol от колона UNIQ-10 (каталожен номер: E928KA9723, Sangon Biotech, Шанхай). Стойностите на относителното количество (RQ) на PCR продуктите бяха подложени на анализ, използвайки метода △ △ CT за оценка на нивата на експресия на иРНК на Col-1, α-SMA, TGF-β1, Col-4 и Smad3.
Подготовка на библиотеката и последователност от десет Illumina HiSeq X
Библиотеките бяха избрани по размер за кДНК целеви фрагменти от 200-300 bp на 2% ултра агароза с нисък обхват, последвано от PCR амплификация с използване на Phusion DNA полимераза (NEB) за 15 PCR цикъла. След количествено определяне с флуорометър TBS380, библиотеката за секвениране на сдвоени РНК-секвенции беше секвенирана със система за секвениране Illumina HiSeq X Ten (2 × 150 bp дължина на четене). Данните бяха анализирани с помощта на безплатната онлайн облачна платформа Majorbio I-Sanger (www.i-sanger.com).
Статистически анализ
Статистическият анализ на данните от базата данни е извършен с помощта на софтуера SPSS 22.0 за Mac OS. Данните от измерванията в статистическото описание са обозначени със S и се отнасят до данните за преброяване. Когато нормалността и хомогенността на дисперсията бяха удовлетворени, беше приложен t тест за сравнение на двете групи. Сравнението на данните от йерархичното групиране беше изчислено чрез анализ на Radit.
Резултати
Промени в приема на храна и вода, телесна маса и нива на мокро тегло в черния дроб между всяка група
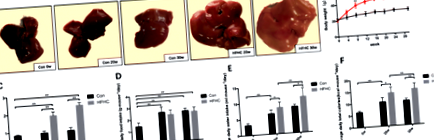
Поява на черен дроб при мишки от всяка група
Най-общо черният дроб от мишките от групата Con беше тъмночервен и мек. Черният дроб от мишки от групата HFHC показва различна степен на жълто в различни часови точки и изглеждаше пълен и тъп; секциите бяха мазни и текстурата стана жилава. На 30 седмици някои черни дробове от HFHC мишки са имали жълтеникаво-бяло фокално отлагане на мазнини в черния дроб (фиг. 1а).
Промени в средния прием на храна, прием на вода и мокро тегло на черния дроб
По време на експеримента не са загинали мишки. Телесната маса на мишките от всяка група се увеличава постепенно с течение на времето (фиг. 1б). На 20 седмици телесната маса и мокрото тегло на черния дроб в групата на HFHC са значително увеличени (P 0,05) (Фиг. 1d-f).
Ензимология и състояние на метаболизма на глюкозата във всяка група
Промени в ALT и AST дейностите във всяка група
На 20 седмици серумните ALT и AST активности при мишките от групата на HFHC бяха значително повишени (P Фиг. 2
Промени във FBG, FINS и HOMA-IR във всяка група
В сравнение с мишките от групата Con при 20w, нивата на FBG и FINS при мишките от групата HFHC при 20w са значително по-високи (P Фиг. 3
H&E оцветяване
Под светлинен микроскоп, H&E оцветяването на чернодробната тъкан показа, че чернодробната стеатоза засяга цялата чернодробна лобула, със значителна възпалителна клетъчна инфилтрация и разпръсната некроза. HFHC мишките при 30w показват балонна дегенерация на хепатоцити и възпалителни огнища в чернодробната лобула. Резултатите за активност на NAFLD (NAS) варират от 4 до 8, сред които 80% са по-високи от 5, отговарящи на критериите за диагностика на NASH, а 40% са близо до 8 (фиг. 3а и г).
Маслено червено O оцветяване
Омазняването с маслено червено О показва, че както макровезикуларна, така и микровезикуларна стеатоза присъстват в чернодробните тъкани от мишки от групата на HFHC при 20w, вариращи от 33 до 66%. Площта, плътността и интензивността на оцветяването с маслено червено в чернодробната тъкан от групата HFHC се увеличава постепенно с течение на времето. На 30 седмици в чернодробните тъкани от групата на HFHC е налице тежка макровезикуларна и микровезикуларна стеатоза, варираща от 66 до 99% (фиг. 3б).
Отлагане на колаген и състояние на активиране на чернодробни звездни клетки (HSC) в чернодробна тъкан от мишки от всяка група
HYP съдържание
Съдържанието на HYP в черния дроб в групата на HFHC се увеличава постепенно с течение на времето. В сравнение с това в групата Con при 20w, съдържанието на HYP в черния дроб в мишките от групата HFHC при 20w е значително увеличено (P Фиг. 4
Червено оцветяване на Сириус
Под светлинен микроскоп оцветяването на червената тъкан със сириус в червено показа, че на 20 седмица фиброзата в перисинусоидалното пространство присъства във формата на звезда в черния дроб на мишката HFHC, а стадията на фиброза варира от F1-F2, с по-голямата част (60 %) на етап F2. На 30 седмици имаше значителна перисинусоидална фиброза в черния дроб, наличие на клетки, подобни на клетки и масивна фиброзна съединителнотъканна хиперплазия, с някои мостови образувания. Полуколичественият анализ показа, че на 30 седмици нивото на колаген в групата на HFHC е значително по-високо от това в групата Con (P Фиг. 5
IHC на Col-1 и α-SMA в черния дроб на мишката във всяка група
Това α-SMA-положително оцветяване е значително засилено във фиброзната чернодробна преграда в групата на HFHC при 20w и 30w и се намира главно в дебелата и плътна фиброзна преграда. Положителната зона на оцветяване се увеличава с времето. По същия начин, Col-I положително оцветяване присъства само в стените на кръвоносните съдове в групата Con при 0w. Това Col-I положително оцветяване е значително засилено във фиброзната чернодробна преграда в групата на HFHC при 20w и 30w и се намира главно в перисинусоидалните хепатоцитни мембрани и фиброзна преграда. Положителната зона на оцветяване се увеличава с времето (фиг. 5б).
Col-I, Col-4, α-SMA, TGF-β1 и Smad3 нива на експресия на иРНК при мишки от всяка група
В сравнение с тези в черния дроб на Con при 0w, нивата на експресия на Col-I, TGF-β1 и α-SMA в чернодробните групи на HFHC при 20w са значително увеличени (P Фиг. 6
Диференциално експресирани гени между моделната група и нормалната група
Имаше 151 диференциално експресирани гена с Log2FC ≥ 2 и P Таблица 1 Диференциално надрегулирани гени в моделната група и контролната група с Log2FC ≥ 2 и P
Сигнално регулирани пътища, свързани с гените, диференцирано изразени между моделната група и нормалната група
151-те диференциално експресирани гена между моделната група и нормалната група с промяна в пъти ≥2 според стойностите на Log2FC бяха анализирани чрез KEGG PATHWAY анализ, използвайки R скрипт. Когато коригираното P стойност (P коригиране) беше Таблица 3 KEGG сигнални пътища, идентифицирани в гени, които са диференцирано изразени между моделната група и контролната група
Дискусия
NAFLD се превърна в често срещано хронично чернодробно заболяване в световен мащаб и неговият спектър от заболявания включва NAFL, NASH, мастна чернодробна фиброза и чернодробна цироза. В момента NAFLD засяга 30% от населението в западните страни и 15–40% в Китай. Повече от 50% от затлъстелите имат NAFLD, а 30–42% от тежко затлъстелите пациенти с NASH имат значителна чернодробна фиброза [1]. Неотдавнашно проучване показа, че персистиращото увреждане на черния дроб прогресира до чернодробна фиброза и чернодробна цироза при приблизително 40% от пациентите с NASH. В рамките на едно десетилетие голямата популация от пациенти с NASH може да доведе до висока честота на мастна чернодробна фиброза и чернодробна цироза. Дългосрочните проследяващи проучвания показват, че фиброзата на черния дроб е най-важният индикатор за предсказване, засягащ прогнозата на NAFLD [4, 5].
Комбинация от фруктоза и захароза осигурява нормален прием на вода при опитни животни.
След систематичен анализ, внимателно сравнение и задълбочено проучване на настоящите главно приети изследователски модели, ние предпазливо решихме да храним мишки с високо съдържание на мазнини (особено TFA), плюс прекомерно количество фруктоза и захароза, според проучване, публикувано в Хепатология [3]. Въз основа на това проучване определихме различни времеви точки, удължихме продължителността на създаване на модела до 20 и 30 седмици. Важно е, че динамично наблюдавахме патологичните характеристики на модела на тези мишки, включително, но не само, чернодробна стеатоза, възпаление и отлагане на колаген. По този начин установихме идеален модел, който по-добре рекапитулира NASH с чернодробна фиброза и допълнително допринася за терапевтичните оценки на ефикасността на лекарствата в бъдеще.
Въз основа на успешната конструкция на този миши модел на NASH с чернодробна фиброза, която имитира патогенезата и симптомите, възникнали при пациентите, с цел по-добро разкриване на патогенния механизъм на този модел и поставяне на основата на разработването на нови лекарства, сравнихме нивата на генна експресия контролната група с групата на модела. Чрез анализ открихме 151 гена с разлика в Log2FC, кратни на 2 и P
Заключения
В обобщение, описаният тук миши модел на NASH и чернодробна фиброза, индуциран от 30-седмична диета с високо съдържание на мазнини (наситени мазнини + TFA) и с високо съдържание на въглехидрати (фруктоза + захароза), имитира отблизо NASH, свързан с патологична фиброза на черния дроб процес при пациенти. Високата честота на тези патологични промени, високият процент на успех при създаването на модела и нулевата смъртност правят този модел подходящ за изследване на основните механизми на чернодробната фиброза в рамките на NASH и за оценка на ефикасността на лекарствата.
Наличност на данни и материали
Всички данни, генерирани или анализирани по време на това проучване, са включени в тази публикувана статия.
- Чернодробни ензими при пациенти с диагноза неалкохолна мастна чернодробна болест (NAFLD) във Veracruz a
- При мишки диета с високо съдържание на мазнини и захар реконструира микробиома и ендоканабиноидната система
- Колко е достатъчно упражнения в практиката на безалкохолни мастни чернодробни заболявания Актуализиране
- Инхибиращ ефект на екстракта от синя орлови нокти върху индуциран от диети мастен черен дроб при мишки -
- Кетогенни диети с ниско съдържание на въглехидрати, хомеостаза на глюкозата и безалкохолно мастно чернодробно заболяване