Център за човешко хранене, Медицински факултет на Вашингтонския университет, Сейнт Луис, Мисури.
Център за човешко хранене, Медицински факултет на Вашингтонския университет, Сейнт Луис, Мисури.
Център за човешко хранене, Медицински факултет на Вашингтонския университет, Сейнт Луис, Мисури.
Център за човешко хранене, Медицински факултет на Вашингтонския университет, Сейнт Луис, Мисури.
Център за човешко хранене, Медицински факултет на Вашингтонския университет, Сейнт Луис, Мисури.
Център за човешко хранене, Медицински факултет на Вашингтонския университет, Сейнт Луис, Мисури.
Център за човешко хранене, Медицински факултет на Вашингтонския университет, Сейнт Луис, Мисури.
Център за човешко хранене, Медицински факултет на Университета във Вашингтон, 660 South Euclid Avenue, Campus Box 8031, Сейнт Луис, МО 63110. E-mail: [email protected] Търсене на още статии от този автор
Център за човешко хранене, Медицински факултет на Вашингтонския университет, Сейнт Луис, Мисури.
Център за човешко хранене, Медицински факултет на Вашингтонския университет, Сейнт Луис, Мисури.
Център за човешко хранене, Медицински факултет на Вашингтонския университет, Сейнт Луис, Мисури.
Център за човешко хранене, Медицински факултет на Вашингтонския университет, Сейнт Луис, Мисури.
Център за човешко хранене, Медицински факултет на Вашингтонския университет, Сейнт Луис, Мисури.
Център за човешко хранене, Медицински факултет на Вашингтонския университет, Сейнт Луис, Мисури.
Център за човешко хранене, Медицински факултет на Вашингтонския университет, Сейнт Луис, Мисури.
Център за човешко хранене, Медицински факултет на Университета във Вашингтон, 660 South Euclid Avenue, Campus Box 8031, Сейнт Луис, МО 63110. E-mail: [email protected] Търсене на още статии от този автор
Резюме
Обективен: Адипонектинът е най-разпространеният протеин, секретиран от мастната тъкан и е обратно свързан със затлъстяването и инсулиновата резистентност. Целта на това проучване е да се оцени хипотезата, че изразената загуба на тегло, индуцирана от стомашна байпас хирургия (GBS), ще увеличи експресията на гена на адипонектин както в горната, така и в долната подкожна телесна мазнина и ще увеличи плазмената концентрация на адипонектин.
Методи и процедури за изследване: Адипонектин подкожна абдоминална и феморална експресия на мастна тъкан, определена чрез използване на количествена верижна реакция с обратна транскриптаза-полимераза, и плазмени концентрации на адипонектин, определени с помощта на ензимно-свързан имуносорбентен анализ, бяха оценени при шест изключително затлъстели жени (ИТМ = 57,1 ± 4,1 kg/m 2) преди и 1 година след GBS.
Резултати: След GBS субектите загубиха 36 ± 5% от първоначалното си телесно тегло и показаха повишена инсулинова чувствителност, изразяваща се в значително намаляване на хомеостазния модел на оценка на инсулиновата резистентност от 10,7 ± 4,1 на 1,4 ± 0,3 (стр
Въведение
Адипонектинът е най-разпространеният секреторен протеин, произвеждан от мастната тъкан и има важни физиологични ефекти върху няколко системи от органи. Адипонектинът увеличава инсулиновата чувствителност в черния дроб, намалява производството на глюкоза в черния дроб ((1)) и увеличава оксидацията на глюкоза в скелетните мускули и окисляване на мастните киселини ((2), (3), (4)). Концентрациите на адипонектин в плазмата са обратно свързани с наднорменото тегло ((5), (6)), инсулиновата резистентност ((3), (7)), диабет тип 2 ((7), (8), (9)), метаболитният синдром ((10), (11)) и коронарна болест на сърцето ((8), (12), (13)). Предполага се, че производството на адипонектин в мастната тъкан е основен фактор, определящ плазмените концентрации на адипонектин, а пациентите, които имат ниска експресия на гена на адипонектин в мастната тъкан, имат ниски плазмени концентрации на адипонектин ((14)).
Ефектът от загубата на тегло върху транскрипцията на адипонектин и плазмената концентрация е неясен поради противоречиви резултати от различни проучвания. Данни от проучвания, включващи индуцирана от диетата загуба на тегло, показват, че плазмените концентрации на адипонектин намаляват ((15)), увеличават се ((8), (16), (17)) или не се променят ((11), (18), (19), (20)), докато генната експресия на мастната тъкан или се е увеличила ((16)), или не се е променила ((19), (21), (22)). Данни от проучвания, включващи индуцирана от бариатрична хирургия загуба на тегло, показват, че плазмените концентрации на адипонектин се повишават ((23), (24), (25), (26), (27), (28), (29)) или не се наблюдават значително промяна ((30)); нито едно от тези последни проучвания не изследва експресията на гена на адипонектин в мастната тъкан. Разликите в резултатите между проучванията могат да бъдат причинени от разликите в количеството загубено тегло сред участниците в изследването; възможно е значително намаляване на теглото, за да се стимулират промените в производството на адипонектин в мастната тъкан.
Целта на това проучване е да се оцени ефектът от изразена загуба на тегло, предизвикана от операция на стомашен байпас (GBS), 1 1 Нестандартни съкращения: GBS, стомашна байпас хирургия; GCRC, Общ клиничен изследователски център; SAT, подкожна мастна тъкан на корема; SFT, подкожна мастна тъкан на бедрената кост; HOMA-IR, модел на хомеостаза оценка на инсулинова резистентност.
върху адипонектин подкожна абдоминална и феморална експресия на мастна тъкан в гена и плазмени концентрации. Ние предположихме, че изразената загуба на тегло би довела до едновременно увеличаване на експресията на гена на адипонектин както в мастните депа в горната, така и в долната част на тялото и увеличаване на плазмените концентрации.
Методи и процедури за изследване
Учебни предмети
В това проучване са включени шест изключително затлъстели жени (на възраст 41,2 ± 3,9 години), които са били планирани за GBS в еврейската болница Barnes-е (Таблица 1). Преди операцията всички субекти са завършили медицинска оценка, включително анамнеза и физически преглед, рутинни кръвни тестове и 2-часов тест за орален глюкозен толеранс. Единият субект е бил наскоро диагностициран като диабет тип 2 след завършване на медицинската оценка, но не е получил медицинска терапия за диабет преди или след операция. Всички субекти са дали писмено информирано съгласие преди да участват в това проучване, което е одобрено от Комитета по човешки изследвания и Научно-консултативния комитет на Общия клиничен изследователски център (GCRC) на Медицинското училище във Вашингтон в Сейнт Луис.
| Тегло (кг) | 152,6 ± 9,0 | 98,3 ± 9,8 * |
| ИТМ (kg/m²) | 57,1 ± 4,1 | 36,9 ± 4,3 * |
| Глюкоза (mg/dL) | 115,5 ± 13,7 | 84,7 ± 3,3 |
| Инсулин (μU/ml) | 32,7 ± 8,3 | 6,6 ± 1,5 † |
| HOMA-IR | 10,7 ± 4,1 | 1,4 ± 0,3 † |
- GBS, стомашна байпас хирургия; HOMA-IR, модел на хомеостаза оценка на инсулинова резистентност.
- Стойност, значително различна от стойността преди GBS;
- * стр † стр
Експериментален протокол
Субектите бяха приети в GCRC вечер преди вземането на пробата и консумираха стандартно хранене в 19:00 ч., Състоящо се от ∼6 kcal/kg телесно тегло, което съдържа 55% от цялата енергия като въглехидрати, 30% като мазнини и 15 % като протеин. На следващата сутрин, след като субектите гладуват през нощта (12 часа), се вземат кръвни проби за определяне на плазмените концентрации на адипонектин, глюкоза и инсулин. Кръв се събира в охладени епруветки, съдържащи EDTA, за да се определят концентрациите на адипонектин и в охладени епруветки, съдържащи EDTA и апротинин (Trasylol; Bayer Pharmaceuticals Corp., West Haven, CT), за да се определят концентрациите на инсулин. Кръвните проби веднага се поставят върху лед и се центрофугират в рамките на 30 минути след събирането, за да се отдели плазмата. Плазмените проби се съхраняват при -78 ° C, докато се извършат анализи. Кръвта, получена за определяне на плазмените концентрации на глюкоза, веднага се центрофугира и анализира с помощта на автоматизиран глюкозен анализатор.
Биопсии от подкожни коремни мастни тъкани (SAT) и подкожни феморални мастни тъкани (SFT) са получени след вземане на кръвни проби. Местата за биопсия бяха подготвени и драпирани и мастната тъкан беше получена при стерилни условия. След анестезиране на кожата и подкожната мастна тъкан с лидокаин, мастната тъкан се аспирира от околопръстните и бедрените зони с помощта на 14-игрова игла, свързана с 5-милилитрова спринцовка. Приблизително 2 грама мастна тъкан бяха аспирирани, незабавно изплакнати с физиологичен разтвор и замразени в течен азот, преди да бъдат съхранявани при -78 ° C.
Трима субекти са подложени на отворена, а три на лапароскопски GB-руксен. Малка (~ 20 ml) проксимална стомашна торбичка е конструирана чрез телбод през стомаха. Крайникът на Ру е образуван чрез трансекция на йеюнума на 30 cm дистално от лигамента на Treitz; 75-см крайник е конструиран за субекти, които имат ИТМ 2 и 150-см крайник е конструиран за субекти, които имат ИТМ ≥50,0 kg/m 2. Всички процедури са извършени от един и същ хирург (J.C.E.).
Една година след GBS всички субекти бяха повторно приети в GCRC, където бяха взети кръвни проби, SAT и SFT, използвайки същите процедури, описани по-горе.
Примерни анализи
Кръвни проби
Концентрациите на адипонектин в плазмата се определят чрез използване на система за анализ на човешки адипонектин, свързана с ензими (ALPCO Diagnostics, Salem, NH). Коефициентите на вариация на междинния анализ и интраанализ за измервания на адипонектин са съответно 6,7% и 7,7%. Плазмените концентрации на инсулин се определят с помощта на радиоимуноанализ. Плазмените концентрации на глюкоза се определят с помощта на автоматизиран глюкозен анализатор (Yellow Springs Instruments, Yellow Springs, OH).
Проби от мастна тъкан
Общата РНК беше изолирана от мастна тъкан чрез използване на протокола TRI-REAGENT (Sigma Chemical Co., Сейнт Луис, Мисури) с допълнителен етап на центрофугиране за отстраняване на излишните триглицериди в съответствие с инструкциите на производителя. Концентрацията на РНК се определя чрез спектрофотометрична абсорбция при две разреждания.
CDNA от първа верига е генерирана чрез обратна транскрипция, като се използва 500 ng обща РНК и Applied Biosystems (Foster City, CA) комплект за обратна транскрипция. Верижната реакция на полимераза в реално време се извършва с помощта на система за откриване на последователност ABI PRISM 7500 и смес PowerSYBR (Applied Biosystems). Произволните единици на адипонектин иРНК бяха коригирани до съдържание на РНК 36В4, за да се контролира натоварването. Използвани са следните набори праймери: адипонектин [напред: TCTGTTTCCCACCTCACCTGA; реверс: CAGGACGTCATCATAGAACCACTT ((31))] и 36B4 [напред: GCAGACAACGTGGGCTCCAAGCAGAT; обратно: GGTCCTCCTTGGTGAACACGAAGCCC ((32))].
Изчисления
Инсулиновата резистентност се изчислява, като се използва оценката на модела на хомеостазата [HOMA-IR = инсулин на гладно (μU/mL) × глюкоза на гладно (mM)/22,5] ((33), (34)).
Статистически анализи
Студентски т тест за сдвоени проби е използван за оценка на статистическата значимост на разликата в стойностите преди и 1 година след GBS. Всички студентски т тестовете бяха двустранни, с изключение на оценката на HOMA-IR, за която беше използван едностранен тест, поради известното намаляване на инсулиновата резистентност след индуцирана от GBS загуба на тегло ((23), (26)). A стр стойност ≤0.05 се счита за статистически значима. Данните са представени като средни стойности ± стандартна грешка.
Резултати
Телесна маса и метаболитни параметри
Една година след GBS, телесното тегло на пациентите намалява с 36 ± 5%; средната загуба на тегло е 54,3 ± 9,1 kg (стр
Параметри на адипонектин
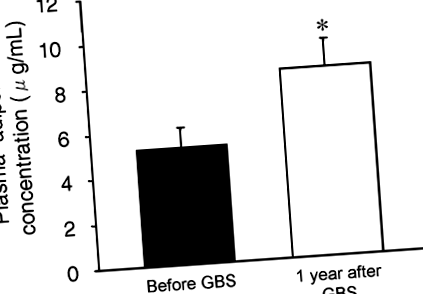
Индуцираната от бариатрична хирургия загуба на тегло причинява 77 ± 31% увеличение на средната плазмена концентрация на адипонектин (от 5,2 ± 0,9 до 8,4 ± 1,2 μg/ml; стр
Концентрация на адипонектин в плазмата преди и 1 година след GBS. Стойност, значително различна от стойността преди GBS; *стр
Експресия на гена на адипонектин в подкожната коремна мастна тъкан (SAT) (горен панел) и подкожната феморална мастна тъкан (SFT) (долен панел) преди и 1 година след GBS. Стойност, значително различна от стойността преди GBS; *стр
Дискусия
Адипонектинът е най-разпространеният секреторен протеин на мастната тъкан и има важни регулаторни ефекти върху действието на инсулина и метаболизма на глюкозата и мастните киселини. Резултатите от това проучване показват, че значителната загуба на тегло, предизвикана от бариатрична хирургия, увеличава експресията на гена на адипонектинова мастна тъкан и плазмените концентрации на адипонектин. Освен това експресията на гена на адипонектин в подкожната мастна тъкан се увеличава едновременно в депата на корема и бедрената мастна тъкан. Тези резултати предполагат, че загубата на тегло при изключително затлъстели лица води до генерализиран отговор в подкожната мастна тъкан, което води до повишено производство на адипонектин и плазмени концентрации. Следователно е вероятно метаболитните промени, предизвикани от загуба на тегло, в самата мастна тъкан да допринесат за повишаване на чувствителността към инсулин, което се случва при загуба на тегло.
Точният (ите) механизъм (и), отговорен (и) за индуцираното от загуба на тегло увеличение на производството на адипонектин в мастната тъкан, не е известен. Въпреки това, възпалителните цитокини, произведени от мастна тъкан, могат да участват в регулирането на производството на адипоцити на адипонектин чрез автокринни, паракринни и системни пътища. Инкубацията на подкожната мастна тъкан на корема с интерлевкин-6 и неговия разтворим рецептор ((16)) или фактор на туморна некроза-α ((16), (35)) потиска експресията на гена на адипонектин. Въпреки че не сме оценявали плазмените цитокини в нашето проучване, други изследователи са показали, че загубата на тегло може да намали концентрациите на плазмен интерлевкин-6 ((16), (26)) и фактор на туморна некроза-α ((36), (37)). В допълнение, андрогените намаляват плазмените концентрации на адипонектин ((38), (39)), а загубата на тегло води до намаляване на циркулиращите андрогени ((40)). Следователно е възможно промени в метаболизма на адипокин и андроген да допринесат за увеличаване на експресията на адипонектин, което наблюдаваме след GBS.
Малко проучвания са оценили хомогенността на експресията на гена на адипонектин в депата на мастна тъкан и резултатите от тези проучвания са противоречиви. В едно проучване експресията на адипонектин е по-висока при висцерални, отколкото при подкожни мазнини при лица с наднормено тегло ((14)), докато при други проучвания експресията на адипонектин е еднаква при висцерални и подкожни мазнини при затлъстели лица ((41), (42), (43)). Не са ни известни проучвания, които оценяват ефекта от загубата на тегло върху експресията на адипонектин в различни подкожни мазнини. Установихме, че както базалната експресия на адипонектин, така и предизвиканото от загуба на тегло регулиране на експресията на адипонектин са сходни в подкожните депа за мазнини в горната и долната част на тялото. Следователно факторите, които регулират експресията на гена на адипонектин и вероятно производството на адипонектин, влияят на подкожната мастна тъкан в тялото.
Загубата на тегло води до ∼75% увеличение на общите плазмени концентрации на адипонектин при нашите пациенти. Промяната в циркулиращия адипонектин е свързана с значително намаляване на инсулиновата резистентност, проявяващо се с %75% намаляване на стойностите на HOMA-IR. Адипонектинът повишава инсулиновата чувствителност в черния дроб, намалява производството на чернодробна глюкоза и увеличава окисляването на глюкоза в скелетните мускули ((1), (2), (3), (4)). Относителното значение на повишаването на концентрациите на адипонектин за подобряване на чувствителността към инсулин при нашите пациенти не може да бъде определено от нашето проучване. Данните от предишни проучвания установяват, че умерената загуба на тегло (7% до 8% от телесното тегло) подобрява инсулиновата чувствителност, оценена чрез HOMA-IR, без увеличаване на плазмените концентрации на адипонектин ((19), (20)). Следователно промените в концентрациите на адипонектин не са единствено отговорни за предизвиканото от загуба на тегло подобрение в действието на инсулина.
В обобщение, индуцирана от GBS загуба на тегло при изключително затлъстели жени причинява значително увеличение на експресията на гена на подкожната мастна тъкан на адипонектин и плазмените концентрации. Увеличаването на циркулиращия адипонектин вероятно допринася за подобряване на чувствителността към инсулин, наблюдавано след GBS. Необходими са обаче допълнителни проучвания, за да се определи независимият от загуба на тегло благоприятен ефект (и) от промените в плазмената концентрация на адипонектин върху действието на инсулина и клетъчния (те) механизъм (и), отговорен (и) за повишеното производство на адипонектин, предизвикано от загуба на тегло.
Благодарности
Авторите благодарят на Дженифър Маккреа и Мишел Кроче за техническа помощ. Това проучване беше подкрепено от NIH Grants DK37948, RR00036 (Общ клиничен изследователски център) и DK56341 (Отдел за клинично хранене).
- Ефект на изразена загуба на тегло върху експресията на гена на адипонектин и плазмените концентрации - PubMed
- Граници Адипонектин, Лептин и Висфатин при хипоксия и ефектът им за отслабване при затлъстяване
- Диета-индуцирано затлъстяване и загуба на тегло променят концентрацията на жлъчна киселина и чувствителния на жлъчните киселини ген
- Ефект от разрешаването на избор на диета върху отслабването Рандомизиран пробен анал на Internal Medicine Vol
- Ефект на L-карнитина върху загубата на тегло и телесния състав на плъхове, хранени с хипокалорична диета - PubMed