Субекти
Резюме
Въведение
Резултати
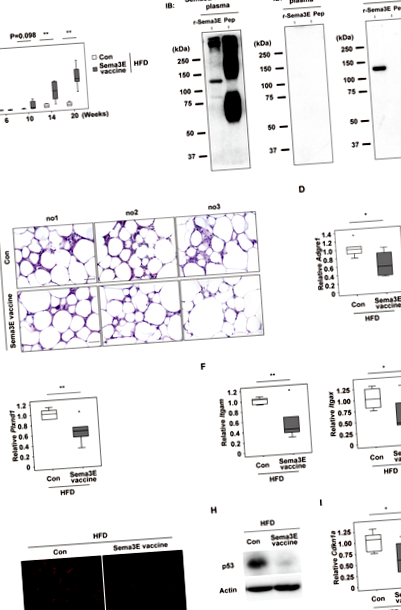
Ваксината Sema3E инхибира възпалението на мастната тъкан във висцералната мастна тъкан
Ваксината Sema3E подобрява системната непоносимост към глюкоза
Общоприето е, че хроничното стерилно възпаление на висцералната мастна тъкан има причинно-следствена роля в индуцирането на системна метаболитна дисфункция 1,2. Затова тествахме ефектите на ваксината Sema3E върху системния метаболизъм при мишки с диетично затлъстяване. Установихме, че няма разлика между контролната група и групата ваксина Sema3E по отношение на приема на храна (фиг. 2А), телесното тегло (фиг. 2Б), теглото на eWAT (фиг. 2С) и обема на висцералните мазнини, оценени чрез CT (Фиг. 2D). Изследванията на метаболитни клетки показват, че консумацията на кислород (VO2), производството на CO2 (VCO2), съотношението на дихателния обмен (RER) и енергийните разходи (EE) са сравними между контролната група и групата ваксина Sema3E (фиг. 2E). Системният толеранс към глюкозата обаче е по-добър в групата на ваксините Sema3E според теста за глюкозен толеранс (фиг. 2F), което показва, че ваксината подобрява системното метаболитно здраве, както и потиска възпалението във висцералната WAT.
Характеризиране на имунния отговор към ваксината Sema3E
За да изследваме потенциалния имунен отговор към ваксината Sema3E, анализирахме циркулиращи имунни клетки, но не открихме разлики между групите (фиг. 3А, В). Тестът за ензимно свързан имуноспот (ELISpot) е извършен, като се използват спленоцити от ваксинната група Sema3E, за да се характеризира реактивността на Т-клетките. Лечението с KLH доведе до увеличаване на производството на IL-4 или IFN-γ от спленоцитите, докато рекомбинантният протеин Sema3E нямаше ефект в този тест (Фиг. 3С, D). Тези резултати показват, че KLH съдържа епитопи за Т клетки, както се съобщава по-рано 5, докато протеинът Sema3E не предизвиква имунен отговор от Т клетки, събрани от ваксинирани мишки. Взети заедно, тези резултати предполагат, че пептидната ваксина, насочена към Sema3E, може потенциално да се превърне в терапевтичен вариант за диабет и/или нездравословно затлъстяване в бъдеще.
Дискусия
Материали и методи
Проектиране и синтез на ваксината
За генериране на неутрализиращи антитела за Sema3E са избрани две антигенни пептидни последователности (обхващащи аминокиселини 385–394 и аминокиселини 359–368 от Sema3E) въз основа на предишни доклади (Pang Z, и др. 5). N-краят или лизинът на всеки кандидат-пептид се конюгира с хемоцианин на лимфен отвор (KLH) чрез глутаралдехид, а синтетичните пептиди се пречистват чрез високоефективна течна хроматография с обратна фаза (> 99% чистота) (Peptide Institute Inc., Osaka, Япония), както е описано по-рано 6 .
Модели на животни
Всички експерименти с животни са проведени в съответствие с протокола, прегледан от Институционалния комитет по грижа и употреба на животните на Университета в Ниигата и одобрен от президента на Университета в Ниигата. Мишките C57BL/6NCr са закупени от SLC Japan (Shizuoka, Япония) и са хранени с високомаслена диета (HFD) (CLEA Япония, Токио, Япония) или нормална чау на възраст от 4 до 20 седмици. Всеки конюгиран с KLH антигенен пептид (20 ug) и еднакъв обем пълен или непълен адювант на Freund (Sigma-Aldrich: F5881 (пълен) или F5506 (непълен)) се емулгират чрез завихряне. За имунизация мишките се инжектират подкожно с KLH-конюгиран пептид на възраст 6 седмици (с пълен адювант на Freund), 10 седмици (с непълен адювант на Freund) и 14 седмици (с непълен адювант на Freund). Контролните групи получават еднакъв обем KLH, смесен с пълен или непълен адювант на Freund. Плазма се събира от опашната вена на всяка мишка за анализ на титрите на антителата.
Измерване на титъра на антителата
Титърът на антителата, генериран чрез инжектиране на всеки пептид, се измерва с ELISA. Микротитърна плака с 96 ямки (Nunc-Immuno MicroWell 96 ямкова твърда плака, Thermo Scientific) беше покрита с един от антигенните пептиди, конюгирани с говежди серумен албумин (BSA) в карбонатен буфер. След покритие, плазмата, събрана от имунизирани мишки, се добавя към ямките и се инкубира през нощта. След това плаката беше инкубирана с вторичното антитяло (ECL Anti-миши IgG, хрян пероксидаза свързано цяло овче антитяло, GE Healthcare). След реакция с TMB субстрата (Sigma-Aldrich, T0440), оптичната плътност беше измерена при 450 nm (OD450) с помощта на четец за микротитърни плочи (iMark четец за микроплаки, Bio-Rad).
Физиологични анализи
Мишките се настаняват индивидуално за проследяване на телесното им тегло и приема на храна. Затлъстяването се изследва чрез CT сканиране (LaTheta, Aloca) съгласно протокола на производителя. CT сканирането се извършва на интервали от 2 mm от диафрагмата до основата на коремната кухина. Консумацията на кислород се измерва при 20-седмични мишки с помощта на метаболитна система за измерване на O2/CO2 (Columbus Instruments) в съответствие с инструкциите на производителя.
Лабораторни изследвания
Тестът за толерантност към интраперитонеална глюкоза (IGTT) се извършва, както е описано по-рано, с леки модификации и глюкозата се дава интраперитонеално в доза от 1 g kg -1 (телесно тегло) 4. Периферните бели кръвни клетки от имунизирани мишки бяха преброени от Oriental Yeast Co. (Токио, Япония).
Хистологични анализи и имунооцветяване
Проби от епидидимална бяла мастна тъкан (WAT) бяха събрани, фиксирани за една нощ в 10% формалин, вградени в парафин и разделени за имунофлуоресценция или оцветяване с хематоксилин-еозин (HE). Извършено е оцветяване за реактивни кислородни видове (ROS), както е описано по-горе 4,7. За имунооцветяване депарафинизираните срезове бяха извлечени с цитратен буфер и инкубирани с анти-PlexinD1 антитяло (Abcam, ab28762) при разреждане 1:50. Anti-Goat IgG Cy5-конюгиран (Abcam, ab6566) се използва като вторично антитяло. Секциите бяха оцветени с пшеничен зародиш аглутинин, конюгат Alexa Fluor 488 (Invitrogen, W11261, 1:10) и Hoechst (Life Technologies, 33258, 1: 1000) и заснети с Biorevo (Keyence Co., Осака, Япония).
РНК анализ
Извършва се екстракция на РНК и PCR в реално време (qPCR), както е описано по-рано 4, като се използват следните праймери. Rplp0 се използва като вътрешен контрол.
Adgre1: GGAGGACTTCTCCAAGCCTATT, AGGCCTCTCAGACTTCTGCTT
Ccl2: CATCCACGTGTTGGCTCA, GATCATCTTGCTGGTGAATGAGT
Cd4: ACACACCTGTGCAAGAAGCA, GCTCTTGTTGGTTGGGAATC
Cd8: CTCACCTGTGCACCCTACC, ATCCGGTCCCCTTCACTG
Cd19: AAGGTCATTGCAAGGTCAGC, CTGGGACTATCCATCCACCA
Cd335: ACACTACTCATCACAGGAGGTGTT, GTTGAAAGGTCAAACTCCCAAT
Cdkn1a: TCCACAGCGATATCCAGACA, GGACATCACCAGGATTGGAC
Itgam: CAATAGCCAGCCTCAGTGC, GAGCCCAGGGGAGAAGTG
Itgax: ATGGAGCCTCAAGACAGGAC, GGATCTGGGATGCTGAAATC
Ly6g: GGCTCAGAAAAGTGCACCA, CGTACGTGGAAGCGAACAG
Plxnd1: CTGGATGTCCATCTGCATGT, CAGGAAGAACGGCTCACCTA
Rplp0: GATGCCCAGGGAAGACAG, ACAATGAAGCATTTTGGATAA.
Western blot анализ
Анализът на Western blot беше извършен, както е описано по-рано 4. Първичните антитела са анти-р53 (1С12) антитяло (Cell Signaling, # 2524) и анти-актиново антитяло (Cell Signaling, # 4970), които се използват при разреждане 1: 1000. За Western blot анализ на миша плазма, рекомбинантен миши протеин Sema3E с пълна дължина (R&D, 3238-S3) и антигенният пептид, конюгиран с BSA, бяха разделени в буфера (10 mM Tris-HCl, pH 7,8, 150 mM NaCl, 1 mM EDTA) и се подлага на SDS-PAGE. Мембраната се инкубира с плазма, събрана от мишки, имунизирани с антигенния пептид или KLH (1: 200 разреждане) или с анти-Sema3E антитяло (Santa Cruz, sc-49733) (1: 1000 разреждане) като основно антитяло, последвано от инкубация с конюгиран с хрян пероксидаза антимиши имуноглобулин G (Jackson Immunoresearch, # 115-035-003) или антикози имуноглобулин G (Jackson Immunoresearch, # 705-035-003).
ELISPOT анализ
ELISPOT анализите за INF-γ и IL-4 бяха извършени с използване на Mouse IFN-γ ELISpot PLUS и Mouse IL-4 ELISpot PLUS (MABTECH Inc., 3321-4HST-2 за IFN-γ и 3311-4HPW-2 за IL-4) според инструкциите на производителя. Накратко, суспензии от спленоцити от имунизирани мишки бяха добавени към 96-гнездните плаки за анализ ELISpot (10 6 клетки на гнездо) и стимулирани с 10 μg/mL рекомбинантен миши Sema3E протеин (R&D, 3238-S3), 10 μg/mL KLH (WAKO, 080-07666), или PBS (Con) при 37 ° С за 48 часа. Плаките се измиват с PBS и се инкубират с конюгирани с биотин антитела за откриване в продължение на 2 часа при стайна температура. След измиване плаките се инкубират с HRP-конюгиран стрептоавидин в продължение на 1 час при стайна температура, последвано от инкубация с TMB субстрат. Цветните петна бяха заснети с помощта на дисекционен микроскоп и преброени с помощта на софтуера ImageJ.
Статистически анализ
Статистическият анализ беше направен със софтуер SPSS (версия 20). Резултатите са показани като средната стойност ± SEM. Отклоненията бяха изключени чрез анализ на парцела. Разликите между групите бяха изследвани от двустранния студент т-тест, чрез повтарящи се мерки за времеви изследвания (тест за толерантност към глюкоза) или двупосочен ANOVA, последван от тест за множество сравнения на Tukey. Във всички анализи, P
Препратки
Hotamisligil, G. S., Shargill, N. S. & Spiegelman, B. M. Адипозна експресия на тумор некротизиращ фактор-алфа: пряка роля в свързаната със затлъстяването инсулинова резистентност. Наука 259, 87–91 (1993).
Ouchi, N., Parker, J. L., Lugus, J. J. & Walsh, K. Adipokines при възпаление и метаболитно заболяване. Nat Rev Immunol 11., 85–97 (2011).
Минамино, Т. и др. Решаваща роля за мастната тъкан p53 в регулирането на инсулиновата резистентност. Nat Med 15, 1082–1087 (2009).
Шимизу, аз. и др. Индуцираното от семафорин3Е възпаление допринася за инсулинова резистентност при диетично затлъстяване. Cell Metab 18., 491–504 (2013).
Панг, Z. и др. Терапевтичната ваксина срещу DPP4 подобрява метаболизма на глюкозата при мишки. Proc Natl Acad Sci САЩ 111, E1256–1263 (2014).
Nakagami, F. и др. Намаляване на кръвното налягане и регресия на сърдечно-съдовите усложнения от ангиотензин II ваксина при мишки. PLoS One 8, e60493 (2013).
Шимизу, аз. и др. p53-индуцираното възпаление на мастната тъкан е критично свързано с развитието на инсулинова резистентност при сърдечна недостатъчност. Cell Metab 15, 51–64 (2012).
Shimizu, I., Yoshida, Y., Suda, M. & Minamino, T. ДНК отговор на увреждане и метаболитно заболяване. Cell Metab 20., 967–977 (2014).
Xu, M. и др. Насочването към стареещите клетки подобрява адипогенезата и метаболитната функция в напреднала възраст. Elife 4 (2015).
Zhu, Y. и др. Ахилесовата пета на застаряващите клетки: от транскриптома до сенолитичните лекарства. Старееща клетка 14., 644–658 (2015).
Tchkonia, T., Zhu, Y., van Deursen, J., Campisi, J. & Kirkland, J. L. Клетъчно стареене и остаряващ секреторен фенотип: терапевтични възможности. J Clin Invest 123, 966–972 (2013).
Chang, J.H. и др. Изчистването на стареещите клетки чрез ABT263 подмладява остарелите хемопоетични стволови клетки при мишки. Природна медицина 22., 78– + (2016).
Бейкър, Д. Дж. и др. Естествените p16 (Ink4a) -положителни клетки съкращават здравословния живот. Природата 530, 184– + (2016).
Лейн, D. P. Рак. p53, пазител на генома. Природата 358, 15–16 (1992).
Nakagami, H., Koriyama, H. & Morishita, R. Пептидни ваксини за хипертония и захарен диабет. Ваксини (Базел) 2, 832–840 (2014).
Благодарности
Информация за автора
Йошко Йошида и Ипей Шимизу допринесоха еднакво.
Принадлежности
Катедра по сърдечно-съдова биология и медицина, Университет Ниигата, Висше училище по медицински и дентални науки, Ниигата, Япония
Йоко Йошида, Ипей Шимидзу, Юка Хаяши, Рютаро Икегами, Масайоши Суда, Горо Кацууми, Такауки Вакасуги, Масааки Накао и Тору Минамино
Отдел за молекулярно стареене и клетъчна биология, Университет Ниигата, Висше училище по медицински и дентални науки, Ниигата, Япония
Йоко Йошида и Ипей Шимизу
Катедра за развитие на здравето и медицина, Медицински факултет на университета в Осака, Осака, Япония
Катедра по клинична генна терапия, Медицински факултет на университета в Осака, Осака, Япония
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Вноски
Професор Тору Минамино е гарант за тази работа и е имал пълен достъп до всички данни в изследването и поема отговорност за целостта на данните и точността на анализа на данните. Y.Y. и е. пише ръкописа и проучва данни. Y.H., R.I., M.S., G.K., T.W., M.N., H.N. и R.M. изследвани данни Т.М. прегледа/редактира ръкописа и ръководи целия проект.
Автора за кореспонденция
Етични декларации
Конкуриращи се интереси
Авторите не декларират конкуриращи се интереси.
Допълнителна информация
Бележка на издателя: Springer Nature остава неутрален по отношение на юрисдикционните претенции в публикувани карти и институционални принадлежности.
- Модифицирана отвара от лингвижуган, включена с диетични ограничения и упражнения подобрява
- Скрининг за затлъстяване и неоткрита непоносимост към глюкоза сред служители от висше здравно заведение
- Роли на вестибуларната система при затлъстяване и нарушен метаболизъм на глюкозата при диети, хранени с високо съдържание на мазнини
- Нарастването на никеловите хранителни алергии, обвързано с диетичната промяна Dermatology Times и Multimedia Medical, LLC
- Сънят и бодърстването се контролират от вентрален медиален среден мозък GABAergic неврони при мишки