Чен-Гуанг Шан
Катедра по акушерство и гинекология, Първа болница в Пекинския университет, Пекин 100034, Китай
Жао-Хуей Лю
Катедра по акушерство и гинекология, Първа болница в Пекинския университет, Пекин 100034, Китай
Сяо-Хуей Уанг
Катедра по акушерство и гинекология, Първа болница в Пекинския университет, Пекин 100034, Китай
Zong-Hao Feng
Катедра по акушерство и гинекология, Първа болница в Пекинския университет, Пекин 100034, Китай
Ян Джанг
Катедра по акушерство и гинекология, Първа болница в Пекинския университет, Пекин 100034, Китай
Резюме
Заден план:
Епидемиологичните и генетични изследвания предполагат връзка между инсулинова резистентност (IR) и рак на ендометриума, а ендометриалната хиперплазия (EH) е предраков стадий на рак на ендометриума. Адипонектинът е адипокин, който по-рано е доказано, че е рисков фактор за рак на ендометриума. Целта на изследването е да се разработи модел на плъхове на IR и EH и да се оцени адипонектиновата система в кръвообращението и матката.
Методи:
Това проучване е 46-седмично изпитване върху животни от февруари 2014 г. до януари 2015 г. Женските плъхове Sprague-Dawley са били хранени с високомаслена диета (HFD) в продължение на 40 седмици, за да предизвикат IR. Последвано от овариектомизация, плъховете се прилагат орално до 17β-естрадиол (Е2) в продължение на 4 седмици, за да се индуцира ЕН и след това се жертват. Общо 36 плъхове бяха разделени в четири групи: E2, HFD, HFD + E2 и контролни групи. Данните бяха анализирани с t-тест на Student, еднопосочен дисперсионен анализ (ANOVA) и U-тестове на Mann-Whitney. Хи-квадрат се използва за оценка на резултата от имунохистохимията.
Резултати:
Дебелината на ендометриума, жлезистия епител и миометриума в групата HFD-E2 са по-високи от групата E2 (F = 59,02, F = 23,51 и F = 12,53, съответно всички ключови думи: Адипонектин, Адипонектинови рецептори, Естрадиол, Инсулинова резистентност
ВЪВЕДЕНИЕ
В това проучване ние изградихме модел на плъх с IR и EH и имахме за цел да анализираме морфологични ефекти, индуцирани в матката на плъхове след диета с високо съдържание на мазнини (HFD) и лечение с естроген. Също така наблюдаваме промените в плазмените нива на адипонектин и определяме експресията на маточния адипонектин и неговите рецептори в модела на плъхове.
М ЕТОДИ
Етично одобрение
Протоколът с животни в това проучване беше прегледан и одобрен от Първата болница в Пекинския университет (№ J201305). Насоките за използване и грижи за лабораторни животни са спазени в съответствие с насоките на Националния съвет за здраве и медицински изследвания на Китай.
Животни
Бяха закупени женски плъхове Sprague-Dawley (на възраст 8 седмици) (Vital River Laboratory Animal Co. Ltd., Пекин, Китай, лиценз №: SCXK [Пекин] -2012-0001) и жертвани 46 седмици след лечението. Животните получиха достъп до храна и вода ad libitum и бяха настанени при стандартизирани условия (стайна температура, 23 ° C ± 2 ° C; относителна влажност, 50% ± 5%; честа вентилация; и график на осветяване от 12 часа светлина/12 з тъмно).
Модел на плъх на инсулинова резистентност и хиперплазия на ендометриума
Експериментални групи
След период на аклимация от 1 седмица, общо 36 плъхове бяха разделени на случаен принцип в четири групи (n = 9 на група): (1) HFD-E2 групата беше захранена с HFD и OVX, последвана от администриране с E2; (2) групата Е2 се захранва със StD и OVX, последвана от администриране с Е2; (3) HFD групата се захранва с HFD и OVX, последвана от администриране с носител (зехтин); и (4) контролната група получи StD и фалшив OVX, последван от администриране с носител. Последвано от хранене със StD или HFD в продължение на 40 седмици, животните са били фалшиви OVX или OVX и са преминали през период на възстановяване от 1 седмица. Плъховете се умъртвяват след приложение с носител или Е2 в продължение на 4 седмици. Теглото на тялото и приема на храна се записват на всеки 2 седмици. В края на експеримента всички животни бяха лишени от храна в продължение на 12 часа и след това анестезирани. Матките се отстраняват и подрязват, последвано от претегляне (мокро тегло на матката). След това матките се поставят между навлажнена филтърна хартия, внимателно се притискат, за да се отстрани луминалната течност, и се претеглят отново (маточно изтрито тегло). Сегмент от маточен рог беше фиксиран в 10% неврален буфер формалин за 24 часа, дехидратиран в степенувана етанолова серия, изчистен в ксилол и вграден в парафин. Маточните срезове от 5 μm бяха рутинно оцветени с оцветяване с хематоксилин и еозин.
Биохимични анализи
За определяне на плазмения адипонектин, кръвни проби се събират от коремната аорта, като се използват епруветки, съдържащи хепарин, и се центрофугират при 3000 × g в продължение на 10 минути и се съхраняват при -80 ° C, докато се извършат измерванията. Плазмените нива на адипонектин се определят с търговски наличен ензимно-свързан имуносорбентен комплект за анализ (R&D System, Минеаполис, САЩ) съгласно инструкциите на производителя. Обхватът на откриване на анализа е 0.2-10.0 ng/ml, а чувствителността е 0.023 ng/ml. Коефициентите на вариация в рамките на интра- и междинния анализ бяха -ΔΔCt) и изразени като промяна в сгъването спрямо контролата.
Имунохистохимия
Извършен е имунохистохимичен анализ, за да се открие експресията на протеини на адипонектиновата система. Серийните 3 μm маточни секции бяха депарафинизирани, рехидратирани и инкубирани за 10 минути в метанол, съдържащ 3% H2O2. Извличането на антиген се получава при използване на вътрешно налягане за 2,5 минути при максимално налягане с 0,01 mol/L цитратен буфер (рН 6,0). След инкубация в нормален кози серум в продължение на 1 час при стайна температура, секции бяха инкубирани с първичен анти-адипонектин (1: 250, Abcam, Великобритания), анти-адипонектинов рецептор 1 (разреден 1: 250, Abcam, Великобритания), анти-адипонектин рецептор 2 (1: 250, Abcam, UK) антитяло за една нощ при 4 ° C. Първичните антитела се използват при 1: 250. Имунохистохимията се извършва с помощта на стрептавидин/пероксидазен комплект съгласно протокола на ръкописа (ZSGB-BIO, Пекин, Китай). Имунооцветени срезове бяха изследвани чрез светлинна микроскопия от двама изследователи и полуколичествено получени в зависимост от интензивността на оцветяване по скала от 0 (без оцветяване) до 3+ (силно оцветяване). Тъкани с 2+ или 3+ оцветяване в повече от 10% от клетките се считат за положителни за протеинова експресия. [16] Наблюдават се и се снимат с микроскоп оцветени диапозитиви (Олимп, Токио, Япония).
статистически анализи
Статистическият анализ беше извършен с помощта на софтуер за статистически продукти и услуги (SPSS, версия 16.0, SPSS Inc., Чикаго, IL, САЩ). Данните се отчитат като средна стойност ± стандартна грешка (SE). Разликите между две групи бяха оценени с помощта на t-тест на Student или непараметрични U-тестове на Mann-Whitney. Извършени са многостранни сравнения с помощта на еднопосочен дисперсионен анализ (ANOVA), последван от тест за най-малко значима разлика. Хи-квадрат тест е използван за оценка на честотата на имунооцветяване по групи. Всички P стойности бяха двустранни и P ESULTS
Диети с високо съдържание на мазнини върху телесното тегло и метаболизма на глюкозата
маса 1
Телесно тегло и биохимични параметри при плъхове след 40 седмици от посочената диета
| Телесно тегло (g) | 402,19 ± 13,49 | 542,14 ± 19,07 | 6.06 | ,† | 75,57 ± 4,72 *, † | 33,33 | ,‡ | 20.21 | ,‡ | 16.68 | ,†, ‡ | 59.02 | ,†, ‡ | 23.51 | ‡ | 4.20 | 0,013 |
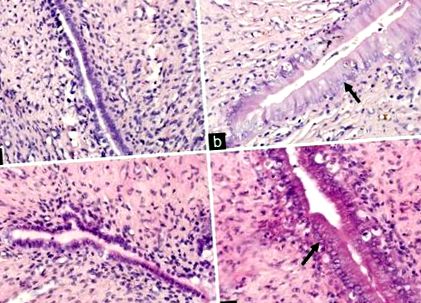
| Дебелина на маточния миометриум (µm) | 383,86 ± 21,53 | 451,63 ± 25,83 | 360,86 ± 32,40 | 623,64 ± 48,26 *, †, ‡ | 12.53 | † P ‡ P Таблица 2]. Морфологичните находки в матките на всички животни, количествено и представени в таблица 2, също показват ефекта на Е2. В контролната група нормалните епителни клетки на ендометриума се характеризират с луминални и жлезисти епителни клетки с кубовидна форма, с ядро, ориентирано в центъра на клетките [Фигура 1а]. В групата с HFD, които са били подложени на OVX, но не и на E2, са показани малки маточни рога, а пикочният и жлезистият епител е атрофичен, което показва прости ниски колоновидни клетки и ниско съотношение между цитоплазма и ядро [Фигура 1в] За разлика от тях, хиперпластичният ендометриум, който се развива в групи E2 и HFD-E2, се характеризира с увеличени маточни рога и по-високи или псевдостратифицирани колоновидни луминални и жлезисти епителни клетки и по-високо съотношение цитоплазма към ядрото [Фигура [Фигура1b 1b и and1d]. 1г]. Дебелината на маточния луминален и жлезист епител и миометриума в групата на HFD-E2 е значително по-висока от групата на E2 [F = 59,02, F = 23,51 и F = 12,53, съответно, P Таблица 2]. Сквамозната интраепителна метаплазия е открита както в луминалния, така и в жлезистия епител, а процентът на сквамозно-епителната метаплазия в групата на HFD-E2 е 66,7% при 33,3% в групата E2. |
Представителни микроскопични изображения на оцветяване с хематоксилин и еозин в тъканите на матката (първоначално увеличение, × 400). Черните стрелки сочат към ендометриума с висока колона. (а) Контролна група, стандартна диета + фалшива овариектомия + носител; (b) Е2 група, стандартна диета + овариектомизирана + 17β-естрадиол; (в) HFD група, диета с високо съдържание на мазнини + овариектомизирана + носител; (г) HFD-E2 група, диета с високо съдържание на мазнини + овариектомизирана + 17β-естрадиол.
Адипонектин в плазмата
За да се изследва адипонектин в циркулация, плазмените нива на адипонектин са показани на фигура 2. В сравнение с контролната група, плазмените нива на адипонектин са значително по-високи при плъхове с HFD (контролна група: 6,28 ± 0,79 μg/ml спрямо група с HFD: 9,23 ± 0,72 μg/ml, F = 13,15, P 0,05). Нивата на тРНК за адипонектинови рецептори се откриват в маточната тъкан, но няма значителна разлика в нивата на мРНК ADIPOR1 и ADIPOR2 сред всички групи [Фигура 3].
Относителни нива на иРНК на адипонектин (а), адипонектинов рецептор 1 (б) и адипонектинов рецептор 2 (в) в матката на плъхове. Резултатите представляват средната стойност ± стандартна грешка. * P Фигура 4]. Експресията на адипонектинов протеин е по-висока както в групите E2, така и в HFD-E2 в сравнение с контролната група [P = 0,131, контролна група спрямо група E2 или HFD-E2 група; Таблица 3]. В сравнение с групата с HFD, експресията на адипонектинов протеин е значително по-висока в групата с HFD-E2 [88,9% срещу 11,1%, Р = 0,003; Таблица 3]. Въпреки това, няма значителна разлика в експресията както на AdipoR1, така и на AdipoR2 сред четирите групи.
Имунохистохимичен анализ на експресията на адипонектин и AdipoR1 и AdipoR2 в ендометриума на плъхове (първоначално увеличение, × 400). Черните стрелки сочат към адипонектин протеиново положително оцветяване в ендометриума. n = 9 във всяка група. Контрол: Стандартна диета + фалшива овариектомия + носител; E2: Стандартна диета + овариектомизирана + 17β-естрадиол; HFD: Диета с високо съдържание на мазнини + овариектомизирана + носител; HFD-E2: Диета с високо съдържание на мазнини + овариектомизирана + 17β-естрадиол; AdipoR: Адипонектинов рецептор.
Таблица 3
Имунохистохимичен анализ на експресията на адипонектин и AdipoR протеин в ендометриума (n = 9)
| Адипонектин | 4 (44,4) | 8 (88,9) | 1 (11.1) | 8 (88,9) * |
| AdipoR1 | 2 (22,2) | 4 (44,4) | 7 (77,8) | 4 (44,4) |
| AdipoR2 | 5 (55,6) | 4 (44,4) | 7 (77,8) | 3 (33,3) |
Стойностите бяха представени като n (%). Интензивността на оцветяването се оценява, както следва: 0, отрицателна; 1, Слаб; 2, умерено; 3, силен. Пробите с резултати ≥2 са положителни. * P = 0,003, спрямо HFD група. Контрол: Стандартна диета + фалшива овариектомия + носител; E2: Стандартна диета + овариектомизирана + 17β-естрадиол; HFD: Диета с високо съдържание на мазнини + овариектомизирана + превозно средство; HFD-E2: Диета с високо съдържание на мазнини + овариектомизирана + 17β-естрадиол; AdipoR: Адипонектинов рецептор.
D ИСКУСИЯ
Тук направихме модел на плъх, при който плъховете бяха поставени на HFD, за да индуцират IR и приложени с естрадиол, за да индуцират EH. Също така сме изследвали ефекта на HFD и 17β-естрадиол върху плазмената концентрация на адипонектин и маточната адипонектинова система.
Имаше няколко ограничения на настоящото проучване. Първо, броят на плъховете нямаше достатъчно мощност, за да открие разликата по отношение на липидния профил в циркулацията и адипонектиновите рецептори в матката, поради което са необходими допълнителни изследвания с по-голям размер на пробата. Второ, трябва да има и други групи, включително плъхове OVX, хранени със StD, и плъхове с фалшив OVX, хранени с HFD, за да се потвърди ефектът от метаболитно разстройство и естроген върху лезията на ендометриума.
В обобщение, констатациите в модела на плъхове на HFD-индуциран IR и 17β-естрадиол-индуциран EH показват, че състоянието на IR или хиперинсулинемия, модулирани маточни редувания. Плазмените нива на адипонектин се регулират както от метаболитно състояние, така и от стероидни хормони, като естрадиол. Въпреки това, адипонектиновият протеин в матката се повлиява главно от естрадиол, който се различава от нарушения, свързани с метаболитни нарушения, включително IR. Въпреки това са необходими допълнителни проучвания, за да се изясни дали адипонектинът действа на нивото на матката, за да регулира сигналните пътища като AMP-активирана протеин киназа.
Финансова подкрепа и спонсорство
Тази работа е подкрепена с безвъзмездна финансова помощ от Националната фондация за естествени науки на Китай (№ 81272870).
- Граничен ефект на хипопротеиновите и високомазнинните диети върху пропускливостта на хипокампалната кръвно-мозъчна бариера
- Ефект на хипопротеиновите и диети с високо съдържание на мазнини върху
- Casitas B-Lineage Lymphoma RING Домейни инхибитори предпазват мишките от диета, предизвикана от високо съдържание на мазнини
- ФОКАЛНА НОДУЛАРНА ХИПЕРПЛАЗИЯ НА ЧЕРНИЯ ЧАЙ - AIMIS
- Премахване на хранителните разстройства по основната причина - Хедър Дейн