Стефани дьо Гроот
1 Катедра по медицинска онкология, Медицински център на Университета в Лайден, Albinusdreef 2, P.O. Box 9600, 2300RC Leiden, Холандия
Хано Пийл
2 Катедра по ендокринология, Медицински център на Университета в Лайден, P.O. Box 9600, 2300RC, Лайден, Холандия
Jacobus J. M. van der Hoeven
1 Катедра по медицинска онкология, Медицински център на Университета в Лайден, Albinusdreef 2, P.O. Box 9600, 2300RC Leiden, Холандия
Джудит Р. Кроп
1 Катедра по медицинска онкология, Медицински център на Университета в Лайден, Albinusdreef 2, P.O. Box 9600, 2300RC Leiden, Холандия
Свързани данни
Резюме
Нарастващите предклинични доказателства показват, че краткосрочното гладуване (STF) предпазва от токсичност, като същевременно повишава ефикасността на различни химиотерапевтични средства при лечението на различни видове тумори. STF засилва устойчивостта на стрес на здравите клетки, докато туморните клетки стават още по-чувствителни към токсините, може би поради недостиг на хранителни вещества, за да задоволят нуждите си в контекста на високи нива на разпространение и/или загуба на гъвкавост при реакция при екстремни обстоятелства. При хората STF може да бъде осъществим подход за повишаване на ефикасността и поносимостта на химиотерапията. Клиничните изследвания, оценяващи потенциала на STF, са в зародиш. Този преглед се фокусира върху молекулярния фон, съвременните познания и клиничните проучвания, оценяващи ефектите на STF при лечението на рак. Предварителните данни показват, че STF е безопасен, но предизвикателен при пациенти с рак, получаващи химиотерапия. Текущите клинични изпитвания трябва да се разгадаят, ако STF може също да намали токсичността и да увеличи ефикасността на химиотерапевтичните режими в ежедневната практика.
Заден план
Хроничното ограничаване на калориите намалява и забавя честотата на рака и инхибира прогресията на тумора и метастазите при гризачи [1–5]. Съответно, честотата и смъртността от рак са силно намалени при хронични калории с ограничени калории примати [6]. Изследванията на дългосрочно ограничени калории при хора са показали намаляване на метаболитните и хормоналните фактори, свързани с риска от рак [7–9]. Хроничното ограничаване на калориите обаче не е осъществима клинична интервенция. Очевидните трудности, като дългия период, необходим за ефективност, и неприемливата загуба на тегло [10, 11] възпрепятстват клиничното приложение при пациенти с рак.
За разлика от повечето терапии за рак, STF има само леки странични ефекти, като главоболие, световъртеж, гадене, слабост и краткосрочна загуба на тегло при хората [26]. Следователно STF е обещаваща стратегия за повишаване на ефикасността и поносимостта на химиотерапията при пациенти с рак, особено тъй като STF е достъпен и достъпен подход и е потенциално ефективен при голямо разнообразие от тумори [12]. Въпреки това, пациентите с тежка загуба на тегло, саркопения, кахексия или недохранване вероятно не са добри кандидати за STF интервенция [27, 28]. Последните насоки препоръчват да се увеличи консумацията на протеини и мазнини при пациенти с кахексия [29, 30]. По този начин, STF може да бъде особено полезен за относително годни пациенти, лекувани с (нео) адювантна химиотерапия.
Този разказ ще обхване текущите познания за молекулярните механизми, обясняващи „диференциална устойчивост на стрес“ на здрави и ракови клетки в отговор на STF. Освен това, той обобщава наличните клинични данни, отразяващи въздействието на STF върху ефектите на химиотерапията при пациенти с рак. И накрая, текущите клинични проучвания на ефектите на STF при лечението на рак ще бъдат критично прегледани.
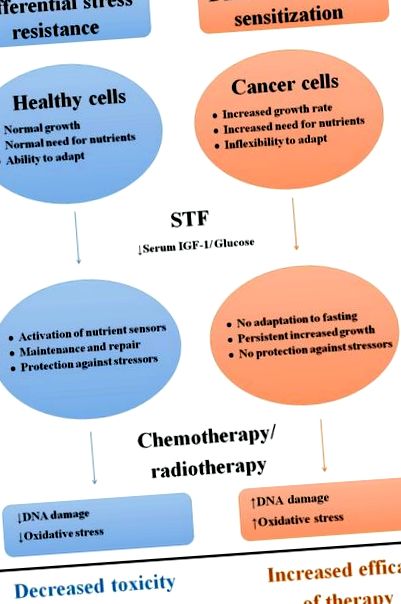
Диференциална устойчивост на стрес и сенсибилизация в отговор на STF
Схематичен преглед на диференциалните ефекти на краткосрочното гладуване върху здрави и ракови клетки.
Съкращения: STF; краткосрочно гладуване, IGF-1: инсулинов растежен фактор-1.
маса 1
Преглед на in vivo проучванията на ефекта на STF върху токсичността и/или ефикасността на химиотерапията, лъчетерапията и инхибиторите на тирозин киназа
Повишена ефикасност на CT,
Само STF е толкова ефективен, колкото само CT, Повишена преживяемост
Повишена ефикасност на CT
Само STF е толкова ефективен, колкото само CT
Повишената ефикасност на CT, само STF е също толкова ефективна, колкото CT само
(само подкожен модел)
24 часа STF (алтернативен)
Намалена токсичност за CT
Няма ефект върху ефикасността на CT
Намалена токсичност за CT
Няма ефект върху ефикасността на CT
Безопасно и осъществимо
Намаляване на повръщането
Без намаляване на IGF-1
STF Краткосрочно гладуване, CT химиотерапия, диета, имитираща гладно ящур
IGF-1 и инсулинът като ключови регулатори на DSR
IGF-1 и инсулинът стимулират пролиферацията и растежа и инхибират апоптозата в отговор на наличието на калории и протеини чрез сигнализиране чрез IGF-1 рецептора (IGF-1R) и инсулиновия рецептор изоформа A (IR-A), съответно [50-53]. Нивата на серумен IGF-1 намаляват по време на STF [54–56], тъй като ниските нива на инсулин причиняват устойчивост на растежен хормон (GH) на черния дроб, което инхибира производството на IGF-1 в черния дроб [54, 57, 58]. Както инсулинът, така и IGF-1 активират Ras/митоген-активирана протеин киназа (MAPK) и фосфатидилинозитол-3-киназа (PI3K)/Akt пътища. В здравите клетки инхибирането на пролиферацията и/или инвестицията в поддръжка може да допринесе за повишена устойчивост на стрес. Например, мишки с чернодробна делеция на Igf1 ген (LID), които са намалили нивата на IGF-1, подобни на тези по време на STF [59–61], показват повишена устойчивост към високи дози на различни химиотерапевтични агенти [42] и тази полза е обезсилена чрез администриране на IGF-1 [12, 42]. По този начин пътят IGF-1R изглежда е ключов медиатор на устойчивост на стрес в отговор на STF в здрави клетки.
По време на STF пътищата Ras/MAPK и PI3K/Akt се регулират надолу в раковите клетки, при което пролиферацията се инхибира [64]. По-специално, резистентност към растежа ограничаващи ефекти на STF се наблюдава в раковите клетки, носещи мутации, които причиняват конститутивно активиране на PI3K пътя, тъй като тези клетки се размножават дори при липса на инсулин или IGF-1 [65]. Следователно, пътят IGF-1R е ключов медиатор на растежа на раковите клетки и устойчивостта на рак към често използваните терапевтични средства [42, 66, 67]. По този начин намаляването на циркулиращите нива на IGF-1 и инсулина по време на STF може да допринесе и за противораковата активност [68].
AMPK и автофагия
АМР-активираната протеин киназа (AMPK) може да играе основна роля в DSR поради STF [69]. AMPK следи нивата на клетъчната енергия и се активира, когато съотношението ADP: ATP или AMP: ATP в клетката се увеличи [70]. AMPK инхибира енергоемките процеси, като клетъчна пролиферация и синтез на протеини, и активира енергогенериращи процеси, като гликолиза и окисляване на мастни киселини. Той инхибира растежа на клетките и стимулира автофагията [71]. Автофагията (на гръцки означава „самоядство“) е силно запазен катаболен процес сред еукариотите за преживяване на периоди на лишаване от хранителни вещества. Тази адаптивна реакция на клетката включва увредено разграждане на протеини и органели за генериране на аминокиселини като алтернативен източник на енергия [72, 73]. Активирането на AMPK и автофагията изглежда играят основна роля в защитните ефекти на STF в здравите клетки [17].
Въпреки това, ефектите от активирането на AMPK в отделни туморни клетки могат да варират, тъй като някои тумори съдържат конститутивно активен AMPK [74, 75], а други проявяват ниска AMPK активност [76–78]. Туморите с намалена активност на AMPK или автофагия могат да бъдат силно чувствителни към STF, тъй като активирането на AMPK засилва имунното наблюдение [40], докато туморите със силно активна AMPK или автофагия могат да бъдат резистентни [77, 79–82].
Метаболизмът на глюкозата и „ефектът на Варбург“
По време на STF здравите клетки имат метаболитна гъвкавост, за да се справят с лишаването от хранителни вещества, тъй като глюкозата може да бъде заменена от кетонни тела и мастни киселини като основен енергиен източник.
За разлика от това, туморните клетки зависят от глюкозата, за да поддържат високата скорост на клетъчна пролиферация [83, 84]. Akt стимулира така наречения „ефект на Варбург“, характеризиращ се с повишена скорост на гликолиза, а не с окислително фосфорилиране дори в присъствието на кислород [83–85]. STF регулира надолу анаеробна гликолиза, докато регулира нагоре окислителното фосфорилиране в туморните клетки и този „анти-Варбург ефект“ води до оксидативен стрес и апоптоза [14]. Също така, контраинтуитивното увеличаване на транслацията на протеин по време на STF увеличава неудовлетворените енергийни нужди, което води до клетъчна смърт [12]. Освен това 20–40% намаление на циркулиращата глюкоза по време на STF може да е достатъчно, за да убие аноксични туморни клетки [85]. По този начин намаляването на наличността на хранителни вещества по време на STF прави раковите клетки по-уязвими към всякакви предизвикателства, включително химиотерапия. Въпреки това, свръхконсумацията след период на STF може да ускори растежа на тумора поради високи условия на глюкоза и повишена гликолиза [86].
Реактивни видове кислород и увреждане на ДНК
Химиотерапевтичните агенти причиняват оксидативен стрес и увреждане на ДНК на здравите клетки, които са в основата на механизмите на токсичност [44, 87]. STF намалява оксидативния стрес в здравите клетки чрез регулиране на метаболизма и увеличаване на извличането на реактивни кислородни форми (ROS), което може да допринесе за DSR [33, 44]. Тъй като нивата на серумна глюкоза намаляват по време на STF, мастните киселини служат като основен източник на енергия. Бета-окисляването на мастни киселини води до кетонни тела, които могат да се използват като алтернатива/допълнително гориво. Кетонните тела могат също да активират пътища, включени в защитата срещу ROS [88]. Освен това STF вероятно активира процесите на възстановяване на ДНК в здрави клетки [22]. Например, при мишки, гладували в продължение на 24 часа преди инфузията на етопозид с висока доза, се наблюдава по-малко увреждане на ДНК в тънкочревните стволови клетки 3 часа след инфузията в сравнение с мишки, които са яли ad libitum. Тъй като 1,5 h след третирането ДНК увреждането е подобно, възстановяването на ДНК е вероятно по-ефективно в здрави клетки поради STF [21].
За разлика от това, туморните клетки показват повишено производство на ROS, ако химиотерапията се комбинира със STF in vitro [12]. В клетките на рак на гърдата, култивирани в среда с ниско съдържание на глюкоза или серум на гладуващи мишки, се наблюдава 20-кратно увеличение на увреждането на ДНК в отговор на химиотерапия, в сравнение с клетки, култивирани в обикновена среда или в серум на мишки, хранени с ad libitum [12].
Имунна компетентност
Химиотерапията причинява токсичност на костния мозък и изчерпване на циркулиращите имунни клетки, особено изчерпване на миелоидните клетки [89, 90]. Постенето предпазва хематопоетичните стволови клетки и циркулиращите имунни клетки от вредните ефекти на химиотерапията при мишки [22, 91]. Освен това, по-ефективният имунитет в резултат на STF вероятно причинява по-нисък процент на инфекции и фебрилна неутропения [92].
От друга страна, гладуването подобрява терапевтичния ефект на химиотерапията върху тумора евентуално чрез клетъчен имунитет при мишки, тъй като този ефект се обезсилва при nu/nu мишки, на които липсват Т клетки [40, 93]. По този начин, STF може да насърчи имунитета и представянето на тумор-асоциирани антигени (TAA), които насърчават ефикасен антитуморен имунитет, допринасящ за повишена ефикасност на химиотерапията [94].
От животински модели до клиниката
Предклиничните данни, документиращи ползите от STF, са изобилни и обещаващи. Въпреки това са подходящи думи за предпазливост по отношение на приложението му при пациенти с рак. Например, предклиничните проучвания показват тежка, макар и преходна загуба на тегло при животински модели (20–40% от общото телесно тегло след 24–48 часа на гладно [12, 19, 23, 39, 95]. За разлика от тях, въздействието на няколко дни гладуване върху телесното тегло на хората изглежда много по-скромно (
1 кг на ден, до голяма степен загуба на вода) [26], което вероятно се обяснява с метаболитни разлики между хората и мишките [95]. Това е успокояващо в контекста на безопасността. Това обаче може също да означава, че хората трябва да постит (много) по-дълъг период от време от мишките, за да получат същите ползи (вж. Дискусията по-долу). Следователно са необходими внимателно контролирани клинични проучвания, проследяващи растежа на тумора, както и неблагоприятните ефекти от различни диетични режими, преди диети, имитиращи гладуване (ЯБР), да могат да се прилагат в клиничната практика.
Метаболитни рискови фактори за рак
Затлъстяването е свързано с повишен риск от развитие на няколко вида рак, като рак на гърдата, рак на дебелото черво, рак на яйчниците, рак на ендометриума и рак на щитовидната жлеза [96, 97], а нивата на IGF-1 са положително свързани с риска от развитие на рак на гърдата и простатата [98, 99]. Нещо повече, затлъстяването и високите нива на инсулин и IGF-1, както и захарният диабет са свързани с по-лоша преживяемост при рак [100–103]. Субектите със затлъстяване често са хипергликемични и хиперинсулинемични в резултат на инсулинова резистентност. Въпреки че нивата на циркулиране на общия (свободен + свързан) IGF-1 са нормални или дори ниски при затлъстели индивиди, нивата на свободен (биоактивен) IGF-1 са по-високи от тези при слаби индивиди [104]. Както инсулинът, така и свободният IGF-1 могат да свържат IGF-1R и IR-A [105] и да активират Ras/MAPK и PI3K/AKT пътя, чрез който клетъчната пролиферация се стимулира и апоптозата се инхибира, съответно [106]. Освен това, предклинично, затлъстяването е свързано с натрупване на макрофаги в мастната тъкан, което води до имуносупресивна микросреда [107]. Тези метаболитни механизми могат да обяснят повишения риск от рак, както и по-лошата прогноза на няколко вида рак при затлъстели пациенти.
Клинични изследвания на гладно
Метаболитни промени по време на STF при хора
Клинични изследвания на STF по време на химиотерапия
Към днешна дата са публикувани няколко малки клинични проучвания при хора, изследващи ефектите на STF в комбинация с химиотерапия (Таблица (Таблица2) 2) [22, 131, 135–138]. Дизайнът и резултатите от тези проучвания при хора са обобщени по-долу.
Таблица 2
Преглед на клиничните проучвания за ефекта на STF върху токсичността на химиотерапията
Безопасно и осъществимо.
Намаляване на CT-индуцираните странични ефекти.
Безопасно и осъществимо.
Намаляване на CT-индуцираните странични ефекти a .
Безопасно и осъществимо .
Намалява увреждането на ДНК в левкоцитите (реакция на дозата).
Намаляване на IGF-1 (реакция на дозата).
Безопасно и осъществимо.
Намаляване на IGF-1
Благоприятен ефект върху еритроцитите и тромбоцитите
Възможно намаляване на увреждането на ДНК в здрави клетки
Безопасно и осъществимо
Благоприятен ефект върху QOL, умора и благосъстояние
USC University of Southern California, KFMC King Fahad Medical City, LUMC University University Medical Center, UC Davis University of California, Davis School of Veterinary Medicine, STF Краткосрочно гладуване, IF периодично гладуване, CT химиотерапия, TAC доцетаксел/доксорубицин/циклофосфамид, IGF-1 инсулиноподобен растежен фактор-1, QOL Качество на живот a не са извършени статистически данни
В медицинския град King Fahad беше проведено клинично изпитване (> NCT00757094), за да се оцени безопасността и възможността за комбиниране на химиотерапия и периодично гладуване (включително течности) по време на Рамадана [135]. Единадесет пациенти с различни видове злокачествени заболявания получиха един подарък химиотерапия. Страничните ефекти и кръвната картина бяха сравнени със стойности, измерени в отговор на подобна доза химиотерапия, дадена 2 седмици след края на Рамадан. Авторите заключават, че съчетаването на гладно и химиотерапия през месец Рамадан се понася добре и е безопасно. Страничните ефекти на химиотерапията обикновено са по-малко. Тъй като обаче изследваната група беше малка, не бяха проведени статистически данни. Освен това, поради краткия период на гладуване (приблизително 12 часа), може да не се очакват големи ползи, тъй като нивата на IGF-1 очевидно няма да бъдат намалени [140].
И накрая, Bauerfeld et al. публикува рандомизирано кръстосано проучване (> NCT01954836), оценяващо ефекта на STF върху качеството на живот при пациенти с рак на гърдата и рак на яйчниците, лекувани с химиотерапия [138]. Пациентите бяха рандомизирани да гладуват, използвайки ящур, 36 часа преди и 24 часа след химиотерапия или да ядат нормокалорична средиземноморска диета за първите три цикъла на химиотерапия. След три цикъла пациентът премина към другата група хранене (средиземноморска диета или гладуване). Дизайнът на изследването позволява вътрешно-индивидуални сравнения по отношение на страничните ефекти от лечението, но изключва заключенията като ефикасност на химиотерапията. Общо в проучването са включени 50 пациенти, но само 34 са анализирани поради ранното прекратяване на проучването. Гладуването беше безопасно и осъществимо и петима пациенти (14,7%) продължиха гладуването след три цикъла и не преминаха към нормокалоричната диета. Авторите заключават, че STF води до по-добра толерантност към химиотерапията с по-малко нарушено качество на живот (QOL) и намалява умората в рамките на 8 дни след химиотерапията. Освен това 31 пациенти са заявили, че ще постят отново по време на химиотерапия, докато само 3 пациенти са заявили, че няма да пости отново по време на химиотерапия.
Тези първи клинични проучвания нямат достатъчно сила, за да направят категорични заключения. Първите резултати обаче показват, че STF е безопасен, докато намалява токсичността на химиотерапията. Необходими са широкомащабни рандомизирани проучвания, за да се получи по-голяма представа за ползите от STF при лечението на рак при хора.
Текущи проучвания
Първите клинични проучвания показват, че STF, комбинирана с химиотерапия, е безопасна и осъществима при малки групи пациенти [131, 136, 138]. Освен това STF може да намали индуцираната от химиотерапия токсичност. Освен това, причиненото от химиотерапия увреждане на ДНК в здрави клетки може да бъде намалено поради STF. Необходими са обаче големи рандомизирани клинични проучвания, за да се получи (повече) прозрение и да се потвърдят възможните ползи от STF по време на химиотерапия. В Таблица Таблица 3, 3 е показан преглед на продължаващите изпитвания със STF, комбинирани с лечение на рак.
Таблица 3
Преглед на текущи или непубликувани клинични изпитвания на STF, комбинирани с химиотерапия или лъчетерапия
- Гладуване и рак Ползи и ефекти
- Опит от лечението със Sehydrin (Hydrazine Sulfate, HS) при пациенти с напреднал рак
- Дисплазия на шийката на матката; Естествени терапии за рак на маточната шийка за лечение и профилактика
- Диета, чревни микроби влияят върху резултатите от лечението на рака - ScienceDaily
- Странични ефекти от химиотерапията - OC кръв; Грижа за рака