Ватару Аой
1 Лаборатория по здравни науки, Висше училище за науки за живота и околната среда, Префектурен университет в Киото, Киото, 606-8522 Япония
Казуя Такеда
2 Лаборатория по хранителни науки, Висше училище за науки за живота и околната среда, Префектура на университета в Киото, Киото, 606-8522 Япония
Азуса Сасаки
2 Лаборатория по хранителни науки, Висше училище за науки за живота и околната среда, Префектура на университета в Киото, Киото, 606-8522 Япония
Юки Хасегава
2 Лаборатория по хранителни науки, Висше училище за науки за живота и околната среда, Префектура на университета в Киото, Киото, 606-8522 Япония
Ясуши Накамура
2 Лаборатория по хранителни науки, Висше училище за науки за живота и околната среда, Префектура на университета в Киото, Киото, 606-8522 Япония
Юн Йънг Парк
2 Лаборатория по хранителни науки, Висше училище за науки за живота и околната среда, Префектура на университета в Киото, Киото, 606-8522 Япония
Кенджи Сато
3 Отдел за приложни биологични науки, Висше училище по земеделие, Университет Киото, Киото, 606-8502 Япония
Масайо Иваса
1 Лаборатория по здравни науки, Висше училище за науки за живота и околната среда, Префектурен университет Киото, Киото, 606-8522 Япония
Айри Накаяма
1 Лаборатория по здравни науки, Висше училище за науки за живота и околната среда, Префектурен университет Киото, Киото, 606-8522 Япония
Мизуки Минамикава
4 Лаборатория по наука за храненето, Висше училище за науки за живота и околната среда, Префектурният университет на Киото, Киото, 606-8522 Япония
Юкико Кобаяши
4 Лаборатория по наука за храненето, Висше училище за науки за живота и околната среда, Префектурният университет на Киото, Киото, 606-8522 Япония
Коджи Широта
5 Отдел за градинарство, Префектура на Киото, Център за земеделие, горско стопанство и риболов, Камеока, 621-0806 Япония
Noboru Suetome
5 Отдел по градинарство, Префектурен район на Киото Център за земеделие, горско стопанство и рибарство, Камеока, 621-0806 Япония
Резюме
Предназначение
Изследвахме ефекта на Кацура-ури (японски пъпеш за ецване; Cucumis melo var. Conomon) върху енергийния метаболизъм по време на упражнения при изследвания върху хора и животни.
Методи
Осем здрави мъже (средна възраст, 21,4 ± 0,7 години) участваха в едно-сляпо, кръстосано проучване. Тридесет минути след поглъщането на напитката Katsura-uri или напитката плацебо, те тренираха на велоергометър при 40% максимален сърдечен ритъм за 30 минути. По време на тренировка беше извършен анализ на дихателните газове, за да се изследва консумацията на кислород и използването на субстрата. Биохимичните параметри на кръвта бяха оценени по време на тренировка. В проучването върху животни, ефектът на метилтиоцетна киселина (MTA), компонент, получен от Katsura-uri, е изследван при мишки. Непосредствено след бягане с 25 m/min в продължение на 30 минути бяха измерени биохимични параметри в мускула на задния крайник и кръв на мишки.
Резултати
Консумацията на кислород по време на тренировка е по-висока в състоянието на Katsura-uri (19,8 ± 3,5 ml/kg/min), отколкото при плацебо (18,6 ± 3,0 ml/kg/min) (P 2 = 0,86) в сравнение с условието на плацебо (R 2 = 0,47). Намаляването на междумускулното рН и повишаването на лактата в кръвта след тренировка са предотвратени чрез добавяне на MTA (250 ppm) със значителни разлики в групата, добавена с MTA в сравнение с контролната група.
Заключения
Тези резултати предполагат, че поглъщането на Katsura-uri и/или MTA подобрява метаболизма на глюкозата и подкисляването в скелетните мускули по време на упражнения при изследвания върху хора и животни.
Заден план
Kyo-yasai е общ термин за наследствени зеленчуци в Киото (Япония), които са запазени като семена и са отгледани чрез традиционни методи на отглеждане, а някои Kyo-yasai имат много уникални съединения, които не присъстват в конвенционалните зеленчуци. Katsura-uri (японски пъпеш за ецване; Cucumis melo var. Conomon), един от Kyo-yasai има уникалното свойство на силен аромат, подобен на мускус (Nakamura et al. 2008); някои съединения, отговорни за аромата, допринасят за ефекта му върху определени физиологични функции (антимутагенни, индукция на диференциация в раковите клетки и антиоксидантни ефекти), които обикновено не се влияят от средно узрелия Katsura-uri или неговия конвенционален аналог (Nakamura et al. 2010). Преди това идентифицирахме 6 типични ароматни съставки на Katsura-uri, включително етилов естер на метилтиоцетна киселина (MTAE) (Nakamura et al. 2010), който се хидролизира в киселина до метилтиоцетна киселина (MTA) в стомаха. Все още обаче не е докладвано проучване на енергийния метаболизъм на поглъщане на цели плодове Katsura-uri и MTAE/MTA.
Резултати
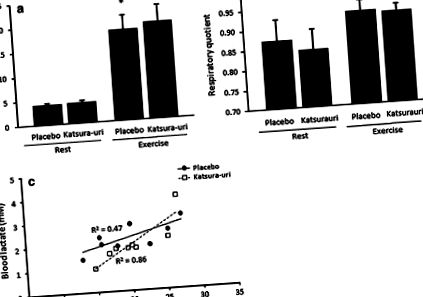
Непряко метаболитно представяне при хората
Ефектът от приема на напитка Katsura-uri върху консумацията на кислород (а) и дихателен коефициент (б) и корелацията между окисляването на въглехидратите и концентрацията на лактат в кръвта (° С) при хората. Непрекъснатата линия показва плацебо, а пунктираната линия показва Katsura-uri. Стойностите са представени като средната стойност ± SD. * P # P 2 = 0,86) в сравнение със състоянието на плацебо (R 2 = 0,47) (фиг. 1 в).
Биохимични показатели на кръвта при хората
Киселинна хидролиза от MTAE до MTA в изкуствен стомашен сок. Неизпълнен кръг Остатъчен MTAE, запълнен кръг MTA образуван, отворен квадрат общо количество MTAE и MTA. Пунктирана линия изразява 50% от концентрацията на MTAE от първоначалната концентрация при 0 h (7.45 mM). MTA метилтиоцетна киселина, MTAE метилтиоцетна киселина етилов естер.
Кръвни параметри при мишки
маса 1
Параметри на метаболизма в кръвта при мишки
| Кръвна глюкоза (mg/dL) | 6,6 ± 0,7 | 7,8 ± 1,4 | 7,5 ± 2,0 | 6,7 ± 1,0 |
| Плазма NEFA (mM) | 880 ± 281 | 916 ± 360 | 883 ± 529 | 889 ± 268 |
| Амоняк в кръвта (μM) | 110 ± 43 | 135 ± 37 | 125 ± 68 | 107 ± 33 |
| Кръвен лактат (mM) | - | 3,2 ± 1,2 | 2,5 ± 0,7 | 2,1 ± 0,3 # |
Стойностите са представени като средна стойност ± SD. Контрол, упражнение група администрирана вода.
MTA-25 упражняваща група, получаваща 25 ppm MTA добавки, MTA-250 упражняваща група, приемаща 250 ppm MTA добавки, MTA метилтиоцетна киселина.
Ефектът на MTA върху междумускулното рН при мишки. Контролирайте контролно администрирана тренировъчна група, MTA-25 25 ppm Управлявана от MTA упражняваща група, MTA-250 250 ppm Управлявана група от MTA, MTA, метилтиоцетна киселина. Стойностите са представени като средната стойност ± SD. * Р 2). Сукцинат дехидрогеназата (SDH), ензим от цикъла на Кребс, показва тенденция към увеличаване с MTA по дозозависим начин. Както карнитин палмитоилтрансферазата Ι (CPTI), ограничаващ скоростта ензим на навлизане на мастна киселина в митохондриите, така и пируват дехидрогеназата (PDH), ензим, който свързва пътя на гликолизата с цикъла на Кребс, са непроменени нито при упражнения, нито при добавяне на MTA (Таблица 2).
Таблица 2
Мускулни метаболитни параметри при мишки
| Съдържание на гликоген (μg/g) | 40,0 ± 11,0 | 33,7 ± 7,5 | 29,9 ± 11,3 | 26,4 ± 7,8 * |
| CPTI активност (nmol/mg протеини) | 4,9 ± 1,0 | 5,2 ± 0,9 | 4,9 ± 1,3 | 5,4 ± 0,9 |
| SDH активност (μmol/mg прот.) | 27,4 ± 15,2 | 21,3 ± 14,9 | 27,9 ± 13,4 | 29,4 ± 23,2 |
| PDH активност (OD промяна/15 минути) | 0,067 ± 0,026 | 0,078 ± 0,003 | 0,068 ± 0,024 | 0,066 ± 0,035 |
Стойностите са представени като средна стойност ± SD.
Контролна упражняваща група, администрирана вода, MTA-25 упражняваща група, приемаща 25 ppm MTA добавки, MTA-250 упражняваща група, приемаща 250 ppm MTA добавки, MTA метилтиоцетна киселина, CPTI карнитин палмитоилтрансфераза Ι, SDH сукцинат дехидрогеназа, PDH пируват дехидрогеназа.
* P 2) са наети като участници в едно-сляпо, кръстосано проучване, което е одобрено от комисията по етика на Префектурния университет в Киото (№ 45). Всички субекти предоставиха писмено информирано съгласие. Нито един субект няма текущо или предишно хронично заболяване или анамнеза за тютюнопушене и понастоящем никой не използва лекарства. Освен това никой субект не е бил привикнат към редовен режим на упражнения.
Пробна напитка
Човешки експеримент
Субектите бяха помолени да постит, с изключение на консумацията на вода, от 22:00 през нощта преди експеримента. В експерименталния ден всички субекти консумираха една и съща закуска (200 г ориз на пара и 170 мл супа от мисо [Asage; Nagatanien, Токио, Япония]) в 8:30, за да нормализират ефектите от хранене преди тренировка. Тридесет минути след пиене на напитката Кацура-ури или плацебо напитката в 10:00, всички участници изпълниха една сесия на колоездене в стационарно състояние за 30 минути. Работното натоварване постепенно се увеличава с 10 W на всеки 2 минути, започвайки с 50 W, докато сърдечната честота достигне прогнозираните 40% от максималната сърдечна честота, определена с помощта на формулата на Karvonen (Karvonen 1957), и това работно натоварване се поддържа до края на упражнението. Измерването на дихателните газове започва 15 минути преди тренировка и продължава до след тренировка. Нивата на кръвната глюкоза и лактата се измерват в покой и след 15 и 30 минути от началото на упражнението с помощта на обикновен кръвен тест с пръчка (Lactate Pro, Glu Test; Arkray, Kyoto, Japan). Имаше 1-седмичен период на измиване преди теста и всички участници изпълниха и двете условия на тестване.
Непряко метаболитно представяне
Консумацията на кислород за дихателни газове (VO2) и производството на въглероден диоксид (VCO2) се измерват с помощта на дихателна система за дишане (Aeromonitor AE310S; Minato, Осака, Япония). За да се намали вариацията „дъх по дъх“, тези данни се анализират, като се използва средна стойност, получена на всеки 60 s. RQ и използването на субстрата са изчислени от нивото на VO2 и VCO2, както е описано по-рано (Frayn 1983).
Експериментален дизайн на мишки
Това проучване е в съответствие с насоките на Японския съвет за грижа за животните и е одобрено от Комитета за изследване на животните към университета (M24-49). ICR мишки (на 7 седмици; Лабораторни консумативи Shimizu, Киото, Япония) бяха аклиматизирани за 1 седмица в климатизирана (22 ± 2 ° C) стая при 12-часов цикъл светлина/тъмнина (светлини от 7: От 30 до 19:30). Мишките бяха разделени на следните 4 групи с по 10 мишки във всяка група: заседнали, упражнения с контрол, упражнения с добавки от 25 ppm MTA и упражнения с добавки от 250 ppm MTA.
MTA разтворите се приготвят с вода до подходяща концентрация и се дават на мишки 30 минути преди тренировка (10 μL/g телесно тегло). Осигурена е вода за контролиране на мишките в същия обем като добавките на MTA. След пероралното приложение мишките в групите за упражнения бягаха на бягаща пътека със скорост 25 m/min в продължение на 30 минути. Веднага след тренировка се измерва междумускулно рН под анестезия и се получават и измерват кръвни концентрации на глюкоза и лактат (GluTest, LactatePro; Arkray) от вената на опашката. Гастрокнемиалните мускули и кръвта се събират чрез кардиоцентеза. Заседналите мишки са били подложени на същите процедури за събиране на кръв и мускули. Нивата на амоняк в кръвта и плазмата NEFA са измерени, като се използват съответно комплекти за анализ (Wako, Osaka, Japan).
Съдържание на гликоген в скелетните мускули
Мускулните тъкани се хомогенизират в 0,3 М хипохлорна киселина, инкубира се с амилоглюкозидаза (25 mg протеин/6 ml) и 20 mM натриев ацетат и се определя количествено с помощта на комплект за измерване на d -глюкоза (F-kit, Roche Diagnostics, Базел, Швейцария).
Ензимна активност в скелетните мускули
Ензимната активност се измерва с помощта на мускулни хомогенати. Нивата на SDH и CPTI се измерват съгласно предварително описаните протоколи (Cooperstein et al. 1950; Bieber et al. 1972). Активността на PDH се измерва с помощта на търговски набор за анализ на свързан с ензими сорбент (Abcam, Cambridge, UK) и данните се изразяват като OD промяна при 450 nm за 15 минути ензимна реакция.
Киселинна хидролиза от MTAE до MTA в изкуствен стомашен сок
Пет милиграма MTAE (Alfa Aesar, Lancashire, UK) се разтварят с 5,0 ml изкуствен стомашен сок (действителна концентрация на MTAE: 1 mg/ml или 7,45 mM). Епруветката се инкубира в продължение на 0,5–30 h при 37 ° C, аликвота от 200 μL от разтвора се изтегля през няколко времеви точки и остатъчните MTAE и MTA (Matrix Scientific, Columbia, SC, USA) се образуват в изкуствения стомашен сок. измерено чрез използване на обратнофазова HPLC-UV. Нивата на MTAE и MTA бяха измерени с помощта на HPLC модел LC-20AT с SPD-20A UV детектор (Shimadzu, Киото, Япония). Аналитична колона YMC-пакет Pro C18-RS (Ø4,6 × 150 mm) беше използвана за MTAE и MTA анализи, базирани на хроматография с обратнофазова фаза. Аликвотна част от 10 μL проба се инжектира и изократично се елуира, като се използва 18% ацетонитрил в 0.1% трифлуороацетатна подвижна фаза. Ултра абсорбцията при 230 nm се използва за откриване на MTA при 3,5 минути и MTAE при 23,5 минути.
- Ефектът от диетата и радиацията върху бактериалния симбиом на пъпешовата муха, Zeugodacus cucurbitae
- Ефектът на 5-алфа редуктазата върху тестостерона при мъжете - изглед в пълен текст
- Суши направи лесно ръководство за приготвяне на японски изкушения НА ЗДРАВЕ!
- Ефектът на нисковъглехидратната, кетогенна диета спрямо диета с нисък гликемичен индекс върху гликемичната
- Ефектът от терапевтична диета при стрес в урината върху краткосрочната рецидив на котешка идиопатия