Даниел Хикман
колеж по медицина, Катедра по молекулярна генетика и микробиология, Институт за възникващи патогени, Университет на Флорида, Гейнсвил, Флорида, САЩ
Мелиса К. Джоунс
колеж по медицина, Катедра по молекулярна генетика и микробиология, Институт за възникващи патогени, Университет на Флорида, Гейнсвил, Флорида, САЩ
Шу Жу
колеж по медицина, Катедра по молекулярна генетика и микробиология, Институт за възникващи патогени, Университет на Флорида, Гейнсвил, Флорида, САЩ
Ерика Къркпатрик
колеж по медицина, Катедра по молекулярна генетика и микробиология, Институт за възникващи патогени, Университет на Флорида, Гейнсвил, Флорида, САЩ
Дейвид А. Остров
b Медицински колеж, Катедра по патология, имунология и лабораторна медицина, Център по неврогенетика, Университет на Флорида, Гейнсвил, Флорида, САЩ
Сяою Уанг
c Катедри по микробиология и имунология, компютърни науки и инженерство и биостатистика, Държавен университет в Ню Йорк в Бъфало, Бъфало, Ню Йорк, САЩ
Мария Уханова
d Колеж по обществено здраве и здравни професии и Медицински колеж, Катедра по епидемиология, Институт за възникващи патогени, Университет на Флорида, Гейнсвил, Флорида, САЩ
Yijun Sun
c Катедри по микробиология и имунология, компютърни науки и инженерство и биостатистика, Държавен университет в Ню Йорк в Бъфало, Бъфало, Ню Йорк, САЩ
Фолкер Май
d Колеж по обществено здраве и здравни професии и Медицински колеж, Катедра по епидемиология, Институт за възникващи патогени, Университет на Флорида, Гейнсвил, Флорида, САЩ
Марко Салеми
e Медицински колеж, Катедра по патология, имунология и лабораторна медицина, Институт за възникващи патогени, Университет на Флорида, Гейнсвил, Флорида, САЩ
Стефани М. Карст
колеж по медицина, Катедра по молекулярна генетика и микробиология, Институт за възникващи патогени, Университет на Флорида, Гейнсвил, Флорида, САЩ
РЕЗЮМЕ
ВАЖНОСТ
Недохранените деца в развиващите се страни са податливи на по-тежки инфекции, отколкото здравите им колеги, по-специално чревни инфекции, които причиняват диария. За да изследваме ефектите от недохранване върху ентерична инфекция в добре контролирана система, лишена от друга екологична и генетична променливост, ние изследвахме норовирусна инфекция в миши модел. Ние разкрихме, че недохранените мишки развиват по-тежки норовирусни инфекции и те не успяват да изградят ефективен имунитет към паметта на вторично предизвикателство. Това е от особено значение, тъй като недохранваните деца обикновено получават по-малко ефективни имунни отговори на перорални ваксини и вече можем да използваме новата си моделна система, за да изследваме имунологичната основа на това увреждане. Също така установихме, че норовирусите се развиват по-лесно в условията на недохранване. И накрая, както норовирусната инфекция, така и недохранването независимо променят състава на чревната микробиота по съществени и припокриващи се начини.
ВЪВЕДЕНИЕ
Недохранването води до нарушен контрол и забавено изчистване на норовирусна инфекция.
Контролът на инфекцията с MNV-1 е нарушен при недохранения гостоприемник и вирусният клирънс се забавя. Групи мишки C57BL/6 бяха хранени или с 2% (сиви ленти; недохранване) или с 20% (черни ленти; здравословна) протеинова диета в продължение на 12 дни след отбиването. След това и двете групи бяха заразени с 10 6 TCID50 единици MNV-1 p.o. При 1 dpi (n = 3), 3 dpi (n = 8) и 7 dpi (n = 7) се събират мишки от всяка група, посочените тъкани се дисектират и вирусните титри се определят чрез анализ на плаката. Данните се отчитат като PFU/g тъкан и данните за всички мишки на група са осреднени. Двете диетични групи бяха сравнени във всеки момент от време за всяка тъкан за статистически цели.
Отговорите на антивирусните антитела са намалени при недохранения гостоприемник, което корелира с аблатния защитен имунитет.
Отговорът на антивирусните антитела се заглушава при недохранени гостоприемници. Групи мишки C57BL/6 (n = 8 до 9, общо, в две експериментални повторения) са били хранени или с 2% (сиви линии; недохранване) или с 20% (черни линии; здравословна) протеинова диета в продължение на 12 дни след отбиването и след това инокулирани или заразени с 10 6 TCID50 единици MNV-1 po На 1, 2, 4 и 6 седмици след инфекцията, фекални пелети и серум бяха събрани от всяка мишка. Специфично за вируса антитяло се открива чрез стандартна ELISA, като се използва антимиши IgA вторичен за фекални лизати (A) или антимиши IgG вторичен за серумни проби (B). Данните се отчитат като средни показания на абсорбция за всички мишки за състояние. Всички проби, събрани от имитирани инокулирани мишки, са тествани отрицателно (данните не са показани). Двете диетични групи бяха сравнени във всеки момент от време за статистически цели.
Защитният имунитет на MNV-1 се премахва от недохранване, оценено по титри на вируса в тъканите. Групи от мишки (n = 5), хранени с 2% (бели ленти; недохранване) или 20% (сиви ленти; здравословна) протеинова диета, бяха или подменени инокулирани (с надпис „макет“ по оста x) или имунизирани с 10 6 TCID50 единици MNV -1 (с надпис „вакс“ по оста x за ваксинирани). Шест седмици по-късно всички мишки бяха предизвикани с 10 7 TCID50 единици MNV-1 p.o. На 1 ден след вторично предизвикване, мишките се умъртвяват и посочените тъкани се събират за определяне на вирусно натоварване, използвайки стандартен анализ на плака. Данните за всички мишки за състояние бяха осреднени и границите на откриване са посочени с пунктирани линии. Групите, сравнени за статистически анализ, включват подбрани диетични макет срещу вакс, макет на 2% срещу 20% протеинови диети и вакс на 2% спрямо 20% протеинови диети.
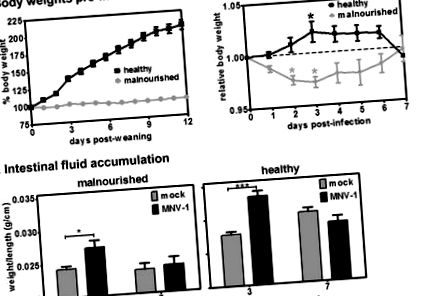
Защитният имунитет на MNV-1 се премахва от недохранване, оценено чрез натрупване на чревна течност. Групи от мишки, хранени с 2% (A) или 20% (B) протеинова диета, бяха или подменени инокулирани (с надпис „макет“ по оста x; n = 4), или имунизирани с 10 6 TCID50 единици MNV-1 (с надпис „vax“ по оста x, за ваксинирани; n = 6). Шест седмици по-късно всички мишки бяха предизвикани с 10 7 TCID50 единици MNV-1 p.o. Трета група мишки бяха включени за всяка диета, която получи подменен инокулум и при двете инфекции (с етикет „наивно“ по оста x; n = 3). На 3 дни след вторично предизвикване, мишките се умъртвяват и чревната течност се измерва, както е описано в Материали и методи. Данните за всички мишки за състояние бяха осреднени. Групите, сравнени за статистически анализи, включват наивно спрямо фалшиво, наивно срещу вакс и макет срещу вакс.
Наблюдава се повишена вирусна дивергенция при недохранени мишки.
Недохранването и норовирусната инфекция са свързани с драматични промени в състава на микробиотата.
Съставът на микробиотата се променя поради недохранване с протеини и инфекция с MNV-1. Групи от мишки (n = 8) бяха хранени или с 2% (недохранена) или 20% (здравословна) протеинова диета. Три мишки на диета бяха подменени инокулирани, докато останалите пет мишки бяха заразени с 10 7 TCID50 единици MNV-1. Фекални проби бяха събрани от отделни мишки при 0, 1, 2, 3, 4 и 5 dpi и микробиомният състав беше определен чрез 454 секвениране на хипервариабилната V1-до-V3 област на бактериалния 16S rRNA ген. (А) Представено е разпределението на микробиомите на всяка диетична група при 0 dpi на ниво филум. (B) Данните за филума за заразените мишки при 0 и 5 dpi са показани за всяка диетична група.
ДИСКУСИЯ
Недохранените мишки развиват по-тежки и продължителни инфекции с MNV-1.
Недохранените мишки са нарушени в способността им да индуцират защитен имунитет към MNV-1.
Съществува по-голямо разнообразие на MNV-1 при недохранени мишки, отколкото при здрави мишки.
Въпреки че по-голямата част от адаптивните мутации са открити само в една диетична група, промяната на лизин в глутамат на позиция VP1 296 става преобладаваща и в двете диетични групи с течение на времето. По-конкретно, 7% от клоновете на вирусни инокулуми съдържат остатък от глутамат в тази позиция, докато 59% и 75% от клонингите, получени от фекални пелети от нашата колективна група мишки, съдържат глутамат при 35 и 50 dpi, съответно. Тази специфична промяна възниква по време на пасиране на клетъчна култура на MNV-1 (29, 63) и е свързана със затихване при мишки STAT1 -/- (28, 29). Повечето MNV щамове, различни от MNV-1, идентифицирани до момента, имат глутамат в тази позиция (29), което предполага фитнес предимство на вируса, тъй като той е рутинно избран за in vitro и in vivo въпреки неговия атенюиращ фенотип при интерферон-дефицитни мишки . Аминокиселина 296 се среща в хиперпроменливата Р2 област на VP1, така че промяната на лизин в глутамат може да промени ефективността на ангажирането на рецептора.
Недохранването и инфекцията с MNV-1 независимо влияят върху състава на микробиотата.
Като цяло представяме обширна характеристика на MNV инфекцията при недохранени гостоприемници, като поставяме основата за изследване на сложните взаимовръзки между хранителния статус, имунитета на лигавицата и микробиотата, които формират цялостната реакция на гостоприемника към ентеричните патогени.
МАТЕРИАЛИ И МЕТОДИ
Мишки и диети.
Бременни мишки от див тип C57BL/6 бяха закупени от лабораториите на Charles River (Wilmington, MA) и настанени в съоръжения за животни в Университета на Флорида при условия, свободни от специфични патогени. За всички експерименти, съвпадащи по пол 3-седмични мишки C57BL/6 бяха разпределени произволно по време на отбиването към изокалорични диети (Harlan Laboratory, Maine), съдържащи 2% (TD.92203) или 20% (TD.91352) протеин; диетите са направени изокалорични чрез заместване на протеина със захар и нишесте. По време на експериментите мишките се поддържат на съответните им диети. Всички изследвания на животни, проведени в настоящото проучване, са одобрени от Институционалния комитет за грижа и употреба на животните към Университета на Флорида (номер на изследване 201107166 или 201107538).
Вирус и инфекции.
MNV-1 изолат CW3 (16) в пасаж 7 (посочен тук като MNV-1) се използва във всички експерименти. Запасът от вируси се генерира чрез центрофугиране на заразени RAW 264.7 клетъчни лизати през захарозна възглавница и фракциониране върху градиент на цезиев хлорид, както е описано по-рано (16, 63), и се титрува, използвайки стандартен TCID50 анализ (53). Паралелно се приготвя фалшив инокулум, като се използва RAW 264,7 клетъчен лизат от незаразени култури. За всички експерименти, мишките бяха инокулирани перорално (р.о.) с 25 ul MNV-1 или фалшив инокулум. Когато се определят вирусни натоварвания, мишките се перфузират и тъканите се дисектират, претеглят и хомогенизират в среда чрез биене на зърна, като се използват 1.0-милиметрови топчета цирконий/силициев диоксид (BioSpec Products, Inc.). Анализите на плака на тъканни проби се извършват, както е описано по-рано (17, 63), а данните са представени като PFU на грам тъкан.
Анализ на гастроентерит.
Натрупването на чревна течност се оценява чрез стандартен анализ (16, 17). Накратко, тънките черва бяха лигирани в пилорични и цекални кръстовища, дисектирани, претеглени и измерени по дължина. Натрупването на чревна течност се показва чрез съотношението тегло/дължина, което е увеличено за заразените мишки над това за контролите.
ELISA, специфичен за вируса.
Подмандибуларната пункция се използва за събиране на серум от мишки в посочените времеви точки след постинфекция. Фекални пелети (0,05 g) се събират в 0,5 ml фосфатно буфериран физиологичен разтвор (PBS), съдържащ протеазен инхибиторен коктейл (Sigma), хомогенизират се и се центрофугират при 20 000 × g при 4 ° С в продължение на 20 минути. Специфичен за MNV-1 ELISA е описан по-рано (25). Накратко, 96-ямкови плаки бяха покрити с 250 ng MNV-1 рекомбинантен VP1/VP2 (rVP1/2) протеин и инкубирани при 4 ° С за една нощ. Прилагат се серумни проби, разредени 1:20 или фекални лизати, разредени 1:10, последвани от антимиши IgG или антимиши IgA, конюгирани с хрянова пероксидаза (HRP) като вторично антитяло, съответно. След добавяне на субстрата ABTS [2,2'-азинобис (3-етилбензтиазолинесулфонова киселина), стойностите на абсорбция бяха отчетени при 410 nm с помощта на четец за плочи Spectramax M2. Генерирана беше стандартна крива за всяка плоча с използване на серийни разреждания на положителен контрол MNV-1 серумна проба, за да се осигури консистенция плоча до плоча. Серумни и фекални проби от еквивалентен брой имитирани инокулирани контролни мишки бяха тествани успоредно с експериментални проби. Средната стойност на контролите беше използвана като индикация за базовите нива на откриване.
Вирусно разнообразие.
Анализ на микробиота.
Статистически анализ.
Всички анализи на данни, представени на фиг. 1 до 6 6, са извършени с помощта на софтуера GraphPad Prism. Във всички графики бяха използвани стандартни грешки на средствата за определяне на грешките и стойностите на P бяха определени с помощта на несдвоени двустранни t тестове. Една звездичка представлява стойности на Р от 0,01 до 0,05, две звездички представляват стойности на Р от 0,001 до 0,01 и три звездички представляват стойности на Р по-малко от 0,001. Еднократен тест на Mann-Whitney U беше използван, за да се оцени дали средното вирусно отклонение в недохранената група е значително по-високо (P Koo HL, Neill FH, Estes MK, Munoz FM, Cameron A, DuPont HL, Atmer RL. 2013. Noroviruses: най-често срещаният детски вирусен ентеричен патоген в голяма университетска болница след въвеждане на ротавирусна ваксинация. J. Pediatr. Infect. Dis. 2: 57–60. 10.1093/jpids/pis070 [PMC безплатна статия] [PubMed] [CrossRef] [ Google Scholar]
- Инфекция на пикочните пътища (UTI) Симптоми, причини, лечение
- Инфекция на пикочните пътища при мъжете - Здраве на Харвард
- Какво е инфекция на дебелото черво Irrfan Khan страда от инфекция на дебелото черво и ето всичко, от което се нуждаете
- Какво е затлъстяване; s Ефект върху съдовата система; ED Affirm Clinic
- Ефектът на джунглата Лекар открива най-здравословните диети от цял свят - защо работят и