Резюме
Заден план
Хипоталамусното възпаление, включително астроглиоза и активиране на микроглията, възниква след прием на диета с високо съдържание на мазнини (HFD) при модели на гризачи или при затлъстели индивиди. Въпреки това, ефектът от хроничното HFD хранене върху олигодендроцитите (OLG), произвеждаща миелин глиална популация в централната нервна система (ЦНС), остава неясен. В това проучване използвахме 8-седмични мъжки мишки C57BL/6, хранени с HFD в продължение на 3–6 месеца, за да индуцираме хронично затлъстяване.
Резултати
Анализът на образната трансмисионна електронна микроскопия показа, че целостта на хипоталамусния миелин е нарушена след HFD хранене в продължение на 4 и 6 месеца. Освен това, натрупването на Iba1 + -микроглия с амебоидна хипертрофична форма непрекъснато се наблюдава в дъгообразно ядро на мишки, хранени с HFD през целия период на хранене. Интерлевкин-33 (IL-33), аларма за тъкани при нараняване на ЦНС, е открит с повишено ниво в хипоталамуса след HFD хранене за 3 и 4 месеца. Освен това, изследването in vitro показва, че излагането на зрели OLG на IL-33 нарушава OLG клетъчната структура, заедно с намаляване на експресията на основния протеин на миелина.
Заключения
Като цяло, нашите открития показват, че хроничното HFD хранене предизвиква нарушаване на хипоталамусния миелин, придружено от IL-33 регулиране и продължително микроглиално активиране в хипоталамуса. Като се има предвид, че добавянето на екзогенен IL-33 е вредно за узряването на OLG, увеличаването на IL-33 чрез хронично HFD хранене може да допринесе за индуцирането на хипоталамусен миелин.
Заден план
Затлъстяването, причинено от прекомерен хранителен прием и недостатъчен разход на енергия, се очертава като основен критичен фактор за развитие на сърдечно-съдови заболявания и метаболитен синдром. Индуцираното от затлъстяването увреждане на невроните в централната нервна система (ЦНС) и на целостта на кръвно-мозъчната бариера (ВВВ) увеличава риска от предизвикване на инсулт и болест на Алцхаймер [1, 2]. Като се има предвид, че хипоталамусът е отговорен за регулирането на приема на храна и разхода на енергия чрез действие на лептин и инсулин [3], поддържането в хомеостазата на хипоталамусните невронални и глиални функции е важно за предотвратяване на развитието на заболявания, свързани със затлъстяването.
Възпалението с ниска степен в периферните тъкани на затлъстели индивиди е добре адресирано [4,5,6,7]. Хипоталамусното възпаление се среща и при генетично модифицирани животински модели на затлъстяване или храни с високо съдържание на мазнини (HFD) [5, 8,9,10]. Съобщава се, че се наблюдава повишаване на провоспалителните цитокини и хемокини (т.е. IL-1β, TNF-α и IL-6) в хипоталамуса в острите (часове) и субакутни (седмици) времеви точки след хранене с HFD [11, 12]. Известно е, че активирането на микроглии и астроцити, наречено глиоза, играе критична роля в регулирането на индуцирана от HFD резистентност към лептин и инсулин, заедно с нарушаване на енергийната хомеостаза [11,12,13,14]. Загубата на олигодендроцити (OLG), произвеждаща миелин глиална популация в централната нервна система (ЦНС), е открита в гръбначния мозък на 7 седмица след HFD хранене [15]. И все пак малко се знае за отговора на хипоталамусните OLG на хронично HFD хранене.
Целта на това проучване беше да се изследва отговорът на хипоталамусните OLG на хронично HFD хранене, използвайки нашия утвърден животински модел на метаболитни нарушения чрез хранене на HFD, за да се предизвика инсулинова резистентност и нарушен липиден метаболизъм [16]. Първото проучване показва нарушаването на микроелемента на миелина в задната странична хипоталамусна област в по-късните моменти на HFD хранене. Алтернативно, интерлевкин-33 (IL-33) действа като клетъчен алармин [17] и се съобщава, че IL-33 е критичен фактор за развитието на МС чрез инхибиране на миелинизацията на ЦНС [18]. Интересното е, че открихме, че IL-33 е бил увеличен в OLGs и астроцити на хипоталамуса след хронично HFD хранене. Във връзка с нашето in vitro проучване, че излагането на зрели OLG на IL-33 индуцира увреждането на морфологията на OLG, констатациите предполагат, че нарушената микроелементална структура на миелина в хипоталамуса след HFD хранене може да бъде причинена отчасти от действието на IL-33 молекули, увеличени от хронично HFD хранене.
Резултати
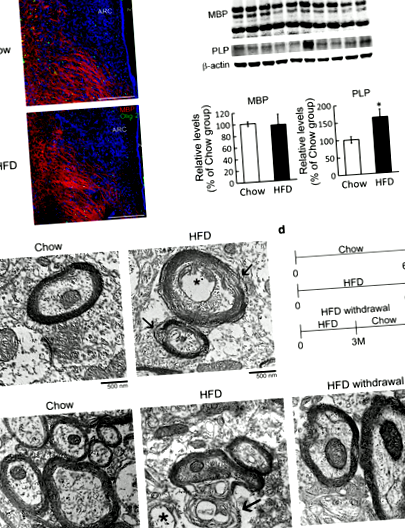
Хронична HFD индуцирана от храненето промяна в микроструктурата на хипоталамусния миелин
И все пак нарушената миелинова обвивка се открива непрекъснато в хипоталамуса на 6-месечен период след хранене (Фиг. 1д, стрелки). Тъй като целостта на миелиновата структура в хипоталамусната област е била по-малко засегната от HFD хранене на 3 месец (Допълнителен файл 1: Фиг. S2), ние бяхме следващият да изследваме дали оттеглянето на HFD в този момент може да предотврати нарушаването на миелиновата структура в хипоталамуса . По този начин проведохме експериментите, че мишките в групата за отнемане на HFD са били хранени от HFD през първите 3 месеца и след това от Chow за още 3 месеца (фиг. 1г). Теглото им е намаляло значително, след като диетата им е била променена на Chow (Допълнителен файл 1: Фиг. S3A). Освен това приемът на вода и приемът им на храна се върнаха на нивото на групата Чау много по-късно (Допълнителен файл 1: Фиг. S3B и C). В допълнение, структурата на миелина в хипоталамусната тъкан, получена от групата за отнемане на HFD, е толкова компактна, колкото тази, наблюдавана в групата на Chow (Фиг. 1д). Тези резултати разкриват, че хроничното HFD хранене може да увреди микроструктурата на хипоталамусния миелин и това прекъсване може да бъде предотвратено чрез промяна на HFD към нормалната диета в по-ранния момент.
Активиране на микроглия в ARC на хипоталамуса чрез хронично HFD хранене
Урегулация на IL-33 в хипоталамуса чрез хронично HFD хранене
IL-33, един от членовете на суперсемейство на ген IL-1, който играе двойни функции при много възпалени заболявания, като сърдечно-съдови заболявания, алергия, множествена склероза (МС), инсулт и болест на Алцхаймер [20, 21]. Протеините IL-33 се откриват главно в клетъчните ядра на хипоталамусните GFAP + -астроцити (фиг. 3а, стрелки) и Olig2 + -OLGs (фиг. 3а, стрелки), но не и Iba1 + -микроглията. Освен това установихме, че храненето с HFD в продължение на 3 и 4 месеца води до повишаване на регулацията на IL-33 протеини в хипоталамуса (Фиг. 3b). Успоредно с това резултатите от имунофлуоресценцията показват, че IL-33 + -експресиращите клетки, увеличени в хипоталамуса, са Olig2 + -OLGs на 4 месец след HFD хранене (фиг. 3d, стрелки), както и GFAP + -астроцити (фиг. 3в, стрелки). Също така забелязахме, че хипоталамусните астроцити показват хипертрофична форма в отговор на хронично HFD хранене (фиг. 3в, върхове на стрелки). Като се има предвид факта, че OLGs и астроцитите освобождават IL-33 като аларма в отговор на увреждане на ЦНС [22, 23], нашите резултати показват, че хроничното HFD хранене предизвиква повишена експресия на хипоталамусен IL-33 в OLG и астроцити, което може да бъде критичен фактор за медииране на реактивността на микроглията в хипоталамуса.
Излагането на IL-33 води до увреждане на олигодендроцитните процеси
Съобщава се, че IL-33 инхибира миелинизацията на ЦНС и регулира развитието на МС [18]. Съответно, нашите открития in vivo повдигнаха възможността IL-33 да се увеличи в хипоталамуса след хронично HFD хранене може да медиира нарушаването на целостта на хипоталамусния миелин по време на хронично HFD хранене. По този начин бяха проведени експериментите in vitro с използване на зрели OLG, получени от първични OPC на мишки, за да се изследва дали IL-33 индуцира морфологичната промяна на зрелите OLG. Както се очакваше, резултатите показаха, че излагането на IL-33 за 24 часа намалява сложността на OLG взаимосвързаната форма на мрежа (Фиг. 4а, стрелки). В допълнение, IL-33 значително намалява броя на MBP + -OLGs в културите и намалява размера на MBP + -OLG клетки (Фиг. 4а). Освен това, нивата на MBP протеин бяха регулирани надолу в културата след третиране с IL-33 (фиг. 4Ь). По същия начин излагането на OLG на зрели плъхове на IL-33 причинява значителни промени в взаимовръзката на процеса на MBP + -OLG (Допълнителен файл 1: Фиг. S5). Констатациите разкриват, че IL-33 е разрушителна молекула за морфологичната организация на зрелите OLG.
Дискусия
Нашите данни показват, че целостта на миелиновата микроструктура в хипоталамусната област е била нарушена след хронично HFD хранене, което показва, че нараняването на миелина се случва в по-късен момент след HFD хранене, отколкото се наблюдава активиране на микроглията. Нещо повече, повишаване на IL-33, което се изразява главно в астроцити и OLGs, се индуцира в хипоталамуса на 3 и 4 месеца след HFD хранене. Добавянето на IL-33 към зрели OLGs в културата отслабва размера на OLG клетките и експресията на MBP.
Заключения
В обобщение, това е първото проучване, което демонстрира, че нарушаването на хипоталамусния миелин и повишеното регулиране на произведен от глия IL-33 са свързани с индуцирано от HFD затлъстяване. Нашето бъдещо проучване е да дисектираме ролята на IL-33 в хипоталамусната невропатогенеза, свързана с хронично HFD хранене.
Методи
Животни
Всички експерименти с животни са проведени в съответствие с насоките ARRIVE (Animal Research: Reporting In Vivo Experiments). Грижите и употребата на животните са одобрени от Националния комитет по грижа и употреба на животните в университета Cheng Kung, Тайнан, Тайван (номер на одобрение на IACUC: 106060). Осемседмични мъжки мишки C57BL/6 (19,91 ± 0,29 g) са получени от Националния център за животни в лаборатория Cheng Kung University (http://www.ncku.edu.tw/animal/eng/nckulac.html) и поставени в отделните клетки (чифт на клетка) със свободен достъп или до нормална диета (Лабораторна диета за гризачи # 5001; LabDiet, Сейнт Луис, Мисури, САЩ) или HFD (Пречистена диета за гризачи # 58Y1; TestDiet, Сейнт Луис, Мисури, САЩ). Мишките са били хранени чрез нормална диета или HFD (Допълнителен файл 1: Таблица S1) за различните периоди от време (3, 4 и 6 месеца). HFD съдържа 61,6% ккал от мазнини, 18,1% от протеини и 20,3% от въглехидрати. Животните бяха настанени (2 животни в клетка) при стандартни стайни условия (стайна температура: 23 ± 2 ° C; влажност: 58 ± 2%; 12-часов цикъл светлина/тъмнина) със свободен достъп до храна и вода ad libitum. Животните бяха умъртвени в различни моменти от време (Допълнителен файл 1: Таблица S1), чрез интраперитонеална (i.p.) инжекция със Zoletil 50 (Virbac Taiwan Co., Ltd .; 5X разреждане във физиологичен разтвор, 0,05–0,06 ml/10 g).
Подготовка на първични клетки-прекурсори на олигодендроцити (OPC)
Western blot анализ
Клетките се лизират в лизисен буфер (1% tritonX-100, 0,05% Tween-20 в PBS), съдържащ протеазен инхибиторен коктейл (Thermo Scientific, Cat # 78443). Хипоталамусните тъкани се отстраняват от животните и се лизират с реагент за екстракция на протеин на T-PER (Thermo Scientific, Cat # 78510), съдържащ протеазен инхибиторен коктейл. 100 μg от общите протеини се зареждат върху 10 или 15% SDS-PAGE и се прехвърлят в нитроцелулозна мембрана. Нитроцелулозните мембрани бяха имуноблотирани за една нощ при 4 ° С с първични антитела (Таблица 1). След това мембраната се инкубира с вторични антитела, конюгирани с пероксидаза, в продължение на 60 минути при стайна температура. Имунореактивните протеини бяха открити с помощта на ECL регент и визуализирани с Super RX-NC филми (Fuji, Япония). Усъвършенстваният хемилуминесцентен субстрат Western Lightning ® Plus-ECL е от PerkinElmer Life Sciences (Бостън, Масачузетс, САЩ).
Имунофлуоресценция
Мозъчните тъкани бяха пост-фиксирани с 4% PFA за една нощ и след това криозащитени в 30% (w/v) захароза в PBS. Тъканите бяха вградени в съединение за оптимална температура на рязане Tissue Tek (Electron Microscopy Sciences, Torrance, CA, USA), разделено с дебелина 20 μm. Свободно плаващите коронални мозъчни секции бяха третирани с 1% TritonX-100 в PBS при 4 ° C за една нощ и инкубирани с първичните антитела в PBS, съдържащи 0,1% TritonX-100 и 1% конски серум при 4 ° C за една нощ. Впоследствие тъканите бяха инкубирани с подходящи биотинилирани вторични антитела за 1 h, последвани от Alexa488/Cy3-avidin (1: 200) в продължение на 45 минути. За двойна имунофлуоресценция, след инкубация с второто първично антитяло, Alexa488/Alexa594-вторични антитела (1: 200) бяха добавени за 1 h. Алтернативно, клетките се фиксират с 4% PFA за 10 минути и се инкубират в PBS, съдържащ 0,1% Triton-X100 за 30 минути. Културите се инкубират една нощ при 4 ° С с първични антитела. След това имунооцветените тъкани и OLG бяха подложени на DAPI ядрено оцветяване. Оцветяването е наблюдавано под конфокален лазерен сканиращ микроскоп Olympus FLUOVIEW FV1000 (Olympus, Япония) с 405, 488 или 594 nm лазери. Антителата и биотинилираните вторични антитела, използвани в проучването, са изброени в таблица 1.
TEM изображения
Мишките бяха перфузирани с 0.9% физиологичен разтвор и фиксиращият разтвор, съдържащ 2% глутаралдехид и 2% PFA в 0.1 М фосфатен буфер. Парчетата от хипоталамусна тъкан с 1 mm 3, приготвени от страничен регион, допълнен към ARC зоната на хипоталамуса (Допълнителен файл 1: Фиг. S1), бяха разделени на дебелина от 100 nm за система за образна трансмисионна електронна микроскопия на Hitachi HT-7650 (Токио, Япония) експлоатирани от основното съоръжение на Националните здравни изследователски институти (NHRI, Тайван).
Количествено определяне на броя на микроглиите и клетъчното тяло
В допълнение към морфологичните наблюдения на Iba1 + или CD11b + микроглия в хипоталамуса, активирането на микроглията се оценява чрез измерване на броя на микроглиите и размера на клетъчното тяло чрез софтуера за анализ на NIH ImageJ. Пет произволно избрани изображения на мозъчна секция бяха обединени, заснети в няколко стъпки с дебелина 1 μm, използвайки конфокален лазерен сканиращ микроскоп Olympus FLUOVIEW FV1000. Пет мозъчни секции, съдържащи ARC области на хипоталамуса, бяха събрани от две животни във всяка група във всяка точка от времето. Броят на Iba1 + microglia и средният размер на клетъчното тяло на Iba1 + microglia в хипоталамусните ARC области (Допълнителен файл 1: Фиг. S1) бяха количествено определени.
Оценка на олигодендроцитна морфологична промяна
Пет произволно взети проби бяха заснети от всяка култура с помощта на епифлуоресцентен микроскоп с обектив 40Х. В допълнение, количествено се определят MBP + -OLGs в културите (общо 1000 клетки на лечение) и размерът на клетките на MBP + -OLGs в културата (общо 100 клетки на лечение) се измерва с помощта на софтуер за анализ на NIH ImageJ (RRID: SCR_003070). Резултатите са представени като процент от данните, получени в третираната с цитокини култура спрямо културата на носителя.
Количествена полимеразна верижна реакция в реално време (QPCR)
Статистически анализ
Наличието на значителни разлики между двете групи (Chow и HFD) в един момент от време, наблюдавано в това проучване, беше определено с помощта на двустранен студент т тест. Всяка стойност е средната стойност ± SEM от пет животни на група (експресия на MBP и PLP), три животни за всяка точка от време на група животни (експресия IL-33), пет мозъчни секции, съдържащи ARC области на хипоталамуса (Iba1 и CD11b имунофлуоресценция) и три повторни експеримента с използване на OLG култури, приготвени от трите препарата (in vitro проучване). Статистическата значимост беше определена като *стр
Наличност на данни и материали
Наборите от данни на това проучване са достъпни от съответния автор при поискване.
- Хроничната диета с високо съдържание на мазнини предизвиква сърдечна хипертрофия и фиброза при мишки
- Д-р Бърнстейн; Диетата с високо съдържание на протеини и мазнини няма въглехидрати и никой не участва в нея
- Диетична диаграма за пациент с високо кръвно налягане, Диетична диаграма с високо кръвно налягане Либрат
- Избор на диета и фактори на начина на живот, замесени при мъже с хронична тазова болка - интерстициална
- Dukan Diet Диета с високо съдържание на протеини, която да ви помогне да отслабнете и да го запазите за цял живот от Williams,