Майкъл Г. Циглер
катедра по медицина, UCSD, 9500 Gilman Drive, La Jolla, CA 92093-0838
Милош Милич
катедра по медицина, UCSD, 9500 Gilman Drive, La Jolla, CA 92093-0838
Ping Sun
катедра по медицина, UCSD, 9500 Gilman Drive, La Jolla, CA 92093-0838
Chih-Min Tang
катедра по медицина, UCSD, 9500 Gilman Drive, La Jolla, CA 92093-0838
Хамзе Елайян
b Катедра по фармакология, Медицински факултет на Йорданския университет, Аман, Йордания
Ксупинг Бао
катедра по медицина, UCSD, 9500 Gilman Drive, La Jolla, CA 92093-0838
Уай Уилсън Чунг
катедра по медицина, UCSD, 9500 Gilman Drive, La Jolla, CA 92093-0838
Даниел Т. О’Конър
катедра по медицина, UCSD, 9500 Gilman Drive, La Jolla, CA 92093-0838
Резюме
Епинефрин (Е) е хормон, освободен от надбъбречната медула в отговор на ниска кръвна захар и други стресове. Е и сродните β2-адренергични агонисти се използват за лечение на астма, но страничен ефект е високата кръвна захар. Мишките C57BL/6, склонни към индуцирано от прехранване диабет тип II, са избили PNMT гена, за да предотвратят синтеза на Е. Тези мишки с дефицит на Е бяха много сходни с контролните животни на диета с 14% мазнини. При диета с 40,6% мазнини те наддават с 20 до 33% повече тегло от контролните животни и повишават отговора си на кръвната глюкоза към тест за толерантност към глюкоза, защото стават резистентни към инсулин.
Въпреки че краткосрочният ефект на β2-агонистите като Е е да повиши кръвната захар, някои дългодействащи β2-агонисти подобряват усвояването на мускулната глюкоза. Ендогенният Е предпазва от диабет, предизвикан от прехранване. Тъй като освобождаването на надбъбречната жлеза може да бъде нарушено при стареене и диабет, ендогенният Е може да помогне за предотвратяване на диабет при възрастни.
Въведение
Епинефринът (Е), наричан още адреналин, е типичният хормон на стреса. Когато се прилага Е, той увеличава кръвната глюкоза чрез инхибиране на освобождаването на инсулин, стимулиране на освобождаването на глюкагон, чернодробна гликогенолиза и чернодробна и бъбречна глюконеогенеза (Cryer, 1993). Парадоксално, докато β-адренергичният агонист Е остро увеличава глюкозата и намалява инсулиновата чувствителност, β-адренергичните антагонисти също са свързани с повишена кръвна глюкоза и намалена инсулинова чувствителност (Jacob et al., 1996). Епинефринът се синтезира от норепинефрин (NE) от ензима фенилетаноламин N-метилтрансфераза (PNMT) и е по-мощен β2-адренергичен агонист от NE. В допълнение към стимулирането на освобождаването на метаболитен субстрат, Е стимулира скоростта на метаболизма. Както E, така и NE стимулират β3 рецепторите да насърчават метаболизма на мазнините, въпреки че това е предимно отговор на освобождаването на невронни NE. Физиологичните нива на Е обаче също стимулират термогенен отговор при хората (Cannon et al., 2004). Обратно, β-блокиращите лекарства са свързани с увеличаване на теглото (Sharma et al., 2001).
Наддаването на тегло и стресът са характеристики на индустриализираните общества, така че хормонът на стреса Е може да играе роля в настоящата епидемия от диабет тип II. Досега най-високите концентрации на E и PNMT се намират в надбъбречната медула, но около половината от всички PNMT е извън надбъбречната жлеза (Kennedy et al., 1995), така че премахването на надбъбречната мозък може да остави важни запаси от E, докато променя освобождаването на глюкокортикоиди от надбъбречната кора. Създадохме нокаутираща мишка PNMT и я превърнахме в мишка, която развива диабет тип II в отговор на прекомерното хранене. Това животно демонстрира роля за ендогенния Е при диабет тип II.
Материали и методи
Животни
Фенилетаноламин N-метилтрансфераза PNMT -/- клетки се инжектират в C57BL/6 бластоцисти и химерите се пресичат обратно в мишки C57BL/6, както се съобщава по-рано (Bao et al., 2007). Мишките бяха настанени при постоянна температура и при 12-часов светлинен, 12-часов тъмен цикъл. Всички експериментални процедури за проучванията са одобрени от институционалния комитет за грижи и употреба на животните към Калифорнийския университет в Сан Диего. Съоръжението за грижа за животните е акредитирано от Асоциацията за оценка и акредитация на лабораторни грижи за животните.
Експеримент 1: ефекти от диетата с високо съдържание на мазнини върху наддаването на тегло, инсулиновия и глюкозен толеранс
15 PNMT +/+ и 13 PNMT -/- мъжки мишки бяха хранени с нормална диета (14% ккал мазнини; Harlan Teklad 8604, Madison, WI). 10 PNMT +/+ и 10PNMT -/- мишки получават диета с високо съдържание на мазнини (40,6% ккал мазнини; Harlan Teklad TD.96132 Коригирана мастна диета) в продължение на 10 седмици ad libitum. Животните се претеглят двуседмично и в края на 10 седмици се провежда интраперитонеален тест за толерантност към глюкоза (ipGTT) и интраперитонеален тест за толерантност към инсулин (ipITT). Преди всеки тест, мишките бяха гладувани в продължение на 6 часа. След това, от извадката им се взема изходна кръвна проба и всяка мишка получава или ip глюкоза, 1g/kg телесно тегло, или ip инсулин 0,85 U/kg телесно тегло (Novolin R от Novo Nordisk Pharmaceuticals, Princeton, NJ). Взети са кръвни проби от опашката на 15, 30, 45, 60, 90 и 120 минути след инжектирането и са анализирани незабавно за съдържание на глюкоза с помощта на HemoCue B-глюкозен анализатор (HemoCue, Lake Forest, CA). Нивата на катехоламин са определени чрез радиоензимен метод на Кенеди и Циглер (Kennedy et al., 1990).
Експеримент 2: глюкозни разлики, открити в проучване 1 и специфични за пола ефекти
За да се изследва етиологията на глюкозните разлики, открити в експеримент 1, и специфичните за пола ефекти, мишките от двата пола бяха подложени на допълнителни тестове. PNMT +/+ (9 мъжки и 10 женски) и 10 PNMT -/- (6 мъжки и 4 женски) мишки са хранени с диета с високо съдържание на мазнини в продължение на 13 седмици. Допълнителни 13 PNMT +/+ (7 мъжки и 6 женски) мишки получават β-адренергичното блокиращо лекарство пропранолол 79 100-150 mg/kg (Sigma Chemical Co., Сейнт Луис, Мисури) заедно с питейната вода мастна диета за осигуряване на фармакологичен блок на някаква Е стимулация. Мишките се претеглят ежеседмично и в края на 13-седмичната диета с високо съдържание на мазнини се подлагат на рентгенова абсорбциометрия с двойна енергия (DEXA), за да се определи телесният им състав. След като мишките бяха на гладно през нощта (с водоснабдяване), за да минимизират ефекта от погълнатата храна и след това да бъдат евтаназирани, използвахме PIXImus миши денситометър (MEC Lunar Corp., Minster, OH), за да определим тяхната слаба и мастна маса.
Статистически анализ
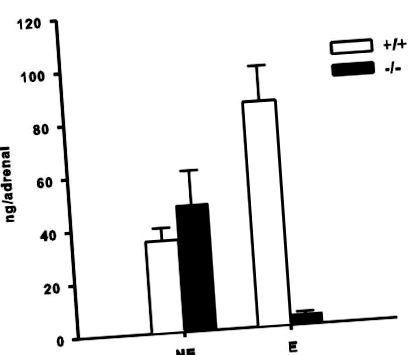
Надбъбречни катехоламини при мишки на диета с високо съдържание на мазнини. Стойностите са представени като средни стойности ± S.E.M.
маса 1
Крайно тегло и увеличаване на теглото на мишки в експеримент 1.
| Крайно тегло (g) | 46 ± 1 | 48 ± 1 |
| Наддаване на тегло (g) | 12 ± 1 | 16 ± 1 a |
Когато PNMT -/- мишките, които не могат да синтезират Е, ядат нормална диета, те имат нива на кръвна глюкоза леко, но не значително по-ниски от PNMT +/+ мишки. Въпреки това, тези на диета с високо съдържание на мазнини обърнаха тази връзка (Фиг. 2), което доведе до значителна диета чрез взаимодействие с генотип. Диетата с високо съдържание на мазнини също удължава продължителността на повишените нива на глюкоза след глюкозно предизвикателство.
Дискусия
Мишките PNMT -/- тежат същите като животните PNMT +/+, когато се отглеждат на обичайна диета с 14% мазнини и техният толеранс към глюкозата и инсулиновата чувствителност не се различават. Всички мишки, използвани в този експеримент, са животни C57B/6, които развиват затлъстяване и диабет тип II на диета с високо съдържание на мазнини (Petro et al., 2004). Мишките PNMT -/- наддават с 20% до 33% повече тегло при диета с високо съдържание на мазнини, но крайните им телесни мазнини, мускулна маса и общо телесно тегло не се различават значително от контролните животни. Независимо от това, премахването на синтеза на Е значително влоши отговора им към глюкозата, защото те станаха по-устойчиви на инсулин от контролните животни, поставени на диета с високо съдържание на мазнини.
Краткосрочният ефект на фармакологичните дози Е е да повиши кръвната глюкоза и да намали инсулиновата чувствителност (Westfall et al., 2010). Изненадващо, нормалното производство на Е имаше обратен ефект, предпазвайки от индуцирана от диетата хипергликемия и инсулинова резистентност. Има основание да се смята, че това се дължи на Е стимулация на β2 рецепторите. PNMT -/- мишките все още имаха нормални количества NE. Е стимулира β2 рецепторите по-добре от NE, но има подобна сила при α, β1 и β3 рецепторите (Westfall et al., 2010). Скелетните мускули са най-важното място за изхвърляне на глюкоза и реагират на β2 стимулация. Хроничната Е инфузия подобрява чувствителността към инсулин на мускулите на плъхове (Jensen et al., 2005). Някои β2-агонисти във фармакологични дози водят до хипертрофия на мускулите при плъхове, говеда, птици и овце (Petrou et al., 1995) чрез намаляване на разграждането на мускулния протеин (Navegantes et al., 2002). Е улеснява свързването на инсулина при упражняване на мускулите (Jensen et al., 2005) и увеличава мускулния кръвен поток.
Краткосрочният ефект на β2-агонистичните лекарства е да увеличи освобождаването на инсулин. Шест часа след приложението на β2-стимулиращи лекарства инсулиновата чувствителност е намалена, но този ефект е краткотраен (Sternbauer et al., 1998). Докато краткодействащите β2-агонисти влошават глюкозния толеранс, хроничното приложение на дългодействащи β2-агонисти подобрява инсулиновата чувствителност (Castle et al., 2001). От друга страна, хроничната употреба на β-блокери повишава гликохемоглобина (Kveiborg et al., 2006), намалява инсулиновата чувствителност и причинява наддаване на тегло (Sharma et al., 2001) при хората. По този начин, дългосрочният ефект на хроничното приложение на β2-агонисти е да увеличи мускулния растеж, притока на кръв, инсулиновото свързване и инсулиновата чувствителност. Нашето проучване показва, че дългосрочният ефект на ендогенния Е е защита срещу нечувствителност към инсулин, която придружава диета с високо съдържание на мазнини. По-рано показахме, че ендогенният Е също така предпазва от повишено кръвно налягане, предизвикано от упражнения, и сърдечно ремоделиране при мишки при нормална диета с мазнини (Bao et al., 2007). Ефектът на ендогенния Е върху хипертонията, която често придружава диета с високо съдържание на мазнини, е важна тема за бъдещите изследвания.
Прехранването при хора се превърна в световен феномен, както и при диабет тип II (Davis et al., 2009). Освобождаването на надбъбречната жлеза и Е реакцията на стрес намаляват с възрастта (Seals et al., 2000), а недостатъчните E отговори са по-чести при диабетици (Cryer et al., 2003). Въпреки че обикновено се смята, че Е повишава глюкозата в кръвта, това е остър ефект от фармакологичните дози. Това проучване показва, че ендогенният Е всъщност предпазва от инсулиновата резистентност и високата кръвна глюкоза, която придружава излишния хранителен режим.
Благодарности
Финансиране Тази работа беше подкрепена отчасти от безвъзмездните средства на NIH P01 HL058120 и M01 RR00827.
Бележки под линия
Отказ от отговорност на издателя: Това е PDF файл на нередактиран ръкопис, който е приет за публикуване. Като услуга за нашите клиенти ние предоставяме тази ранна версия на ръкописа. Ръкописът ще бъде подложен на редактиране, набиране и преглед на полученото доказателство, преди да бъде публикуван в окончателния си вид. Моля, обърнете внимание, че по време на производствения процес могат да бъдат открити грешки, които биха могли да повлияят на съдържанието, и всички правни откази от отговорност, които се отнасят до списанието, се отнасят до.
Декларация за интерес Авторите заявяват, че няма конфликт на интереси, който би могъл да се възприеме като накърняващ безпристрастността на докладваното изследване.
- Упражнявайте стареенето, като играете важна роля за смъртността, затлъстяването и инсулиновата резистентност
- Хлорогенната киселина хром добавка спасява индуцирана от диета инсулинова резистентност и затлъстяване при мишки
- Ефект на лираглутид върху индуцирана от липиди инсулинова резистентност при хора - Koska - 2018 -
- ГМ соевото масло причинява по-малко затлъстяване и инсулинова резистентност, но е вредно за чернодробната функция Мишка
- Стрес в ранна възраст и развитие на затлъстяване и инсулинова резистентност при юношески боне макаки