Резюме
Да се изследват антипролиферативните и апоптотични ефекти на гемцитабин в комбинация с мастика на дъвка и основните механизми в клетъчните линии на рак на панкреаса при човека.
Методи:
Клетъчната пролиферация и апоптоза бяха изследвани, като се използва съответно анализ на метил тиазолил тетразолий (MTT) и оцветяване с пропидиев йод. Експресията на Bcl-2, Bax, NF-κB p65 субединица и IκBα протеин беше измерена с помощта на Western blotting.
Резултати:
Гемцитабин 0,01-100 μg/ml инхибира клетъчната пролиферация и индуцирана апоптоза както в BxPC-3, така и в COLO 357 клетки на рак на панкреаса. Мастика от венците 40 μg/mL значително усилва антипролиферативните и апоптотични ефекти на гемцитабин 10 μg/mL след 72-часово лечение. Когато клетките бяха третирани с гемцитабин в комбинация с мастика от дъвка, нивото на IκBα беше повишено, докато активирането на NF-κB беше блокирано; експресията на Bax протеин беше значително увеличена, но Bcl-2 протеинът беше регулиран надолу.
Заключение:
Гемцитабин в комбинация с мастика на венците причинява мощна апоптоза в раковите клетки на панкреаса. Комбинацията може да бъде ефективна терапевтична стратегия за рак на панкреаса.
Въведение
Ракът на панкреаса е четвъртата водеща причина за смъртност от рак в световен мащаб, с едногодишна преживяемост от само 10% и само 5% от пациентите оцеляват след пет години 1. Дори след лечебна резекция, 5-годишната преживяемост е само 10% –20% 2. Конвенционалната химиотерапия и лъчетерапия, или като единични средства, или в комбинация, имат ограничен ефект върху общата преживяемост на пациенти с рак на панкреаса 3. През последното десетилетие, въпреки наличието на няколко терапевтични агента, гемцитабин (2 ′, 2′-дифлуородеоксицитидин) все още е първа линия на лечение на локално напреднали и метастатични раци на панкреаса 4, 5, 6, 7, 8. Гемцитабин е използван като единичен антитуморен агент или в комбинация с други цитотоксични агенти за солидни тумори като рак на яйчниците, недребноклетъчен белодроб и панкреас 9, 10, 11. Ефективността на гемцитабин обаче не е задоволителна 12, 13 и подобряването на неговите антитуморни цитотоксични ефекти привлича голям интерес през последните години.
Мастика от дъвка, естествена смола, получена от стъблото и листата на Pistacia lentiscus дървета, се използва широко от векове в средиземноморските и близкоизточните страни като едновременно хранителна добавка и билков лек. Медицинските проучвания показват, че мастиката на венците може да има цитопротективно или антиацидно въздействие върху стомашно-чревната система. Също така се съобщава, че притежава антиоксидантна 14 и антибактериална активност 15. Наскоро беше идентифициран като ефективен инхибитор на клетъчната пролиферация и прогресията на клетъчния цикъл в ракови клетки на простатата на човека 16, 17 и като индуктор на апоптоза в човешки HCT116 ракови клетки на дебелото черво 18 .
В настоящото проучване ние изследвахме инвитро антипролиферативни и апоптотични ефекти и механизми на гемцитабин, комбиниран с мастика на дъвка в клетъчни линии на човешки панкреас.
Материали и методи
Клетъчна култура
Човешки панкреатични клетъчни линии BxPC-3 и COLO 357 (American Type Culture Collection, Manassas, VA, USA) се отглеждат съответно в RPMI-1640 и DMEM и се допълват с 10% топлинно инактивиран фетален говежди серум (FBS) при 37 ° С с 5% CO2. Клетките се прекарват два пъти седмично, за да се осигури експоненциален растеж.
Анализ на клетъчна пролиферация
Бяха проведени анализи на 3- (4,5-диметилтиазол-2-ил) -2,5-дифенилтетразолиев бромид (MTT) за оценка на клетъчния растеж и жизнеспособност на клетките след третиране с гемцитабин (Lilly, Франция) и/или мастика на дъвка (Sigma, Сейнт Луис, Мисури, САЩ, № G0878). Клетките се посяват (BxPC-3, 1 × 104 клетки/ямка; COLO 357, 5 × 104 клетки/ямка) в 96-ямкови плаки в RPMI-1640 с 10% FBS за 72 часа при 37 ° С с 5% CO2. MTT (Sigma Chemicals) реагент (5 mg/mL) се добавя по време на оценката на клетъчния растеж и инкубацията продължава още 4 часа. Реакцията се прекратява със 150 μL диметилсулфоксид (DMSO, Sigma Chemicals) на гнездо. Стойностите на абсорбцията бяха определени с помощта на ELISA четец (Модел 680, Bio-Rad) при 490 nm.
Анализ на клетъчната апоптоза чрез поточна цитометрия
Клетките се посяват (4 х 105 клетки на гнездо) в 6-гнездни плаки в среда RPMI-1640 за 24 часа. Средата се отстранява и клетките се измиват с PBS и след това се добавя гемцитабин (10 μg/mL) и/или гума мастика (40 μg/mL). След 48 часа клетките бяха трипсинизирани и фиксирани за една нощ в 70% ледено студен етанол при 4 ° С. Преди проточен цитометричен анализ, фиксираните клетки се центрофугират, промиват се два пъти с PBS и се суспендират отново в PI оцветяващ разтвор, съдържащ 5 μg/mL PI и 250 μg/mL RNase A (Sigma Chemicals). Използвайки поточен цитометър FACSCalibur (FCM-500, Beckman Coulter), беше извършен анализ на клетъчния цикъл върху 10 000 клетки за всяка проба. Количественото разпределение на клетъчния цикъл се извършва с помощта на софтуера CellQuest.
Western blot анализ
Клетъчните лизати се разделят с 10% SDS-PAGE и се прехвърлят електро върху нитроцелулозни мембрани. След блокиране с 5% обезмаслено мляко в TBST (20 mmol/L Tris, 150 mmol/L NaCl, 0.2% Tween-20, pH 7.6), мембраните бяха инкубирани със специфични анти-NF-кВ р65, анти- Bcl-2, анти-Bax, anti-IκBα или анти-β-актин (Santa Cruz) антитела при стайна температура в продължение на 2 часа и впоследствие с конюгирано второ антитяло от хрян пероксидаза (HRP) 1: 4000 (Santa Cruz) за 1 з. Имунореактивните ленти се визуализират с помощта на подобрен комплект за хемилуминесценция (ECL, Santa Cruz Biotechnology Inc, САЩ). β-актин се използва за нормализиране на количеството протеин върху петно.
Статистически анализ
Всеки експеримент се провежда най-малко три пъти. Данните бяха показани като средно ± SD, където е приложимо, и разликите бяха оценени с помощта на Student т-тестове. Вероятността за P
Резултати
Ефектът на гемцитабин и гума мастика върху клетъчната пролиферация
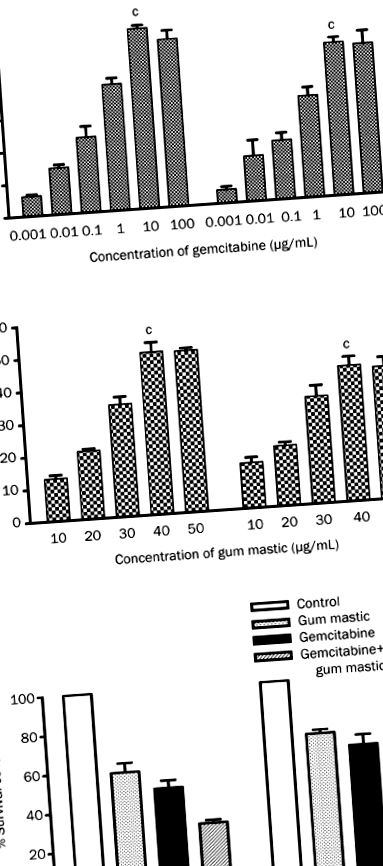
За да се открие ефектът на гемцитабин и мастика на дъвка върху клетъчния растеж, клетъчните линии на рак на панкреаса на човека BxPC-3 и COLO 357 бяха третирани със степенувани концентрации на гемцитабин (0,01-100 μg/ml) или мастика на дъвка (10-50 μg/ml) за 72 часа. Както е показано на Фигура 1А, клетъчната пролиферация е инхибирана или чрез лечение с гемцитабин или дъвка, зависима от дозата. Като цяло, 10 μg/mL гемцитабин или 40 μg/mL гума мастика произвеждат максимално инхибиране на растежа от 55,55% (P Фигура 1
Ефектът на гемцитабин и гума мастика върху клетъчната апоптоза
Клетките BxPC-3 и COLO 357 бяха третирани с гемцитабин (10 μg/ml) и мастика на венците (40 μg/ml) поотделно или в комбинация. Клетъчната апоптоза беше изследвана чрез двойно маркиране на анексин V-PI и FACS анализ. Както е показано на Фигура 2, в клетките BxPC-3, 30,40% ± 3,477% и 31,37% ± 1,662% от клетките са апоптотични съответно в групата на мастичната дъвка и гемцитабин. В COLO 357 клетки, 29,45% ± 1,750% и 30,07% ± 1,358% от клетките са апоптотични в двете групи. В сравнение с лечението с едно средство, комбинацията от гемцитабин и мастика на дъвка води до апоптоза в много по-висок процент (BxPC-3, 45,13% ± 4,005%, P Фигура 2
Активирането на NF-κB може да бъде инхибирано чрез комбинирана употреба на гемцитабин и мастика на венците
Последните доклади 19, 20 разкриват, че в раковите клетки на панкреаса, гемцитабин може да индуцира активиране на NF-кВ. Експериментът се повтаря и дава същите резултати (Фигура 3А-3В, път 2). За да се установи дали инхибиторният ефект на мастиката на дъвка върху клетъчната пролиферация на BxPC-3 е причинен от инактивирането на NF-κB, е извършено Western blot за изследване на промените в експресията на NF-kB p65 протеин. Както е показано на Фигура 3В (пътека 3), мастикът от дъвка сам потиска експресията на NF-κB. Най-важното е, че съвместното третиране с мастика от дъвка инхибира индуцираното от гемцитабин активиране на NF-κB активиране (Фигура 3В, път 4). Подобно явление е открито в клетки COLO 357 (Фигура 3В).
Активирането на NF-κB може да бъде инхибирано чрез комбинирано лечение с гемцитабин и дъвка. (A) Western blot анализ за NF-κB в ядрени екстракти от BxPC-3 клетки, третирани с 10 μg/ml гемцитабин в различни моменти от време. (B) Western blot анализ за NF-κB p65 субединица в ядрени екстракти както на BxPC-3, така и на COLO 357 клетки след 48 часа обработка с клетъчна среда (път 1), гума мастика (път 2), гемцитабин (път 3) или техните комбинация (лента 4). Като вътрешен контрол се използва белтъкът на β-актин. Денситометричното измерване на нивата на протеин NF-kB p65 беше нормализирано съответно на вътрешния контрол и изразено като относителна стойност.
Лечението на гемцитабин, комбинирано с мастика от дъвка, регулира надолу експресията на Bcl-2, повишава експресията на Bax и предотвратява разграждането на IκBα
Тъй като NF-κB има централна роля в регулирането на апоптотичния път при рак на панкреаса, експресията на IκBα, Bcl-2 (NF-κB надолу по веригата анти-апоптотични молекули) и Bax (NF-κB надолу по веригата про-апоптотични молекули) е открити. Уестърн блотинг показва, че експресията на Bcl-2 е значително регулирана надолу в комбинираната група в сравнение с лечението с индивидуален агент и контрола (P Фигура 4
Лечението на гемцитабин, комбинирано с гума мастика променя експресията на Bcl-2, Bax и IκBα. Експресията на Bcl-2, Bax и IκBα се анализира чрез Western blot. BxPC-3 клетките се третират с клетъчна среда, 40 μg/mL гума мастика, 10 μg/mL гемицитабин или тяхната комбинация в продължение на 48 часа. β-актинът е използван като вътрешен контрол. Денситометричното измерване на тези нива на протеини се нормализира съответно на вътрешния контрол и се изразява като относителна стойност.
Дискусия
През последното десетилетие основното лекарство за лечение на локално напреднал и метастатичен рак на панкреаса остава гемцитабин 21. Ефикасността му обаче често е ограничена. За да подобрим неговия антитуморен цитотоксичен ефект и да идентифицираме нови лечения за лечение на рак на панкреаса, ние изследвахме ефектите на гемцитабин в комбинация с нов агент, дъвка мастика, върху клетъчната пролиферация, както и апоптозата в човешките клетъчни линии на рак на панкреаса и изследвахме механизма, допринасящ за това към тези ефекти.
Антитуморната активност на лекарството е свързана с инхибиране на пролиферацията на туморни клетки, насърчаване на клетъчната диференциация и индукция на апоптоза. Мастиката на венците е естествен екстракт от Pistacia lentiscus дървета и неговите противоракови свойства са ново идентифицирани 16, 17, 18, 22 . Инвитро, Доказано е, че мастиката на венците инхибира растежа на раковите клетки на простатата и предизвиква апоптоза на раковите клетки на дебелото черво. В това проучване ние оценихме ефектите на мастиката на венците в раковите клетки на панкреаса. Открихме, че дъвка мастика, инвитро, имали антипролиферативни и апоптотични ефекти върху ракови клетки на човешки панкреас (BxPC-3). Най-важното е, че мастиката на венците е синергична, когато се използва с гемцитабин. След едновременно лечение с тези два агента, клетъчната пролиферация беше силно потисната и скоростта на клетъчна апоптоза беше значително по-висока в сравнение с клетките, третирани само с двата агента.
По същия начин, в BxPC-3 и COLO357 клетъчни линии, инхибирането на NF-κB чрез гума мастика е свързано с повишения апоптотичен ефект на гемцитабин. Установихме, че когато клетките са били третирани с гемцитабин и мастика, експресията на NF-κB p65 е силно потисната, докато експресията на IκBα е увеличена. Експресията на Bcl-2 беше значително регулирана надолу и Bax беше регулирана нагоре в комбинираната група в сравнение с индивидуалното лечение и нетретиран контрол. По този начин може да се предположи, че добавянето на гума мастика към гемцитабин увеличава инхибирането на NF-κB сигналния път върху клетъчния растеж и апоптозата на BxPC-3 клетките. Повишената експресия на IkBα може да инхибира експресията и активирането на NF-kB, което индуцира клетъчна апоптоза. Инхибирането на NF-κB пътя регулира надолу антиапоптотичен Bcl-2, но регулира нагоре експресията на проапоптотичен Bax.
Следователно, гемцитабин, комбиниран с мастика на дъвка, води до мощно потискане на пролиферацията на раковите клетки на панкреаса и апоптозата. Дали обаче това е често срещано явление, трябва да се определи чрез тестване на повече панкреатични клетъчни линии като PANC-1 29, 30. Нашите открития показват, че комбинираната употреба на гемцитабин и мастика на венците има потенциална клинична стойност и може да действа като ефективна терапевтична стратегия за клинично лечение на рак на панкреаса.
Принос на автора
Xin-yu HUANG ръководи проекта и проектира експериментите; Hong-cheng WANG, Zhou YUAN, Ang LI, Mei-lan HE и Kai-xing AI извършиха експериментите; Ци ZHENG и Huan-long QIN написаха статията; Анг LI критично преразгледа ръкописа.
Препратки
Фрайер RA, Galustian C, Dalgleish AG. Последни постижения и разработки в стратегии за лечение на рак на панкреаса. Curr Clin Pharmacol 2009; 4: 102–12.
Йокояма Y, Nimura Y, Nagino M. Напредък в лечението на рак на панкреаса: ограничения на операцията и оценка на нови терапевтични стратегии. Surg Today 2009; 39: 466–75.
Локхарт AC, Ротенберг ML, Берлин JD. Лечение на рак на панкреаса: текуща терапия и продължаващ напредък. Гастроентерология 2005; 128: 1642–54.
Burris HA, Moore MJ, Andersen J, Green MR, Rothenberg ML, Modiano MR, и др. Подобрения в преживяемостта и клиничната полза от гемцитабин като терапия от първа линия за пациенти с напреднал рак на панкреаса: рандомизирано проучване. J Clin Oncol 1997; 15: 2403–13.
Burris HA, Storniolo AM. Оценка на клиничната полза при лечението на рак на панкреаса: гемцитабин в сравнение с 5-флуороурацил. Eur J Рак 1997; 33: 18–22.
Mackenzie RP, McCollum AD. Нови агенти за лечение на аденокарцином на панкреаса. Експерт Rev Anticancer Ther 2009; 9: 1473–85.
Igarashi H, Ito T, Kawabe K, Hisano T, Arita Y, Kaku T, и др. Хеморадиотерапия с два пъти седмично приложение на ниски дози гемцитабин за локално напреднал рак на панкреаса. Свят J Gastroenterol 2008; 14.: 5311–5.
Boeck S, Hinke A, Wilkowski R, Heinemann V. Значение на състоянието на ефективността за резултата от лечението при напреднал рак на панкреаса. Свят J Gastroenterol 2007; 13: 224–7.
Abratt RP, Bezwoda WR, Falkson G, Goedhals L, Hacking D, Rugg TA. Профил на ефикасност и безопасност на гемцитабин при недребноклетъчен рак на белия дроб. Фаза II проучване. J Clin Oncol 1994; 12: 1535–40.
Lund B, Hansen OP, Theilade K, Hansen M, Neijit JP. Проучване във фаза II на гемцитабин (2 ', 2′-дифлуородеоксицитидин) при предварително лекувани пациенти с рак на яйчниците. J Natl Cancer Inst 1994; 86: 1530–3.
Хайнеман V. Гемцитабин: напредък в лечението на рак на панкреаса. Онкология 2001; 60: 8–18.
Nieto J, Grossbard ML, Kozuch P. Метастатичен рак на панкреаса 2008: чашата е по-малко празна? Онколог 2008; 13: 562–76.
Custodio A, Puente J, Sastre J, Díaz-Rubio E. Терапия от втора линия за напреднал рак на панкреаса: преглед на литературата и бъдещите указания. Лечение на рак Rev 2009; 35: 676–84.
Dedoussis GV, Kaliora AC, Psarras S, Chiou A, Mylona A, Papadopoulos NG, и др. Антиатерогенен ефект на Pistacia lentiscus чрез GSH възстановяване и понижаване на експресията на CD36 иРНК. Атеросклероза 2004; 174: 293–303.
Huwez FU, Thirlwell D, Cockayne A, Ala'Aldeen DA. Мастичната дъвка убива Helicobacter pylori. N Engl J Med 1998; 339: 1946.
Той ML, Yuan HQ, Jiang AL, Gong AY, Chen WW, Zhang PJ, и др. Мастиката на венците инхибира експресията и функцията на андрогенния рецептор в раковите клетки на простатата. Рак 2006; 106: 2547–55.
Той ML, Li A, Xu CS, Wang SL, Zhang MJ, Gu H, и др. Механизми на рак на простатата чрез мастика на венците: NF-kappaB сигнал като цел. Acta Pharmacol Sin 2007; 28: 446–52.
Balan KV, Demetzos C, Prince J, Dimas K, Cladaras M, Han Z, и др. Индукция на апоптоза при човешки рак на дебелото черво HCT116 клетки, третирани с екстракт от растителния продукт, мастика Chios. In Vivo 2005; 19.: 93–102.
Li Y, Ellis KL, Ali S, El-Rayes BF, Nedeljkovic-Kurepa A, Kucuk O, и др. Индуциращият апоптоза ефект на химиотерапевтичните средства се засилва от соевия изофлавон генистеин, естествен инхибитор на NF-κB в клетъчната линия на рак на панкреаса BxPC-3. Панкреас 2004; 4: 90–5.
Banerjee S, Zhang YX, Ali S, Bhuiyan M, Wang ZW, Chiao PJ, и др. Молекулярни доказателства за повишена противотуморна активност на гемцитабин от генистеин инвитро и in vivo с помощта на ортотопичен модел на рак на панкреаса. Рак Res 2005; 65: 9064–72.
О'Райли Е.М. Аденокарцином на панкреаса: нови стратегии за успех. Gastrointest рак Res 2009; 3: S11–5.
Dimas K, Hatziantoniou S, Wyche JH, Pantazis P. Екстрактът от мастична дъвка предизвиква потискане на растежа на ксенотрансплантати на човешки колоректален тумор при имунодефицитни мишки. In Vivo 2009; 23.: 63–8.
Балтимор D, Beg AA. ДНК-свързващи протеини. Пеперуда пърха оттам. Природата 1995; 373: 278–87.
Gilmore TD, Koedood M, Piffat KA, White DW. Rel/NF-kappaB/IkappaB протеини и рак. Онкоген 1996; 13: 1367–78.
Boise LH, Gottschalk AR, Quintáns J, Thompson CB. Bcl-2 и Bcl-2-свързани протеини в регулацията на апоптозата. Curr Top Microbiol Immunol 1995; 200: 107–21.
Korsmeyer SJ, Shutter JR, Veis DJ, Merry DE, Oltvai ZN. Bcl-2/Bax: реостат, който регулира антиоксидантния път и клетъчната смърт. Semin Cancer Biol 1993; 4: 327–32.
Chao DT, Korsmeyer SJ. Семейство BCL-2: регулатори на клетъчната смърт. Annu Rev Immunol 1998; 16.: 395–419.
Fahy BN, Schlieman MG, Mortenson MM, Virudachalam S, Bold RJ. Насочване на свръхекспресията на BCL-2 при различни човешки злокачествени заболявания чрез инхибиране на NF-κB от протеазомния инхибитор бортезомиб. Рак Chemother Pharmacol 2005; 56: 46–54.
Jiang PH, Motoo Y, Sawabu N, Minamoto T. Ефект на гемцитабин върху експресията на свързани с апоптозата гени в човешки ракови клетки на панкреаса. Свят J Gastroenterol 2006; 12: 1597–602.
Джонсън SK, Haun RS. Инсулиноподобният растежен фактор, свързващ протеин-5, влияе върху растежа на раковите клетки на панкреаса. Свят J Gastroenterol 2009; 15: 3355–66.
- Гемцитабин в комбинация с мастика на венците причинява мощно инхибиране на растежа и апоптоза на панкреаса
- Причини за дефицит на растежен хормон, симптоми; Диагноза
- Неуспех в успеха Какво е това, какво го причинява, как се управлява и как да добавите алергични
- Сервицит Симптоми, причини и лечение
- Сервицит причини, симптоми, лечения Най-добър OBGYN Лос