7 септември 2016 г.
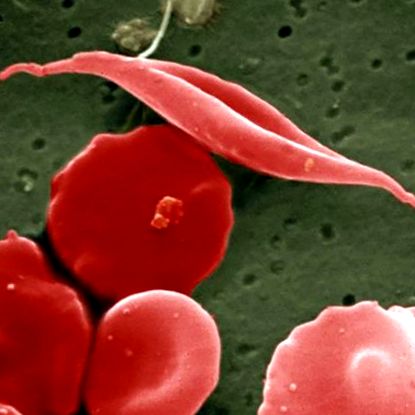
При пациенти със сърповидно-клетъчна болест червените кръвни клетки се извиват в болен полумесец. UCL Medical School/Wellcome Images
Изследователите изчистиха последното научно препятствие пред клинично изпитване на генна терапия за лечение на сърповидно-клетъчна болест, съобщиха те във вторник, подхранвайки надеждите, че ще започнат да записват пациенти в началото на следващата година. Но те избягаха от куршум.
Новото проучване, проведено при мишки, разглежда понякога катастрофичния риск при генната терапия: трудността да се промени само едно нещо, когато се променя ДНК на клетката. Минали усилия за вмъкване на здрав ген при пациенти с дефектна версия доведоха до такива трагедии като момче, развиващо рядка форма на левкемия, след ген, насочен към излекуване на заболяването на имунната му система по невнимание активирана ДНК, причиняваща рак. И нокаутирането на ген за елиминиране на болестотворните му ефекти може също да KO неподозирани здравословни функции.
Изследователи от Центъра за детски рак и кръвни заболявания Dana-Farber/Boston откриха, че и те имат сериозен проблем с непредвидени последици, когато се опитват да разработят генна терапия за сърповидни клетки, която засяга около 300 000 бебета годишно по целия свят. При това наследствено заболяване червените кръвни клетки се извиват в болен полумесец и техните молекули хемоглобин не могат да пренасят кислорода добре. Пациентите страдат от анемия, инфекции, увреждане на тъканите, инсулти, мъчителна болка и дори фатална органна недостатъчност.
Идеята беше да се насочи ген, така че пациентите да продължават да произвеждат форма на хемоглобин, която човешките плодове и новородените правят. Обикновено хората спират да произвеждат този фетален хемоглобин след раждането. Но някои хора с мутация, която причинява сърповидни клетки, всъщност не развиват болестта; телата им продължават да произвеждат фетален хемоглобин, който е здрав и опитен в пренасянето на кислород, вместо да преминат към хемоглобин за възрастни, което не е.
Решението изглеждаше ясно: блокирайте превключването на феталния хемоглобин към възрастен хемоглобин, който се контролира от ген, наречен BCL11A, открит през 2008 г., и хората с мутация на сърповидните клетки няма да получат болестта.
От 50 години знаем какво причинява сърповидно-клетъчна болест. Къде е лечението?
След десетилетия без напредък срещу сърповидните клетки учените бяха на път да направят това. Деактивирането на BCL11A при лабораторни мишки позволява на животните да продължават да произвеждат фетален хемоглобин, установи проучване от 2011 г. След това учени, водени от д-р Дейвид Уилямс от Dana-Farber/Children’s, стартираха допълнителни експерименти с мишки, за да проправят пътя за клинично изпитване на генна терапия, която да поддържа включването на производството на здравословен фетален хемоглобин.
Той и неговият екип премахват стволови клетки от кръвта (които произвеждат всякакви кръвни клетки) от мишки, след което вливат генетично променените клетки обратно в животните. Ако всичко вървеше добре, променените клетки на мишката щяха да направят изход за техния естествен дом - костен мозък - и да създадат магазин там, произвеждайки безкрайно снабдяване на червените кръвни клетки със здрав фетален хемоглобин, а не с необичаен хемоглобин за възрастни.
Преди три години обаче Уилямс получи шок: нокаутирането на BCL11A не просто блокира превключването на хемоглобина между плода и възрастния. Той също така предпазва кръвните стволови клетки от успешно „присаждане“ или задържане в костния мозък. „Когато повалихме BCL11A, животните много бързо загубиха този прираст“, каза Уилямс. "Беше напълно неочаквано."
И това беше голям проблем. Това означаваше, че генната терапия, деактивираща гена BCL11A на хемоглобина за фетал до възрастен, е била осъдена да се провали. Генетично модифицираните кръвни стволови клетки наистина биха направили здрав фетален хемоглобин. Но след като се установят в костния мозък, те ще изсъхнат като орхидея, трансплантирана в пясъка на Сахара. Това обаче не само би обрекло самата генна терапия. Това също би причинило сериозни проблеми за развитието на кръвта, токсичен ефект, който никой не е предвиждал.
Оказа се, че BCL11A има много работа, освен да изключи производството на фетален хемоглобин. Този ген е транскрипционен фактор, което означава, че включва други гени. В зависимост от това с какви други молекули си партнира, BCL11A също активира гени, необходими за присаждането на стволови клетки. Преди новото проучване, публикувано в Journal of Clinical Investigation, „изобщо нямаше намек за тази роля“, каза Уилямс. Кръвните стволови клетки с инвалиден BCL11A, при трансплантация обратно на мишки, „бяха изчезнали за две до четири седмици, вместо да траят вечно“.
Генната терапия, която е насочена към транскрипционен фактор като BCL11A, „е малка част от кутията на Пандора, тъй като не знаете на какви други функции ще повлияете“, каза д-р Мичъл Вайс от Детската болница за деца в Сейнт Джуд, който беше не участва в новото проучване.
Поне една водеща компания за генна терапия се насочва към клинично изпитване, деактивиращо BCL11A; почти със сигурност щеше да се провали. Уилямс убеждава компанията да се оттегли, вероятно предотвратявайки поредното неуспешно проучване за генна терапия.
Големи надежди за генна терапия, породени от неравномерни клинични резултати
През последните три години екипът на Уилямс работи по създаването на начин за заглушаване на BCL11A само в предшествениците на червените кръвни клетки, а не във всички кръвни стволови клетки. Те успяха. Клетките от четири сърповидно-клетъчни пациенти са заглушили BCL11A (чрез молекула, наречена „РНК с къса фиби“) и продължават да произвеждат фетален хемоглобин, изтласквайки сърповидната версия за възрастни.
Мишките, лекувани с BCLA11A-заглушаваща терапия, произвеждат червени кръвни клетки, които имат поне 80 процента здрав фетален хемоглобин, а не сърповиден възрастен хемоглобин. Това се смята за повече от достатъчно за излекуване на сърповидни клетки. И от решаващо значение, тъй като BCL11A е KO’d само в някои клетки от мишките, кръвните стволови клетки успешно създават магазин в мозъка на мишките.
Вайс каза, че резултатите на Уилямс „показват, че можете да бъдете точни в насочването на потискането на [BCL11A]“, очевидно елиминирайки токсичните странични ефекти. „Приближаваме се към успеха“ при намирането на генна терапия за сърповидни клетки, каза той. Конкуриращите се екипи преследват поне три различни подхода, добави той, включително използването на CRISPR редактиране на генома, както той и колегите му докладваха миналия месец.
„Смятаме, че това са данните, които ще ни позволят да преминем в първото изпитване за човешка генна терапия за сърповидни клетки“, използвайки този подход, каза Уилямс. Администрацията по храните и лекарствата проведе проучването, което ще оцени безопасността на генетичната терапия BCL11A, предварително добре и Уилямс очаква да поиска окончателно одобрение от FDA следващия месец.
Молекулата, потискаща BCL11A, е лицензирана на Bluebird Bio, която ще плати за нейното производство. Уилямс е кандидатствал за безвъзмездна финансова помощ от Националния здравен институт за провеждане на изпитанието и се надява даден филантроп да осигури останалата част от необходимото финансиране.
- Диета и клетъчна терапия
- Ефекти от инфекция с Helicobacter pylori и западна диета върху гена на мигрена, клетките и тъканите пълни
- Ексклузивно ентерално хранене (EEN) Формулирана диета NiMBAL NIMBAL терапия Лекува IBD с диета
- Упражнението може да надмогне гена за затлъстяване
- Коронавирус Как да пазарувате за здравословни храни, които ще продължат две седмици