Юно Песен
1 Институт по медицина на животните, Колеж по ветеринарна медицина, Национален университет Gyeongsang, Джинджу 660-701, Корея; moc.liamg@5080gnosonuy (Y.S.); moc.revan@1235eehnus (S.-H.J.); rk.ca.ung@kcnow (C.-K.W.)
Су-Юнг Лий
2 Департамент по храните и храненето, Национален университет Gyeongsang, Джинджу 660-701, Корея; ten.liamnah@69yrdob
Сун-Хи Джанг
1 Институт по медицина на животните, Колеж по ветеринарна медицина, Национален университет Gyeongsang, Джинджу 660-701, Корея; moc.liamg@5080gnosonuy (Y.S.); moc.revan@1235eehnus (S.-H.J.); rk.ca.ung@kcnow (C.-K.W.)
Тае Хун Ким
3 Департамент по хранителни науки и биотехнологии, Университет Тегу, Гюнсан 712-714, Корея; rk.ca.ugead@7yeyks
Хонг-Дък Ким
4 Катедра по екологични здравни науки, Нюйоркски медицински колеж, Валхала, Ню Йорк 10595, САЩ; ude.cmyn@miK_kcuDgnoH
Сун-У Ким
5 Станция за генетични ресурси на животните, Национален институт по наука за животните, RDA, Namwon 590-832, Корея; rk.aerok@oowgnus
Чунг-Кил Уон
1 Институт по медицина на животните, Колеж по ветеринарна медицина, Национален университет Gyeongsang, Джинджу 660-701, Корея; moc.liamg@5080gnosonuy (Y.S.); moc.revan@1235eehnus (S.-H.J.); rk.ca.ung@kcnow (C.-K.W.)
Jae-Hyeon Cho
1 Институт по медицина на животните, Колеж по ветеринарна медицина, Национален университет Gyeongsang, Джинджу 660-701, Корея; moc.liamg@5080gnosonuy (Y.S.); moc.revan@1235eehnus (S.-H.J.); rk.ca.ung@kcnow (C.-K.W.)
Резюме
1. Въведение
Затлъстяването е състояние, при което човек има необичайно висок и нездравословен дял от телесните мазнини. Затлъстяването е основен рисков фактор за много метаболитни нарушения, включително хиперлипидемия, захарен диабет, атеросклероза, хипертония и сърдечно-съдови заболявания [1]. Физиологично затлъстяването се свързва с повишени нива на адипоцити и увеличаване на обема на адипоцитите. Въпреки че натрупаните вътреклетъчни триглицериди могат да бъдат разградени чрез упражнения или диета, затлъстяването, причинено от увеличения размер на мастните клетки и броя им, е трудно за лечение, тъй като мастните клетки трябва да бъдат унищожени или отстранени.
Адипогенезата е многоетапен процес, включващ каскада от транскрипционни фактори и специфична за адипоцитите генна експресия, водеща до развитие на адипоцити. Липидното натрупване отразява процеса на адипогенеза, който се регулира от генетични и растежни фактори [2,3]. Адипогенезата е процес на диференциация, при който преадипоцитните клетки се подлагат на терминална диференциация до зрели адипоцити. CCAAT/енхансер свързващ протеин-δ (C/EBPδ) и CCAAT/енхансер свързващ протеин-β (C/EBPβ) се експресират бързо и преходно след хормоналната индукция на диференциация [4,5]. Тези гени действат синергично за насърчаване на експресията на CCAAT/енхансер свързващ протеин-α (C/EPBα) и активиран от пероксимален пролифератор рецептор-y (PPARγ), които са основните адипогенни транскрипционни фактори [6,7]. След диференциация адипоцитите регулират липидния метаболизъм чрез липогенни протеини като синтаза на мастни киселини (FAS) и aP2 [7].
Сигнализирането за инсулин и Akt модулира растежа на мастната тъкан и адипогенезата [8]. Инсулинът стимулира усвояването на глюкоза и свободни мастни киселини, инхибира липолизата и стимулира синтеза на мастни киселини de novo в адипоцитите. Ser/Thr киназата Akt играе съществена роля в диференциацията на адипоцитите. Миши ембрионални фибробласти (MEFs), при които липсва Akt, показват неспособност да се диференцират в адипоцити [9] и е установено, че RNAi-медиираното намаление на Akt блокира диференциацията на 3T3-L1 клетки [10]. Гликоген синтазата киназа-3β (GSK-3β), която контролира синтеза на гликоген и протеини сред много други клетъчни процеси, беше една от първите описани физиологични цели на Akt [11].
Напоследък медицинската употреба на естествени растителни продукти може да осигури по-ефективни и по-евтини лекарства за хората от всякога. Artemisia annua L., известен също като едногодишен пелин (AW), е често срещан вид пелин, който принадлежи към семейство Asteraceae. Едногодишните пелинни листа (AWL) се използват от много векове в традиционната медицина в Азия за лечение на фебрилни заболявания и малария. Сред основните компоненти като монотерпени, камфор и кетон на Artemisia в Artemisia annua L., артемизининът, който играе критична роля в антиоксиданта и противовъзпалителното средство с формула C15H22O15 и се характеризира със структурни характеристики, съдържа пероксиден мост (COOC) [ 12]. Като важна биологична функционалност е известно, че артемизининът има антибактериални, противогъбични, анти-лайшманиални, антиоксидантни, противотуморни и противовъзпалителни действия [13,14,15]. По-специално, артемизиновата киселина, изолирана от AW, инхибира адипогенната диференциация на мезенхимни стволови клетки, получени от човешка мастна тъкан [16].
Едногодишният пелин е свързан с много ползи за здравето. Остава обаче неизвестно как AWL насърчава ефект срещу затлъстяването при 3T3-L1 адипоцити и диети с високо съдържание на мазнини (HFD), индуцирани със затлъстяване. В настоящото проучване ефектът от екстрактите на AWL върху диференциацията на адипоцитите в 3T3-L1 клетките беше изследван чрез измерване на натрупването на вътреклетъчни капчици триглицериди, както и нивата на експресия на няколко гена, свързани с адипогенезата. Освен това, за да разберем специфичните механизми на тези ефекти, ние изследвахме дали активирането на Akt и GSK3β е критично за антиадипогенните функции на AWL. По-нататък оценяваме ефектите срещу затлъстяването на AWL при затлъстели плъхове, хранени с високомаслена диета (HFD).
2. Материали и методи
2.1. Приготвяне на екстракти от едногодишен пелин (AWL)
Пресни листа от едногодишен пелин (AW) бяха събрани веднага след прибирането на реколтата през май 2016 г. в Джинджу, Кьоннам (Банка за биологични ресурси на животните, Кьоннам, Корея). Едногодишните пелинни листа (AWL) са удостоверени от професор Т. Х. Ким от Департамента по хранителни науки и биотехнологии, Университет Тегу, Корея. Пресни проби от едногодишни листа от пелин се приготвят чрез алкохолна екстракция. Листата се нарязват след измиване с течаща вода, сушат се във фурна при 40 ° С в продължение на 2 дни, последвано от смилане на прах. След това прахът AWL (30 g) се суспендира в 80% (v/v) етанолов разтвор с помощта на миксер, последвано от екстракция на пробите в продължение на 3 дни с енергично разклащане при стайна температура и филтриране през филтърна хартия Whatman No. 1. Етаноловите екстракти от AWL се концентрират, използвайки ротационно-вакуумно изпаряване при 50 ° C и след това лиофилизирани.
2.2. Клетъчна култура
Преадипоцитите на мишки 3T3-L1 са закупени от Корейската банка за клетъчни линии (Сеул, Корея) и са култивирани, както е описано другаде [17]. Накратко, клетките бяха култивирани в модифицирана среда на Dulbecco's Eagle с висока глюкоза (DMEM), допълнена с 10% телешки серум при 37 ° C в овлажнена атмосфера от 5% CO2. На 1 ден след конфлуенция (обозначен „ден 0“), клетъчната диференциация се индуцира със смес (DMI) от 0,5 тМ 3-изобутил-1-метилксантин, 100 цМ индометацин, 0,25 цМ дексаметазон и 167 пМ инсулин в DMEM, съдържащ 10% FBS . 3-изобутил-1-метилксантин (MIX), дексаметазон (DEX), индометацин и Oil Red O са получени от Sigma-Aldrich (Сейнт Луис, МО, САЩ). Средата се сменяше на всеки 2 дни. AWLs бяха добавени към културалната среда на адипоцитите на ден 0. Клетките бяха третирани с 0, 25 или 100 μg/ml AW екстракти всеки ден. След лечение с AWL в продължение на 4 и 7 дни, 3T3-L1 адипоцитите бяха лизирани за Western blot анализ. За да се анализира жизнеспособността на клетките, се оцени цитотоксичността на AWL, използвайки 3- (4, 5-деметилтиазол-2-ил) -2, 5-дифенилтетразолиев бромид (MTT).
2.3. Маслено червено O оцветяване
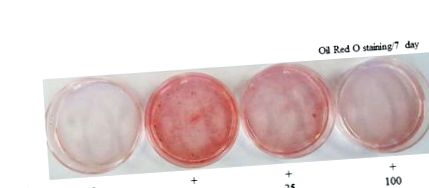
Съдържанието на клетъчни липиди се оценява чрез оцветяване с Oil Red O (Sigma, Сейнт Луис, МО, САЩ). Клетките се третират или с AWL екстракти (25 μg/mL или 100 μg/mL) или носители в диференциращата среда за дни 0–7 на адипогенезата. На 4 или 7 ден клетките се оцветяват с маслено червено O. За оцветяване с маслено червено О клетките се измиват внимателно с буфериран с фосфат физиологичен разтвор (PBS) и се оцветяват с филтриран разтвор на масло червено О (60% изопропанол и 40% вода) за 30 минути. След оцветяване на липидните капчици в червено, разтворът за оцветяване Oil Red O се отстранява и плочите се изплакват с вода и се изсушават. След 3 измивания с PBS, клетките са заснети с 12-мегапикселова цифрова камера (Canon, Токио, Япония).
2.4. Измерване на съдържанието на триглицериди
Съдържанието на клетъчни триглицериди се измерва с помощта на търговски комплект за анализ на триглицериди (Sigma-Aldrich, St Louis, MO, USA), съгласно инструкциите на производителя. Адипоцитите, диференцирани в продължение на 4 или 7 дни, се третират с AWL при концентрации от 0, 25 и 100 μg/ml в плаки с 6 ямки. За да се анализира съдържанието на клетъчни триглицериди, клетките се измиват с PBS и след това се остъргват в 200 μL PBS и се хомогенизират чрез обработка с ултразвук за 1 min. Лизатите бяха анализирани за общите триглицериди, използвайки тестовите комплекти.
2.5. RT-PCR
2.6. Анализ на Western Blot
Уестърн блотинг се извършва съгласно стандартни процедури. Накратко, клетките бяха лизирани в лизисен буфер, съдържащ 50 mM Tris-HCl (pH 8,0), 0,4% Nonidet P-40, 120 mM NaCl, 1,5 mM MgCl2, 0,1% натриев додецил сулфат (SDS), 2 mM фенилметилсулфонил флуорид, 80 μg/ml левпептин, 3 mM NaF и 1 mM дитиотреитол (DTT). Клетъчните лизати (50 μg протеин) се разделят чрез 10% SDS-полиакриламиден гел електрофореза, прехвърлят се върху мембрана от поливинилиден флуорид (Amersham Pharmacia, Little Chalfont, Англия, Великобритания), блокират се с 5% обезмаслено мляко и се хибридизират с първични антитела. PPARy, C/EBPβ, C/EBPα, aP2, Akt и GSK3β антитяло са от Cell Signaling (Danvers, MA, USA), а моноклоналните β-актинови антитела са от Chemicon (Temecula, California, USA). Белязан от хрян пероксидаза (HRP) миши анти-заешки IgG е от Jackson ImmunoResearch (West Grove, PA, USA). Комплектът за хемилуминесценция е от Pierce (Рокфорд, Илинойс, САЩ). След инкубация с конюгирано с хрян-пероксидаза вторично антитяло при стайна температура, имунореактивните протеини бяха открити с помощта на хемилуминесцентен ECL Assay Kit (Amersham Pharmacia, Little Chalfont, Англия, Великобритания) съгласно инструкциите на производителя.
2.7. Животни и диети
Четириседмични мъжки плъхове Sprague – Dawley са закупени от Central Lab Animal Inc. (Сеул, Корея). Всички експерименти с животни са извършени в съответствие с етичните насоки, установени от институционалната грижа за животните на Националния университет в Кьонсан и с одобрението на комисията по грижи и употреба на животните към Националния университет в Кьонгсанг (Номер на одобрение: GNU-160912-R0032). Експериментите започват след аклимация на животните в продължение на 7 дни при постоянни условия на температура (22 ° C), влажност (55%) и светлина (12 часа цикъл тъмно/светло) в клетки от поликарбонат. Животните бяха разделени на случаен принцип в три групи (n = 10) и хранени с нормалната или експериментална диета в продължение на 5 седмици, както следва: (1) нормална диетична група (ND, n = 10); (2) диетична група с високо съдържание на мазнини (HFD, n = 10); (3) AWL група (HFD + AWL 150 mg/kg BW, n = 10). Плъховете от групата на ND са хранени с нормална диета (# 55VXT0038, Samyang Co., Сеул, Корея). Хранене на плъхове с диета с високо съдържание на мазнини произвеждаше затлъстели плъхове, а плъховете от групите с HFD са били хранени с HFD въз основа на търговска диета (диета с гризачи с 60% ккал мазнини, Research Diet, Сеул, Корея). Животните получиха свободен достъп до храна и вода в продължение на пет седмици. Приемът на храна се измерва ежедневно и плъховете се претеглят два пъти седмично. В края на експерименталния период плъховете се умъртвяват след 12 часа гладуване.
2.8. Биохимичен анализ
Цели кръвни проби се центрофугират в епруветка, съдържаща хепарин като антикоагулант, и изолиран серум се използва за анализ на триглицериди (TG), общ холестерол (TC) и липопротеин-холестерол с висока плътност (HDL-C). След центрофугиране органичният слой се отстранява и суши. Получената пелета се разтваря във фосфатно буфериран физиологичен разтвор, съдържащ 1% Triton X-100, и съдържанието на триглицериди се определя, като се използва търговски наличен ензимен реактивен комплект (Asan phams, Co., Hwaseon-si, Korea). Концентрациите на общ холестерол (TC) и липопротеин-холестерол с висока плътност (HDL-C) са анализирани ензимно с помощта на търговските комплекти (Asan phams, Co., Корея).
2.9. Хистологичен анализ
Епидидималните мастни тъкани бяха отстранени и фиксирани в 10% неутрално буфериран формалин. Впоследствие мастните подложки бяха вградени в парафин, разделени на 5 μm участъци (Leica, Wetzlar, Германия) и оцветени с хематоксилин-еозин за микроскопска оценка (Olympus, Tokyo, Japan). Три различни области на напречното сечение и съответните им клетъчни популации бяха оценени с помощта на програма за анализ на изображения (Image-Pro Plus версия 6.0, Rockville, MD, САЩ).
2.10. Статистически анализ
Всеки експеримент се провежда най-малко три пъти. Данните са изразени като средната стойност ± SD. Използвани са еднопосочни ANOVA и множество тестове на Дънкан, за да се определят значителните разлики между лечебните групи. Стойност на р Фигура 1 А). По-специално, до ден 7, диференцирани 3T3-L1 клетки разкриват 4-5 пъти по-високо конститутивно ниво на съдържание на триглицериди в сравнение с недиференцирани клетки. Въпреки това, вътреклетъчното натрупване на триглицериди е намалено с 43% в 100 μg/ml AWL третирани 3T3-L1 адипоцити в сравнение с напълно диференцирани адипоцити (Фигура 1 B). Извършен е анализ на жизнеспособността на клетките, за да се изследва възможността ефектът AWL да е просто следствие от цитотоксичността. При концентрация от 100 μg/ml, AWL няма значителна активност върху жизнеспособността на клетките в сравнение с контролите и не причинява цитотоксичност в клетките 3T3-L1 след 4 или 7 дни инкубация (Фигура 1 С). Заедно тези резултати показват, че AWL упражнява антиадипогенен ефект върху адипоцитите на 3T3-L1.
Ефекти на AWL върху натрупването на липиди и диференциацията на адипоцитите в 3T3-L1 клетки. (A). 3T3-L1 клетки бяха индуцирани да се диференцират с DMI и AWL в нарастващи концентрации (0, 25 и 100 μg/mL) в продължение на седем дни. Съдържанието на клетъчни липиди се оценява чрез оцветяване с Oil Red O. DMI: 0,5 mM 3-IBMX, 100 μM индометацин, 0,25 μM дексаметазон и 167 nM инсулин. AWL: едногодишни екстракти от пелин. (Б.) AWL инхибира натрупването на TG в адипоцитите на 3T3-L1. Използвани са три независими експеримента за представяне на грешките. * p Фигура 2 A, B). След това, за да се изследват моделите на експресия на протеини на адипогенно специфични гени по време на диференциацията на 3T3-L1, нивата на протеин на C/EBPβ, C/EBPα и PPARy бяха измерени чрез Western blot анализ. Нивата на експресия на C/EBPβ, C/EBPα и PPARy бяха намалени в зависимост от дозата след лечение с AWL в продължение на четири или седем дни (Фигура 2 С). Тези резултати показват, че AWL блокира диференциацията на адипоцитите на 3T3-L1 чрез понижаване на експресията на C/EBPβ, C/EBPα и PPARy. Освен това, за да определим дали репресията на PPARy и C/EBPα причинява понижаване на регулацията на техния целеви ген, aP2, ние изследвахме активирането на aP2 при същите условия. Лечението с AWL значително намалява експресията на aP2 в сравнение с тази на напълно диференцираните 3T3-L1 адипоцити (Фигура 2 В).
- Едногодишният лист от пелин инхибира
- В56алфапротеин фосфатаза 2А инхибира мастната липолиза при затлъстели мишки, предизвикани от диета с високо съдържание на мазнини -
- Наднорменото тегло - не само затлъстяване - убива милиони годишно, казват експертите Obesity The Guardian
- 250 милиона деца по целия свят прогнозират затлъстяване до 2030 г. Затлъстяването The Guardian
- Резюме 473 Затлъстяването ще фалира ли пациентите със затлъстяване в САЩ, претърпели сърдечно-белодробна