Резюме
Въведение
Ягода (Фрагария × ананаса Duch.) Е един от най-важните плодове, който се адаптира към различни условия на растеж на околната среда [1]. Ягодовите плодове са привлекателни не само с вкусния си вкус и свеж аромат, но и с хранителните си стойности и антиоксидантни свойства [2]. Тяхното търговско производство за пазара на пресни плодове и преработвателната промишленост се е увеличило значително през последните години и през 2010 г. световното производство на ягоди е 4,4 милиона тона [3]. Бъдещето на производството и продажбите на ягоди е много обещаващо. Полша със своята продукция от 176 000 тона е водещ производител на ягоди в Европа [3]. Ягодите заемат важно място в полската индустрия за замразени плодове и в промишленото производство на ягодови концентрати [4].
Според много изследвания високата консумация на плодове и зеленчуци намалява риска от развитие на много цивилизационни болести. Това е частично свързано с наличието на здравословни вещества в растителните продукти [5, 6]. Благоприятното им влияние се оказва чрез различни допълнителни механизми, които включват редица биоактивни съединения като танини, флавоноиди и фенолни киселини [7]. Известно е, че ягодите са богат източник на полифеноли, като елаготанини (ET) [8, 9], проантоцианидини [4, 10, 11], антоцианини [4, 12] и флавоноли (най-вече кверцетин и кемпферол гликозиди) [2, 13]. Смята се, че елаготанините са най-важните полифеноли в ягодите. Те са естери с високо молекулно тегло на монозахариди, обикновено β-d -глюкоза и няколко остатъци от хексахидроксидифенова киселина (HHDP). Според много изследователи основният елаготанин, идентифициран в ягодовите плодове, е сангуин Н-6; изследванията на Vrhovsek et al. [14] доказаха в основата на ЯМР спектроскопията, че агримониинът, а не сангуинът Н-6 е съединението. Грешката е резултат от един и същ масов спектър на две съединения и липсата на стандарти за известна, документирана структура. Агримониинът е елаготанин, присъстващ и в други растителни части, т.е. в листа [15] и цветя [16].
Качественият и количественият състав на ЕТ в ягодите до момента не е добре решен [7, 17]. Елаготанините и техните метаболити притежават редица здравословни качества, включително антивирусни, антибактериални, антиоксидантни, антимутагенни и антиканцерогенни свойства [18, 19]. По-рано се смяташе, че подобряващата здравето активност на полифенолните съединения се дължи на техните силни антиоксидантни свойства. В наши дни обаче много данни показват, че полифенолите играят важна роля като сигнални молекули, участващи в модулацията на сигналните пътища, като по този начин засягат клетъчната функция и генната експресия, в допълнение към техните директни ефекти върху храносмилателната система [17, 20, 21].
Индустриалната преработка на плодове е придружена от големи количества странични продукти, които, ако бъдат рециклирани, могат да осигурят важен източник на вещества, които представляват добавена стойност в много продукти [22]. Индустриалната ягодова пресова торта, която остава след преработката на сок, възлиза на около 4% от теглото на суровината [23]. Плодовата пресова торта представлява ценен източник на здравословни вещества и особено на диетични фибри и полифеноли [2, 24, 25].
Към днешна дата са проведени проучвания за определяне на полифенолното съдържание и състава на ягодовата плът и семена, често наричани семки, ягодови пюрета без семки [23, 26], както и семена, извлечени от пресната торта [27]. Няма обаче данни относно съдържанието на полифеноли в промишлената пресова торта с ягоди, която е отпадъчен продукт при производството на ягодов сок. По този начин настоящата статия представя изследване на хранителния и полифенолния състав на индустриалната ягодова пресова торта и нейната безсеменна фракция.
Материали и методи
Растителен материал
Материалът за изследването беше прясна промишлена ягодова пресова торта от съвременния завод за трансформация на плодове в региони Мазовия в Полша. Пресованата торта е получена от типично концентрирано производство на ягодов сок, с използване на плодова смес от сортове „Sega Sengana“, „Polka“, „Honeoye“, „Kama“ и „Dukat“. Сортовете са често срещани при индустриалното отглеждане в Полша.
Методи
Определяне на протеини
Четири повторения на измерванията на съдържанието на протеин в пробите бяха направени съгласно официалния метод 920.152 на AOAC, по метода на Kjeldahl [28]. Резултатите са дадени като% протеин на сухо вещество (DM) от пресованата питка.
Мазнините се определят по метода на Soxhlet с петролен етер съгласно официалния метод AOAC 930.09 [29]. Всички проби бяха анализирани в дубликати. Резултатите са изразени като% мазнини на DM от пресованата питка.
Пепел (общо и неразтворимо в киселина)
Общата пепел беше определена съгласно официалния метод 940.26 на AOAC [30]. Неразтворимата в киселина пепел се определя съгласно официалния метод 941.12 на AOAC [31]. Всички проби бяха анализирани четири пъти. Резултатите са изразени като% пепел или неразтворима в киселина пепел на DM от пресованата утайка.
Общо диетични фибри
Общите диетични фибри (TDF) се определят по метода на ензимното тегло съгласно официалния метод на AOAC 985.29 [32]. Резултатите са изразени като% на DM от пресованата торта.
Разтворими твърди вещества
Определянето на разтворимите твърди вещества (SS) на материалите беше направено съгласно метода ISO 2173: 2003 [33], използвайки PR-32a Digital Refractometer (Atago, Tokyo, Japan). Направени са две повторения на измерванията за всяка проба и резултатите са дадени в проценти (%).
Захари
Захарта глюкоза и фруктоза се определят по метода HPLC, описан в предишна работа [34].
Определяне на елаготанини, флавоноли и антоцианини
Екстракцията на полифеноли се извършва, както е описано по-рано [35], на три етапа, като се използва 70% разтвор на ацетон. 500 mg от смления материал се поставят в 7-милилитрова епруветка, върху нея се изсипват 4 ml разтворител и след това се смесва с помощта на вихър и се сонизира в продължение на 15 минути. След сонификацията разтворът се центрофугира (4800ж) и се изсипва в колба. Горната процедура се повтаря два пъти и екстрактите се комбинират. Ацетонът се дестилира от екстрактите чрез използване на вакуумен ротационен изпарител и сухият остатък се разтваря в 2 ml 70% глицерол. Елаготанините в глицеролови разтвори се подлагат на киселинна хидролиза, както следва: 150 μl от 2 М трифлуороцетна киселина (Sigma-Aldrich, Сейнт Луис, МО, САЩ) се добавя към 1 ml екстракт. Хидролизата се провежда при температура 95 ± 1 ° С в продължение на 6 часа. Разтворите преди и след хидролизата се разреждат с метанол, следващият хроматографски анализ се извършва.
Съдържанието на свободна елагова киселина, агримониин и други полифеноли (антоцианини и флавоноли) се определят в глицеролови разтвори преди хидролизата. 0,5 ml от горния разтвор се разреждат в 5 ml метанол и се подлагат на HPLC анализ. Съдържанието на обща елагова киселина беше определено след киселинна хидролиза чрез използване на HPLC методи със същите условия като за свободната елагова киселина. Сумата от елаготанини, изчислена като мономер на галоил-бис-HHDP-глюкоза, се отчита чрез умножаване на разликата между общата и свободната елагова киселина с фактор 1,55. Факторът идва от дела на елаговата киселина в мономерната молекула.
За хроматографския анализ се използва хроматограф Smartline (Knauer, Берлин, Германия), оборудван с дегазатор, две помпи, смесителна камера, автосамплер, колонна фурна и PDA детектор. Разделянето се извършва на колона Phenomenex Gemini 5u C18 110A (250 × 4,60 mm; 5 μm). Колоната се поддържа при 35 ° С. Елуентът A съдържа 0,05% фосфорна киселина във вода, а елуентът B съдържа 0,05% фосфорна киселина в ацетонитрил. Скоростта на потока е 1,25 ml/min. Програмата за градиент беше, както следва: 0–5 мин. 4% В; 5–12,5 мин. 4–15% В; 12,5–42,5 мин. 15–40% В; 42,5–51,8 мин. 40–50% В; 51,8-53,4 мин 50-55% В; и 53,4–55 минути 4% В. Обемът на инжектираната проба е 20 μl. Условията за откриване бяха както следва: 280 nm (стр-кумарова киселина, кемпферол-3-О-β- d - (6 ″ -E-стр-кумароил) -глюкопиранозид, агримоний), 360 nm (елагова киселина, кверцетин и кемпферол гликозиди, кверцетин, кемпферол), 520 nm (антоцианини). Данните са регистрирани от софтуера за хроматография ClarityChrom (Knauer, Берлин, Германия).
Стандартни криви, направени от елагова киселина, кверцетин-3-О-глюкозид, кемпферол-3-О-глюкозид, кверцетин, кемпферол, пеларгонидин-3-О-глюкозид, кемпферол-3-О-β- d - (6 ″ -E-стр-кумароил) -глюкопиранозид (KpCG) (Екстрасинтеза, Genay, Франция), стр-бяха използвани кумарова киселина (Sigma-Aldrich, Steinheim, Германия) и agrimoniin. Съдържанието на кверцетинови производни се определя като сбор от кверцетин гликозиди и кверцетин агликон, където гликозидите се изчисляват като кверцетин-3-глюкозид. Производните на кемпферол се определят като сбор от гликозиди и кемпферол, където гликозидите се изчисляват като кемпферол-3-глюкозид. Отделно се изчислява съдържанието на KpCG в основата на външния стандарт. Антоцианините са изчислени като пеларгонидин-3-глюкозид. Стандартът на Agrimoniin се екстрахира от пресен сладкиш с ягоди и се пречиства чрез препаративна хроматография.
Екстракция и пречистване на агримониин
ЯМР анализ на агримониин
1 H NMR спектър на агримониин е записан в 0,55 ml хексадеутериран ацетон (99,9% CD3COCD3, Merck, Германия) при 25 ° C на спектрометър Bruker Avance III HD 500 NMR, оборудван с 5-милиметрова обратна BBI сонда с z-градиент, работещ на 500,18 MHz (1 H 90 ° широчина на импулса = 8,0 μs). Протонният спектър се отнася вътрешно към остатъчния сигнал на протонирания ацетон δ Н 2.05 ppm. Сравнението на ЯМР спектрите на основния елаготанин, изолиран от ягодов пресен кекс и агримониин, характеризирано от Vrhovsek et al. [14] е представен в Таблица 1. Присвояването на 1Н NMR и за двете вещества е идентично, което потвърждава, че агримониинът е основният ягодов елагитанин. Увеличението на ЯМР спектъра на агримониин (в същия диапазон, както е представен от Vrhovsek et al. [14]) е показано на фиг. 1.
'Н ЯМР спектър в ацетон-d6 на агримониин
HPLC анализ на флаваноли (сума на проантоцианидини и катехини)
Статистика
Всички резултати са анализирани статистически чрез еднопосочен дисперсионен анализ и post hoc тест на Дънкан със статистическа значимост стр ≤ 0,05. За да се илюстрира разликата в съдържанието на изследваните компоненти между SPC и ESF, клъстерният анализ е извършен по метода на к-средната клъстеризация. Статистическият анализ е извършен от софтуера Statistica версия 7 (StatSoft, Tulsa, САЩ).
Резултати и дискусия
Хранителен и полифенолен състав на ягодов пресен кекс (SPC)
Основният химичен състав на пресните сладкиши с ягоди, получени от едно преработвателно предприятие в продължение на три последователни сезона на реколта, е даден в Таблица 2.
Полифенолният състав на SPC от сезоните 2010, 2011 и 2012 е показан в таблица 2; хроматограмите на определени компоненти са представени на фиг. 2. Въпреки многото проучвания върху ягоди, знанията относно полифенолния състав на техните промишлени странични продукти все още са незадоволителни. Няма литературни данни за общите полифеноли в промишлената пресова торта. Има само няколко проучвания за полифенолния състав на семената и отпадъчните странични продукти от производството на ягодово пюре без семена [23]. На свой ред, Oszmiański et al. [10], който изследва промишленото производство на концентриран ягодов сок, се фокусира само върху вариациите в суровината и полифенолите в сока на различни етапи от процеса. Основните полифенолни групи в КХП са флаваноли (проантоцианидини и катехини), които съставляват 56% от общите полифеноли, и елаготанинини, които съставляват близо 40% от полифенолите в пресата. По този начин, танините, както кондензирани, така и хидролизиращи се, представляват 96% от общите полифеноли в пресования кекс. Флавонолите, т.е. кверцетинът и кемпфероловите гликозиди, са следващата най-разпространена група полифеноли, представляващи почти 4% от общите полифеноли.
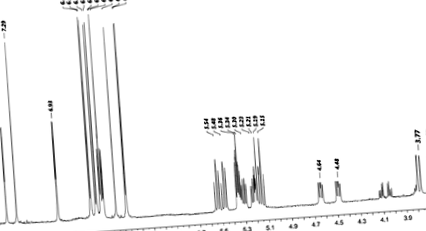
HPLC хроматограма (280 nm, 360 nm, 520 nm) на полифенолни съединения в SPC
Фина линия–HPLC-FD хроматограма на продукти на разцепване на проантоцианидини от SPC. Удебелена линия -HPLC-FD хроматограма преди флороглюцинолиза на проантоцианидини от SPC
Кемпферол-3-О-β- d - (6 ″ -E-p-кумароил) -глюкопиранозид (KpCG) е преобладаващият флавонол в SPC (44–96 mg/100 g DW) и разкрива значителни вариации между трите изследвани сезона. Нивата на кверцетин гликозидите в ягодовия пресен кекс варират от 18,4 до 37,9 mg/100 g DW. Съдържанието на кемпферол гликозиди, освен KpCG, е 10,2–39,7 mg/100 g тегло, докато пресовата торта от 2010 г. има значително по-ниски нива на флавонолни гликозиди, включително кверцетин и кемпферол гликозиди и KpCG, в сравнение с пресните питки от 2011 до 2012 г.
Съдържанието на антоцианини в пресната торта е едва 0,2% от общите полифеноли, докато в плодовете те представляват 13–45% от общите полифеноли [4, 11]. В зависимост от сезона, изследваните пресни питки съдържат от 47 до 87 mg антоцианини на 100 g DW. Ниските нива на антоцианини в пресните пити се дължат на факта, че те се намират във вакуоли и се отстраняват по време на високоефективно извличане на сок. Според Oszmiański et al. [10], 90% от антоцианините се прехвърлят от плодовете в сока по време на промишленото производство на концентриран ягодов сок.
Хранителен и полифенолен състав на ESF
Ягодов пресен кекс (SPC) е дехидратиран страничен продукт от пресоването и екстракцията на вода от плодовата каша, който е до голяма степен лишен от клетъчен сок и хидрофилни вещества. SPC може да бъде разделен на плът и семена. Значителна загуба на маса и разтворимо вещество в процеса на производство на сок се случва най-вече в месото и само в малка степен в семената. Семената имат твърди и непропускливи перикарпи; поради тази причина те запазват своите компоненти и особено мазнини, протеини и полизахариди. Следователно, безсемената фракция на пресната торта се нарича изтощена ягодова плът (ESF). Подобно на пресните сладкиши от други плодове, SPC е смес от тези два компонента (семена и ESF), които се различават един от друг по отношение на морфологията, химичния състав и употребата [27, 34]. В настоящата работа в лабораторен мащаб получихме средно 60% ESF (с размер на частиците от Таблица 3 Съдържание на основните хранителни компоненти (g/100 g DW на пробата), енергийна стойност (kcal/100 g DW на пробата) ), фенолни съединения (mg/100 g DW от пробата), моларен дял на съставните флаваноли и средно DP на проантоцианидини в ESF от сезоните 2011 и 2012
Материалът е получен от две компании за преработка на плодове и зеленчуци (обозначени A и B). Проби от компания А са от сезоните 2011 и 2012, а проби от компания Б само от сезон 2012. Анализираните ESF фракции се характеризират с високи нива на TDF, вариращи от 52 до 62% в сухо тегло; те също съдържат от 19,3 до 21,5% протеин и от 3,1 до 3,5% мазнини. Установено е, че общото ниво на пепел варира значително (от 4.3 до 8.9 g/100 g DW) в тези фракции. Всички проби от 2012 г. съдържат значително повече пепел в сравнение с 2011 г., което показва, че този диференциращ фактор зависи от условията на реколтата. Високото и неравномерно замърсяване на фракциите на ESF с пясък е основният недостатък на този материал, който се добива от почвата, и ограничава използването на ESF за целите на потреблението. Средната енергийна стойност на ESF е 276 kcal/100 g DW и е малко по-ниска от тази на SPC (309 kcal/100 g DW). Съдържанието на разтворими вещества, както и глюкоза и фруктоза е значително по-високо в пробата от 2011 г. Разликите в нивата на въглехидратите вероятно се дължат на различната ефективност на отделянето на сока от пресования сладкиш и екстракцията на последния.
Съдържанието на хранителни вещества и полифеноли в ягодовия пресен кекс и неговата безсеменна фракция бяха анализирани статистически, използвайки k-mean клъстер анализ. Данните, използвани за анализ, бяха стандартизирани. Фигура 4 показва резултатите от клъстерния анализ с два клъстера. Статистическият анализ потвърди разликите между SPC и ESF, т.е. единият клъстер съдържа SPC, докато другият ESF. Диаграмата представя разликите между клъстерите въз основа на разстоянията между точките, представляващи изследваните вещества (разстоянието между точките по Y. ос). Големите разстояния между точките потвърждават значителна диференциация на материалите по отношение на изследваните вещества. Графиката ясно показва, че SPC и ESF се различават значително по отношение на съдържанието на такива вещества като протеини, мазнини, агримониин, кверцетин гликозиди, KpCG и флаваноли.
Клъстер анализ на ягодови пресови сладкиши с използване на к-средна група; клъстер 1 — пресен сладкиш с ягоди (квадрат SPC), клъстер 2 - изтощена плът на ягода (кръг ESF); QD производни на кверцетин, KD производни на кемпферол
- Ягодова торта с ванилова извара; Скандинавско просто хранене
- Процедури за оценка на хранителните стойности за бази данни за състава на храните - ScienceDirect
- Сладко ягодово смути с чийзкейк - вашата чаша торта
- Връзка на пулса в покой с телесния състав и затлъстяването сред младите възрастни в Индия -
- Мезенхимни стволови клетки като регулатори на образуването на кости, мускули и мазнини SpringerLink