Резюме
Заден план
Ограничението на енергията причинява адаптация в енергийните разходи (общо-, TEE; почивка-, REE; индуцирана активност-, AEE).
Обективен
Да се определи дали промените в нивата на протеини, участващи в метаболизма на адипоцитната глюкоза и мастните киселини като показатели за енергиен дефицит, са свързани с адаптациите в енергийните разходи по време на загуба на тегло.
Методи
Четиридесет и осем здрави индивида (18 мъже, 30 жени), средно ± SD възраст 42 ± 8 години и ИТМ 31.4 ± 2.8 kg/m 2, спазват диета с много ниска енергия в продължение на 8 седмици. Протеинови нива на протеин 4, свързващ мастните киселини (FABP4), фруктоза-бисфосфат алдолаза С (AldoC) и късоверижна 3-хидроксиацил-КоА дехидрогеназа (HADHsc) (биопсия на мастна тъкан, Western blot), TEE (вода с двойно етикетиране), REE ( вентилирана качулка) и AEE бяха оценени преди и след 8-седмичната диета.
Резултати
Имаше положителна корелация между намаляването на AldoC и намаляването на TEE (R = 0,438, P
Въведение
Нарастващото разпространение на затлъстяването и съпътстващите го заболявания е един от основните здравословни проблеми в съвременния ни свят [1]. Въпреки че стратегиите за отслабване са насочени към двете страни на енергийния баланс, приема и разходите, успехът при дългосрочното поддържане на загуба на тегло е нисък [2, 3]. Мастната тъкан е важна енергия, съхраняваща и освобождаваща тъкан и за да изпълнят тази роля, адипоцитите трябва да реагират бързо на вариациите в търсенето. Много изследвания свързват затлъстяването с метаболитните процеси на цялото тяло, като намалено окисление на мазнините, както и вътре в адипоцита като намален метаболизъм на дълговерижни мастни киселини [4–7]. Проучванията върху загуба на тегло показват, че ограничаването на енергията води до промени в експресията на гени, участващи в липидния, въглехидратния и енергийния метаболизъм в мастната тъкан [8–13]. По време на ограничаването на енергията ограничаващата наличност на глюкоза трябва да се компенсира от повишено окисление на митохондриалните мастни киселини, за да се запазят нивата на кръвната глюкоза и да се осигурят достатъчно глюкозозависими тъкани с достатъчно енергия, като мозъка или червените кръвни клетки [14].
Биологичният отговор на загуба на тегло причинява възвръщаемостта към възстановяване на теглото, както е прегледано от MacLean et al. [15]. Mariman обобщи този отговор като мрежа от адаптации с енергийна празнина, насърчаваща възстановяването на теглото и физиологични промени, водещи до съпротива за по-нататъшно отслабване [16]. Две от тези адаптации са намаляването на енергийните разходи в отговор на енергийните ограничения, което може да ограничи загубата на тегло и може да бъде важен фактор, който компрометира поддържането на намалено телесно тегло. Първо, проучвания, проведени при слаби и затлъстели лица, показват значително намаляване на енергийните разходи в покой (REE) по време и малко след загуба на тегло, до стойности под прогнозите въз основа на загуба на тегло и промени в телесния състав [17–22]. Намаляването на REE над това, което може да се предвиди чрез загуба на безмаслена маса (FFM) и мастна маса (FM), се определя като адаптивна термогенеза. На второ място, няколко проучвания показват намаляване на физическата активност и предизвиканите от активността енергийни разходи (AEE) в резултат на загуба на тегло [23-28].
Предмети и методи
Субекти
Четиридесет и осем здрави субекта (30 жени и 18 мъже), средна + SD възраст 42 ± 8 години и среден ± SD индекс на телесна маса (ИТМ) 31.4 ± 2.8 kg/m 2, бяха наети чрез реклами в местни вестници и на табла за обяви в университета. Те бяха подложени на първоначален скрининг, който включваше измерване на телесно тегло и ръст и попълване на въпросник за общото здравословно състояние. Всички са били в добро здраве, не са използвали лекарства (с изключение на контрацепцията), непушачи и най-много умерени потребители на алкохол. Те са били стабилни в теглото, както е определено чрез промяна на теглото 2).
Разход на енергия за почивка
В 0800 ч. Сутринта, след пренощуването в университета, субектите бавно отидоха до отделна стая, където почиваха на легло в продължение на 30 минути, последвано от 30 минути измерване на тяхната РЗЕ в легнало положение, използвайки вентилирана отворена верига качулка-система [34]. Газовите анализи бяха извършени с парамагнитен кислороден анализатор (Servomex, тип 1158, Crowborough, Източен Съсекс, Великобритания) и инфрачервен анализатор на въглероден диоксид (Servomex, тип 1520, Crowborough, Източен Съсекс, Великобритания), докато потокът се поддържаше с постоянна скорост от 80 l/min и допълнително измерена, както е описано от Schoffelen et al. [35]. Вътрешният индивидуален коефициент на вариация за тази система е 3,3% ± 2,1 [34]. Изчисляването на REE от измерената консумация на кислород и производството на въглероден диоксид се основава на формулата на Brouwer [36].
В допълнение към измерването на REE с вентилирана система на аспиратора (REEm), REE се прогнозира (REEp) с уравнението: REEp (MJ/d) = 0,024 x маса мазнина (kg) + 0,102 x маса без мазнини x (kg) + 0,85 [37]. Тъй като масата на мазнините (FM) и масата без мазнини (FFM) се използват за изчисляване на REEp, уравнението може да се използва независимо за пола. Адаптивната термогенеза беше изчислена като REEm, разделена на REEp [22].
Общо енергийни разходи, предизвикани от активност
Посоченият метод за оценка на AEE е двойно обозначеният воден метод за измерване на TEE в комбинация с измерване на REE [41]. В началото AEE се изчислява като (0,9 X TEE) - REE, като се приема, че термогенезата, индуцирана от диетата, е 10% от TEE, което се основава на нормална смесена диета [42] и стойностите на DIT за отделните макронутриенти са 10 % за въглехидрати, 3% за мазнини и 25% за протеини. В края на диетата процентният DIT се изчислява въз основа на приема на диетата Modifast и допълнителния прием на храна с нормален смесен състав, който отчита разликата между очакваната загуба на тегло и реалната загуба на тегло. DIT се изчислява на 8% от TEE в края на диетата; следователно AEE се изчислява като (0,92 X TEE) - REE.
Western blot анализ
Три протеина, участващи в метаболизма на глюкозата и мастните киселини, бяха избрани и измерени в мастната тъкан чрез Western blotting. Фруктоза-бисфосфатна алдолаза С (AldoC), свързващ протеин 4 с мастни киселини (FABP4) и 3-хидроксиацил-КоА дехидрогеназа с къса верига (HADHsc).
Коремни биопсии на подкожната мастна тъкан (приблизително 1,5 g) бяха получени чрез липосукция с игла под местна упойка (2% лидокаин, Fresenius Kabi BV, Холандия) след еднодневно гладуване, преди и след диетата. Пробите се изплакват в стерилен студен физиологичен разтвор, замразяват се в течен азот и се съхраняват при -80 ° C до изолиране на протеина.
Замразената мастна тъкан се смила в хаван и прахът се разтваря в 200 μl 8 М урея, 2% CHAPS, 65 mM DTT на 100 mg прах. Хомогенатът се завихря за 5 минути и се центрофугира за 30 минути при 14000 об/мин и 10 ° С. Супернатантата, съдържаща протеома на мастната тъкан, се събира внимателно и аликвотни части се съхраняват при -80 ° С. Концентрациите на протеини се определят чрез анализ на протеин, базиран на Biorad Bradfort [43].
Биохимичен анализ
Кръв се събира в епруветки, съдържащи EDTA, и се центрофугира (1000 × g, 10 минути, 4 ° С) и плазмата незабавно се замразява в течен азот и се съхранява при -80 ° С до анализ. Концентрацията на глюкоза в плазмата се анализира ензимно на автоматизиран спектрофотометър Cobas Mira (Roche Diagnostica). Плазменият инсулин е измерен с радиоимуноанализ с двойно антитяло (Insulin RIA 100, Kabi-Pharmacia, Упсала, Швеция).
Изчисления и статистически анализ
Извършен е сдвоен t-тест (двустранно разпределение), за да се определят възможни разлики между средните стойности. Регресионният анализ и коефициентите на корелация на Spearman Rho бяха изчислени за асоциации между параметри. Използвани са еднопосочни повтарящи се мерки ANOVA за сравняване на резултатите през 0 и 8 седмици, като полът е ковариатен. Значимостта беше определена като P
Резултати
Състав на тялото
След 8 седмици VLED загубата на тегло е средно 9,9 ± 4,1 kg (P Таблица 1 Характеристики на субекта (средно ± SD) на изходно ниво и след 8 седмици на диета с много ниска енергия
Разход на енергия
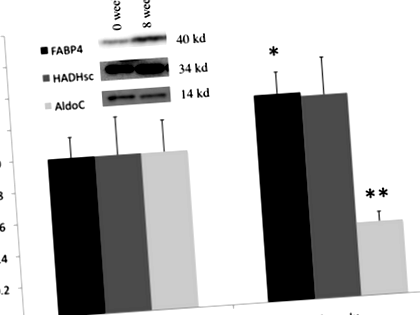
TEE намалява значително от 12,65 ± 2,08 MJ/d в началото на 10,38 ± 1,95 MJ/d (P Фиг. 1
След 8 седмици промяната в FABP4 е в значителна отрицателна корелация с промяната в FM (R = -0,35, P Таблица 2 Коефициентите на корелация на Spearman Rho за промени в нивата на протеин с промени в телесния състав и параметрите на разход на енергия. Увеличените (+) и намалените (-) параметри са посочени в първата колона
След загуба на тегло имаше значителна положителна връзка между промяната в AldoC и процентната промяна в TEE (R = 0,44, P
Дискусия
Измерването на протеини, участващи в метаболизма на глюкозата и мастните киселини преди и след 8-седмичен VLED, отразява метаболитните адаптации, възникващи в мастната тъкан, свързани с енергийните разходи. По-конкретно, намаляването на AldoC, ензим на гликолиза, е свързано с намаляването на AEE, а незначителната промяна HADHsc, решаващ ензим за митохондриално бета-окисление, е в отрицателна корелация с адаптацията в REE. Освен това има корелация между увеличаването на FABP4, вътреклетъчния транспортер на мастни киселини и намаляването на мастната маса и корелация между намаляването на AldoC и намаляването на масата без мазнини. FABP4, AldoC и HADHsc са положително корелирани.
Повишеното FABP4 след загуба на тегло VLED е в съответствие с предишни резултати при затлъстели пациенти [11, 12, 44]. Това е в съответствие с повишаването на вътреклетъчния трафик на мастни киселини, което се очаква по време на отрицателен енергиен баланс, когато се стимулира липолизата, с освобождаването на мастни киселини от съхраняваните триглицериди, които след това могат да се използват за митохондриалното бета-окисление в мазнините клетка или да се секретира от клетката, за да служи като източник на енергия за други тъкани. По време на енергийни ограничения, увеличаването на липолизата и вътреклетъчният трафик на мастни киселини води до намаляване на мастната маса. Това би било в съответствие с наблюдаваната корелация между увеличаване на FABP4 и загуба на мастна маса.
Намаленият AldoC по време на ограничаване на енергията е в съответствие с предишни резултати при затлъстели пациенти на диета с ограничено потребление на енергия [11, 12]. Едновременно с това кръвната захар не се променя след ограничаване на енергията. Постоянно наблюдаваното намаляване на AldoC по време на ограничаване на енергията [13], предполага, че това може да е маркер за гликолитичния поток в мастната тъкан. В допълнение, паралел между намаляването на гликолитичния поток в мастната тъкан от една страна и намаляването на активността и използването на мускули, от друга страна, може да е в основата на наблюдаваната корелация между намаляването на AldoC и намаляването на AEE. Намаляването на AEE е в съответствие с предишни проучвания, които показват намаляване на физическата активност след ограничаване на енергията [23-28]. Хипотетично нашите резултати могат да покажат, че по време на намалена наличност на глюкоза като субстрат има намален гликолитичен поток в мастната тъкан и намалена активност, за да се запази кръвната глюкоза като запас за глюкозозависими тъкани, като мозъка или червените кръвни клетки 45]. Освен това, намалената наличност на субстрат може да увеличи търсенето на аминокиселини като източник на енергия за други тъкани [46]. Това би било в съответствие с наблюдаваната корелация между намаляването на AldoC и намаляването на масата без мазнини.
HADHsc не се увеличава значително в края на 8-седмичния VLED, който е описан преди [11, 12]. Преди това Bouwman et al. показа положителна корелация между три ензима на бета-окислението (HADHsc, Acetyl-CoA ацетилтрансфераза и Acyl-CoA дехидрогеназа) и свободни от плазма мастни киселини (FFA) по време на поддържане на загуба на тегло [13]. Очевидно нивото на мастната тъкан на HADHsc е паралелно с нивото на плазмения FFA. Повишеното ниво на FFA по време на енергийното ограничение би подпомогнало енергийния поток към други периферни тъкани, което би могло да позволи по-ниска адаптивна термогенеза в REE. Изглежда, че това е в съответствие с наблюдаваната корелация между промяната в HADHsc и адаптивната термогенеза след 8-седмичното VLED. HADHsc е от решаващо значение за бета-окислението [29, 30]. Следователно е възможно промените в HADHsc да отразяват промените в потока на мастни киселини през митохондриалния път на бета-окисляване. Хипотетично, регулирането на митохондриалния бета-окислителен поток може да бъде следствие от активирана липолиза, водеща до повишена плазмена FFA и по-малка адаптивна термогенеза в REE.
Корелацията между FABP4 и HADHsc също би била в съответствие с нивото на HADHsc, отразяващо липолитичната активност, тъй като това би успоредно с изискването за вътреклетъчен трафик на мастни киселини. Освен това, повишен трафик и бета-окисление на мастни киселини в мастната тъкан може да съвпадне с намален поток през гликолитичния път. В това отношение положителната корелация между AldoC и FABP4 и HADHsc би означавала, че по-високият поток на мастните киселини е по-добър за поддържане на гликолитичния поток.
Ограничение на това проучване е използването на материал за биопсия на цялата мастна тъкан за Western blotting, тъй като това би могло да съдържа други типове клетки в стромалната съдова фракция. Резултатите от предишните ни проучвания обаче показват, че по-голямата част от изолирания протеин е получен от адипоцити [13]. Освен това бета-актинът не показва значителни промени и е избран за контрол на домакинството, за да може да сравнява настоящите резултати с тези от други проучвания. Въпреки че избраните протеини участват в основните стъпки на метаболизма на глюкозата и мастните киселини и могат да отразяват капацитета на метаболитните пътища, трябва да се отбележи, че нивата на протеини не представляват действителния поток през пътищата. Освен това, наблюдаваните корелации на мастните тъкани не могат да бъдат преведени в регулаторни механизми и не са подходящи за доказване на причинно-следствена връзка. Въпреки това, наблюдаваните резултати са в съответствие с интуитивните очаквания и хипотезираните механизми могат да бъдат обект на бъдещи изследвания.
В заключение, по време на ограничаване на енергията, молекулярният метаболизъм в мастната тъкан е свързан с енергийните разходи. По-конкретно, намаляването на AldoC е свързано с намаляването на AEE, което може да се обясни със запазването на глюкозата, а промяната в HADHsc е свързана с адаптивната термогенеза в REE, което може да се обясни с промени в бета-окислението и липолиза. Като цяло нашите открития разкриват връзка между промените на физиологично ниво и промените в молекулярния метаболизъм в мастните клетки. Това показва важната роля на мастната тъкан при затлъстелите хора. Молекулните промени в мастната тъкан в резултат на отрицателен енергиен баланс може дори да са основният двигател на адаптациите в телесния състав и енергийните разходи (Фиг. 2).
Преглед на мрежата от промени в мастната тъкан в резултат на отрицателен енергиен баланс и хипотетичните връзки с адаптации в телесния състав и енергийните разходи. FABP4, протеин, свързващ мастни киселини 4, HADHsc, късоверижна 3-хидроксиацил-КоА дехидрогеназа, AldoC, фруктоза-бисфосфат алдолаза С, FM, мастна маса, FFM, безмаслена маса, FFA, свободни мастни киселини, REE, разход на енергия в покой, AEE, разход на енергия, предизвикан от активност, TEE, общ разход на енергия
- Намаляване на теглото и урсодезоксихолева киселина при пациенти с неалкохолно мастно чернодробно заболяване
- Намаляване на теглото и урсодезоксихолева киселина при пациенти с неалкохолно мастно чернодробно заболяване
- Влиянието на промените в теглото върху безалкохолната мастна чернодробна болест при възрастни мъже с нормално тегло
- Промените са очевидни; Ева Полна се похвали с резултат от загуба на тегло; Новини за знаменитости
- Отслабването на Wellbutrin може да причини промени в теглото