От Klinik für Innere Medizin III (S.W., T.C., M.B., G.N.), Universitätsklinikum des Saarlandes, Homburg/Saar, Германия; Aventis Pharma Deutschland (M.v.E.), Група за сърдечно-съдови заболявания, Франкфурт/Майн, Германия; и Institut für Kardiovaskuläre Physiologie (I.F.), Университет Йохан В. Гьоте, Франкфурт/Майн, Германия.
От Klinik für Innere Medizin III (S.W., T.C., M.B., G.N.), Universitätsklinikum des Saarlandes, Homburg/Saar, Германия; Aventis Pharma Deutschland (M.v.E.), Група за сърдечно-съдови заболявания, Франкфурт/Майн, Германия; и Institut für Kardiovaskuläre Physiologie (I.F.), Университет Йохан В. Гьоте, Франкфурт/Майн, Германия.
От Klinik für Innere Medizin III (S.W., T.C., M.B., G.N.), Universitätsklinikum des Saarlandes, Homburg/Saar, Германия; Aventis Pharma Deutschland (M.v.E.), Група за сърдечно-съдови заболявания, Франкфурт/Майн, Германия; и Institut für Kardiovaskuläre Physiologie (I.F.), Университет Йохан В. Гьоте, Франкфурт/Майн, Германия.
От Klinik für Innere Medizin III (S.W., T.C., M.B., G.N.), Universitätsklinikum des Saarlandes, Homburg/Saar, Германия; Aventis Pharma Deutschland (M.v.E.), Група за сърдечно-съдови заболявания, Франкфурт/Майн, Германия; и Institut für Kardiovaskuläre Physiologie (I.F.), Университет Йохан В. Гьоте, Франкфурт/Майн, Германия.
От Klinik für Innere Medizin III (S.W., T.C., M.B., G.N.), Universitätsklinikum des Saarlandes, Homburg/Saar, Германия; Aventis Pharma Deutschland (M.v.E.), Група за сърдечно-съдови заболявания, Франкфурт/Майн, Германия; и Institut für Kardiovaskuläre Physiologie (I.F.), Университет Йохан В. Гьоте, Франкфурт/Майн, Германия.
От Klinik für Innere Medizin III (S.W., T.C., M.B., G.N.), Universitätsklinikum des Saarlandes, Homburg/Saar, Германия; Aventis Pharma Deutschland (M.v.E.), Група за сърдечно-съдови заболявания, Франкфурт/Майн, Германия; и Institut für Kardiovaskuläre Physiologie (I.F.), Университет Йохан В. Гьоте, Франкфурт/Майн, Германия.
Преглеждате най-новата версия на тази статия. Предишни версии:
Резюме
Заден план- Активирането на рецептора за ангиотензин II тип 1 (AT1) потенциално участва в мултифакторната патогенеза на атеросклерозата.
Заключения— Генетичното нарушаване на AT1A рецептора води до инхибиране на съдовия оксидативен стрес, ендотелна дисфункция и образуване на атеросклеротични лезии при мишки ApoE -/-, независимо от кръвното налягане и нивата на холестерола в плазмата. Тези резултати показват фундаментална роля на активирането на AT1 рецептора в атерогенезата.
Патогенезата на атеросклерозата включва продължително излагане на рискови фактори и слабо разбрано генетично предразположение. 1 Оксидативният стрес и възпалението са решаващо включени в инициирането и прогресирането на атеросклерозата, което води до засилено привличане, адхезия и инвазия на макрофаги и лимфоцити, отлагане на липиди в съдовата стена, образуване на плаки и дестабилизация на предварително формираните атеросклеротични лезии. 2,3
Това понятие обаче е доказано досега само от механистични и фармакологични проучвания. За да тестваме ролята на активирането на AT1 рецептора при атеросклероза в различен, по-специфичен модел, използвахме генетичен подход. Мишките с дефицит на Аполипопротеин Е (ApoE -/-) страдат от преждевременна атеросклероза, основана на тежко липидно разстройство, което се допълва от богати на холестерол диети. 14 Генерирахме двойно нокаутиращи животни с дефицит на ApoE и AT1A рецептори и изследвахме ефекта на богата на холестерол диета върху развитието на съдов оксидативен стрес, ендотелна дисфункция и формиране на атеросклеротични лезии в този модел на атеросклероза, предизвикана от липиди.
Методи
Маслено червен O разтвор, соли и други химикали са закупени от Sigma Chemical. L-012 е получен от Wako Chemicals.
Животни и процедури
Измерване на съдови реактивни кислородни видове
Освобождаването на супероксид в непокътнати аортни сегменти се определя чрез L-012 хемилуминесценция. L-012 е производно на луминол с висока чувствителност към супероксидни радикали, което не упражнява редокс циклиране. 15 аорти бяха внимателно изрязани и поставени в охладен, модифициран Krebs-HEPES буфер (рН 7,4; в mmol/L: NaCl 99.01, KCl 4.69, CaCl2 1.87, MgSO4 1.20, Na HEPES 20.0, K2HPO4 1.03, NaHCO3 25.0, D (+) глюкоза 11.1). Съединителната тъкан беше отстранена и аортите бяха нарязани на 2-милиметрови сегменти. Аортните сегменти се прехвърлят в сцинтилационни флакони, съдържащи Krebs-HEPES буфер със 100 μmol/L L-012 и се инкубират в продължение на 5 минути. След това хемилуминесценцията се оценява в продължение на 15 минути в сцинтилационен брояч (Lumat LB 9501, Berthold) на интервали от 1 минута. След това сегментите на съда се изсушават и се определя теглото на сухото вещество. Освобождаването на супероксид се изразява като относителна хемилуминесценция на милиграм аортна тъкан.
Подготовка на аортния пръстен и запис на напрежението
След изрязване на низходящата аорта съдът се потапя в охладен буфер, съдържащ в mmol/L NaCl 118.0, CaCl2 2.5, KCl 4.73, MgCl2 1.2, KH2PO4 1.2, NaHCO3 25.0, Na EDTA 0.026, D (+) глюкоза 5.5, рН 7.4. Адвентициалната тъкан беше внимателно отстранена. Три милиметрови пръстени бяха монтирани в вани за органи, пълни с гореописания буфер (37 ° C; непрекъснато аерирани с 95% O2 и 5% CO2) и бяха прикрепени към преобразувател на сила и беше записано изометрично напрежение. Сегментите на съда постепенно се разтягат в продължение на 60 минути до напрежение в покой от 10 mN, което се поддържа през целия експеримент, и се оставя да се уравновесят за още 30 минути. Лекарствата бяха добавени в нарастващи концентрации, за да се получат кумулативни криви на концентрация-отговор: KCl 20 и 40 mmol/L, фенилефрин 1 nmol/L до 10 μmol/L, карбахол 10 nmol/L до 100 μmol/L и нитроглицерин 1 nmol/L до 10 μmol/L. Концентрацията на лекарството се повишава, когато вазоконстрикцията или вазорелаксацията приключат. Лекарствата се измиват преди да се добави следващото вещество.
Оцветяване на атеросклеротични лезии и морфометричен анализ
Статистически анализ
Данните са представени като средно ± SEM. Статистическият анализ беше извършен с ANOVA тест, последван от post hoc анализ на Neuman-Keuls. P -/-, ApoE -/- и ApoE -/- -AT1 -/- мишките бяха хранени с високомаслена диета, съдържаща 1,25% холестерол в продължение на 7 седмици. Таблица 1 показва получените плазмени концентрации на липиди в кръвта. За разлика от дивия тип и AT1 -/- мишки, общите холестероли, HDL холестерол и LDL холестерол в плазмата са значително повишени при ApoE -/- и ApoE -/- -AT1 -/- животни. Няма значителни разлики между ApoE -/- и ApoE -/- - AT1 -/- мишки.
ТАБЛИЦА 1. Липиди в кръвта, кръвно налягане и активност на ренин
SBP, сърдечна честота и активност на плазмен ренин
SBP и сърдечната честота са измерени във всички животински групи чрез измерване на опашката. Таблица 1 показва нивата на SBP и сърдечните честоти след 7 седмично лечение с диета с висок холестерол. SBP е значително по-нисък при AT1 -/- и ApoE -/- -AT1 -/- мишки, отколкото при див тип и ApoE -/- животни. Няма значителни разлики в сърдечната честота между групите животни. Освен това, активността на ренина в плазмата се определя във всички групи след богата на холестерол диета. Не са открити значителни разлики между див тип, AT1 -/-, ApoE -/- и ApoE -/- -AT1 -/- мишки (Таблица 1).
Формиране на атеросклеротични лезии
Развитието на атеросклеротични лезии се определя количествено след 7 седмици богата на холестерол диета при див тип, AT1 -/-, ApoE -/- и ApoE -/- -AT1 -/- животни с помощта на маслено червени оцветявания, последвани от макроскопски анализ на низходящата гръдна аорта и хистологичен анализ на аортния синус и възходящата аорта. Фигура 1 показва представителни аортни препарати и аортни сечения на всички 4 животински групи. Мишки от див тип и AT1 -/- не показват признаци на атеросклероза в нито една от изследваните части на аортата. За разлика от това, мишките ApoE -/- показват силна атеросклероза в аортния синус и възходящата аорта и в по-малка степен в низходящата гръдна аорта. При мишки ApoE -/- -AT1 -/-, съвпадащи с възрастта, образуването на атеросклеротични лезии почти липсваше във всички изследвани части на аортата. Количественият анализ на образуването на атеросклеротични лезии при мишки ApoE -/- и ApoE -/- -AT1 -/- е показан в таблица 2. 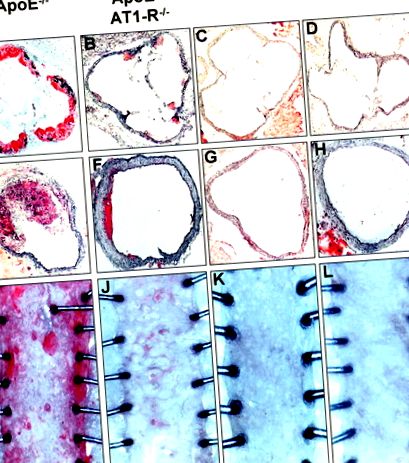
Фигура 1. Образуване на атеросклеротична лезия. Образуването на атеросклеротични лезии беше определено след 7 седмично лечение с богата на холестерол диета в аортен синус (A макар D) и възходяща аорта (E до H; хистологичен анализ) и в низходяща гръдна аорта (I до L; макроскопски анализ) чрез маслено червено O оцветяване. Представителни секции от див тип (WT), AT1 -/-, ApoE -/- и ApoE -/- -AT1 -/- двойно нокаутиращи мишки. AT1-R -/- означава AT1 -/- мишки.
ТАБЛИЦА 2. Размери на атеросклеротичните лезии
Съдова функция
След лечение с обогатена с холестерол диета, съдовата функция се оценява в изолирани препарати на аортния пръстен. За разлика от мишки от див тип и AT1 -/-, ендотел-зависимата вазодилатация е значително нарушена при ApoE -/- мишки, както е оценено чрез стимулация с карбахол (Фигура 2А). Мишките ApoE -/- -AT1 -/- не показват развитие на ендотелна дисфункция, а ендотел-зависимата вазодилатация е подобна на дивия тип и AT1 -/- животните (Фигура 2А). Независимата от ендотел вазорелаксация, индуцирана от нитроглицерин, е сходна във всички групи (Фигура 2В). Освен това вазоконстрикцията, предизвикана от фенилефрин или KCl, е сходна във всички групи (данните не са показани).
Фигура 2. Съдова функция. След 7-седмично лечение с богата на холестерол диета бяха изолирани аортни сегменти от WT, AT1 -/-, ApoE -/- и ApoE -/- -AT1 -/- мишки и тяхната функционална ефективност беше оценена в експерименти с органна камера . Показани са ендотелийно зависима вазодилатация, индуцирана от карбахол (А) и независима от ендотел вазорелаксация, индуцирана от нитроглицерин (В), изразени като процент от максималната индуцирана от фенилефрин вазоконстрикция. Средно ± SEM, n = 6 на група. *P -/-. WT показва див тип.
Съдов оксидативен стрес
Съдовото освобождаване на супероксидни радикали се измерва чрез L-012 хемилуминесцентни анализи в интактни аортни сегменти от див тип, AT1 -/-, ApoE -/- и ApoE -/- -AT1 -/- мишки. Фигура 3 показва, че съдовото освобождаване на супероксид е увеличено 2 пъти при ApoE -/- - мишки в сравнение с диви животни (195 ± 44% от див тип; P -/- -AT1 -/- мишки (96 ± 27% от див тип; P -/-).
Фигура 3. Съдово производство на супероксид. След 7 седмици лечение с богата на холестерол диета, аортите от див тип (WT), AT1 -/-, ApoE -/- и ApoE -/- -AT1 -/- мишки бяха изрязани и производството на съдов супероксид в непокътнато състояние аортните сегменти се определя количествено чрез тестове за хемилуминесценция L-012. Освобождаването на супероксид се изразява като относителна хемилуминесценция на милиграм аортна тъкан. Средно ± SEM, n = 8 на група. *P -/- .
Ефект от лечението с хидралазин или ирбесартан върху формирането на атеросклеротични лезии и съдовата функция
За да се изясни влиянието на намаляването на кръвното налягане върху формирането на атеросклеротични лезии и съдовата функция, мъжките 12-седмични мишки ApoE -/- са лекувани или с вазодилататор хидралазин, или антагонист на AT1 рецептор ирбесартан паралелно с високо съдържание на мазнини, холестерол- богата диета за 7 седмици. И двете лечения доведоха до значително намаляване на SBP до същото ниво като при мишките с двойно избиване (ApoE -/- -AT1 -/-, 83 ± 2 mm Hg; ApoE -/- плюс хидралазин, 87 ± 2 mm Hg; ApoE -/- плюс ирбесартан, 86 ± 3 mm Hg; всички P -/-). Въпреки значителното намаляване на SBP, не се наблюдава ефект върху образуването на атеросклеротични лезии при третирани с хидралазин ApoE -/- мишки в сравнение с третирани с носител ApoE -/- животни (Фигури 4А и 4С; Таблица 2). За разлика от това, лечението с ирбесартан води до значително инхибиране на образуването на атеросклеротични лезии при мишки ApoE -/- (Фигури 4В и 4D; Таблица 2). Нещо повече, лечението с антагониста на АТ1 рецептора доведе до значително подобрение на ендотелиозависимата вазодилатация в препаратите на аортния пръстен, докато ендотелната функция беше нарушена при третирани с хидралазин мишки ApoE -/-, идентични с третираните с носител ApoE -/- животни (Фигура 4Е). И накрая, лечението с хидралазин няма ефект върху производството на съдов супероксид при мишки ApoE -/- (200 ± 38% от див тип; P -/-).
Фигура 4. Образуване на атеросклеротични лезии и съдова функция при ApoE -/- мишки, лекувани с хидралазин или ирбесартан. АпоЕ -/- мишките са лекувани в продължение на 7 седмици с богата на холестерол диета и с носител, хидралазин или ирбесартан. A до D, образуване на атеросклеротична лезия в аортния синус (A, B) и възходяща аорта (C, D), както се определя чрез оцветяване с маслено червено O (хистологичен анализ). Представителни секции на лекувани с хидралазин и ирбесартан ApoE -/- мишки. E, зависима от ендотел вазодилатация на препарати на аортния пръстен, индуцирана от карбахол, изразена като процент от максималната индуцирана от фенилефрин вазоконстрикция. Средно ± SEM, n = 8 на група. *P -/-. Irb означава ирбесартан; Hy, хидралазин.
Дискусия
Хиперхолестеролемията, която е свързана с ускорена атеросклероза, води до свръхекспресия на AT1 рецептори във васкулатурата, както се демонстрира в експерименти с клетъчни култури, животински модели и хора. 10-12 Важно е, че лечението на хиперхолестеролемични зайци, ApoE -/- мишки и нечовешки примати с антагонисти на АТ1 рецептора намалява съдовия оксидативен стрес и възпаление, подобрява ендотелната функция и намалява прогресията на атеросклерозата, въпреки че нивата на кръвното налягане и плазмените липиди остават непроменени . 13,16–18 Подобряването на ендотелната функция от антагонистите на АТ1 рецептора също е потвърдено при хора с хиперхолестеролемия. 19.
Както се очакваше, кръвното налягане беше значително по-ниско при ApoE -/- -AT1 -/- мишки, отколкото при ApoE -/- мишки, докато сърдечната честота беше сходна и в двете групи. За да се изключи значително влияние на намалените нива на кръвното налягане върху развитието на атеросклероза, мишките ApoE -/- бяха третирани с вазодилататор хидралазин. Въпреки че кръвното налягане беше понижено до същото ниво като при мишките с двойно нокаутиране, образуването на атеросклеротични лезии и ендотелната функция бяха идентични като при мишките ApoE -/- лекувани с носител, което показва, че наблюдаваното намаляване на кръвното налягане няма влияние върху атеросклеротичните процес в модела, използван в настоящото изследване. За разлика от това, лечението с ирбесартан на ApoE -/- животни води до подобно намаляване на кръвното налягане, но до значително инхибиране на атеросклерозата и ендотелната дисфункция. Тези резултати демонстрират специфичната значимост на AT1 рецепторната блокада, независимо от понижаването на кръвното налягане.
Според констатациите на представеното проучване, AT1 рецепторът по същество участва в атеросклероза, свързана с хиперхолестеролемия при мишки. Следователно намаленото активиране на AT1 рецептора оказва дълбока атеропротекция. Необходими са допълнителни проучвания, за да се изследва ролята на AT1 рецепторите в атеросклерозата, индуцирана от други рискови фактори като диабет или дефицит на естроген. И накрая, ако бъдат потвърдени при хора, настоящите резултати предполагат, че антагонистите на AT1 рецепторите могат да представляват много обещаваща възможност за атеропротективно лечение.
Това проучване беше подкрепено от Deutsche Forschungsgemeinschaft (DFG), от неограничен изследователски грант от Boehringer Ingelheim и от Европейската мрежа за съдова геномика, мрежа за върхови постижения, предоставена от Европейската комисия (договор № LSHM-CT-2003-503254) . Отличната техническа помощ на Sybille Richter е високо оценена.
- IJMS Безплатен еритропоетин миметичен пептид (pHBSP) коригира ендотелната дисфункция в
- Взаимозависимости между избрани провъзпалителни маркери на ендотелната дисфункция, C-пептид,
- Значение на различните степени на коремно затлъстяване на нивото на тестостерон, еректилна дисфункция,
- Хаплотипен анализ на генетични варианти на ендотелната азотна оксид синтаза (NOS3) и метаболизъм
- Значение на различните степени на коремно затлъстяване на нивото на тестостерон, еректилна дисфункция,
