Икуко Мохри
От Катедрата за психично здраве и изследване на въздействието върху околната среда, * Център за молекулярни изследвания за психично развитие на децата и Катедра по развитие на медицината (педиатрия), Osaka University Graduate School of Medicine, Osaka; и Катедрата по молекулярна поведенческа биология, Институт по биология на Осака, Осака, Япония
Косуке Аритаке
От Катедрата за психично здраве и изследване на въздействието върху околната среда, * Център за молекулярни изследвания за психично развитие на децата и Катедра по развитие на медицината (педиатрия), Osaka University Graduate School of Medicine, Osaka; и Катедрата по молекулярна поведенческа биология, Институт по биология на Осака, Осака, Япония
Хидетоши Танигучи
От Катедрата за психично здраве и изследване на въздействието върху околната среда, * Център за молекулярни изследвания за психично развитие на децата и Департамент по развитие на медицината (педиатрия), Osaka University Graduate School of Medicine, Osaka; и Катедрата по молекулярна поведенческа биология, ‡ Osaka Bioscience Institute, Osaka, Япония
Йо Сато
От Катедрата за психично здраве и изследване на въздействието върху околната среда, * Център за молекулярни изследвания за психично развитие на децата и Катедра по развитие на медицината (педиатрия), Osaka University Graduate School of Medicine, Osaka; и Катедрата по молекулярна поведенческа биология, Институт по биология на Осака, Осака, Япония
Шиня Камаучи
От Катедрата за психично здраве и изследване на въздействието върху околната среда, * Център за молекулярни изследвания за психично развитие на децата и Катедра по развитие на медицината (педиатрия), Osaka University Graduate School of Medicine, Osaka; и Катедрата по молекулярна поведенческа биология, ‡ Osaka Bioscience Institute, Osaka, Япония
Нанае Нагата
От Катедрата за психично здраве и изследване на въздействието върху околната среда, * Център за молекулярни изследвания за психично развитие на децата и Катедра по развитие на медицината (педиатрия), Osaka University Graduate School of Medicine, Osaka; и Катедрата по молекулярна поведенческа биология, Институт по биология на Осака, Осака, Япония
Тошихико Маруяма
От Катедрата за психично здраве и изследване на въздействието върху околната среда, * Център за молекулярни изследвания за психично развитие на децата и Катедра по развитие на медицината (педиатрия), Osaka University Graduate School of Medicine, Osaka; и Катедрата по молекулярна поведенческа биология, Институт по биология на Осака, Осака, Япония
Масако Таниике
От Катедрата за психично здраве и изследване на въздействието върху околната среда, * Център за молекулярни изследвания за психично развитие на децата и Департамент по развитие на медицината (педиатрия), Osaka University Graduate School of Medicine, Osaka; и Катедрата по молекулярна поведенческа биология, Институт по биология на Осака, Осака, Япония
Йошихиро Ураде
От Катедрата за психично здраве и изследване на въздействието върху околната среда, * Център за молекулярни изследвания за психично развитие на децата и Катедра по развитие на медицината (педиатрия), Osaka University Graduate School of Medicine, Osaka; и Катедрата по молекулярна поведенческа биология, Институт по биология на Осака, Осака, Япония
Резюме
Мускулната дистрофия на Дюшен (DMD) е един от най-често срещаните видове мускулна дистрофия, засягащ приблизително 1 от 3500 момчета. 1 Прогресивната мускулна дистрофия при DMD е причинена от мембранната уязвимост, 2 която е резултат от дефект в мускулния протеин дистрофин, 3, 4, но точната патофизиология на прогресията на заболяването не е известна. Все още няма пълно излекуване за тази катастрофална болест, макар че трансферът на гени е опитен широко в модели на бозайници. Глюкокортикоидите 5, 6 и техните аналози 7 са ефективни за потискане на болестта само до известна степен. При DMD тези стероиди намаляват инфилтрацията на възпалителни клетки в мускула 8 и регулират надолу експресията на гени, участващи в имунния отговор. 9 Тези данни предполагат, че възпалението може да играе роля в развитието на болестта.
Материали и методи
Всички експерименти с животни са извършени в съответствие с японския закон за защита на експериментални животни и в съответствие с разпоредбите, издадени от Националния здравен институт и Дружеството за неврология. Използвахме щам на мишка C57BL/6 за модел на мускулна некроза, предизвикан от BPVC. Човешки HPGDS (hHPGDS) -TG мишки се генерират на FVB фон, както е описано по-горе. 17 мишки от див тип от щама FVB бяха използвани като контроли за експериментите с мишки hHPGDS-TG.
Мишките mdx (C57BL/10 ScSn, лаборатории JAX) бяха щедър подарък от д-р Shin'ichi Takeda (отдел по молекулярна терапия, Национален институт по неврология, Национален център по неврология и психиатрия, Кодайра, Токио, Япония) и мутацията се поддържа чрез кръстосване.
Модел на мишката, индуциран от BPVC
Това проучване е проведено със 7-седмични мъжки мишки, както е описано по-горе. 16, 18 Под дълбока анестезия, 0,05 ml 0,1% BPVC се инжектира в открития четириглав мускул под пряко зрение. Като контрола, квадрицепсните мускули на мишките получават 0,05 ml стерилен физиологичен разтвор по същия начин.
Мишките в групата на BPVC бяха разпределени на случаен принцип в две подгрупи и третирани по двойно-сляп начин с носител (0,5% метил целулоза, n = 8) или инхибитор на HPGDS (HQL-79; 30 mg/kg/ден в 0,5% метил целулоза, n = 10) 19 перорално, 1 час преди и на всеки 24 часа, до 7 дни след инжектирането на BPVC. В случай на лечение със специфичен антагонист за DP1 (BW A868C; Cayman, Ann Arbor, MI) 20 или DP2 (Ramatroban; Cayman), 21 мишки са инжектирани подкожно 1 час преди и на всеки 24 часа до 7 дни след инжектирането на BPVC. BW A868C и Ramatroban са химични съединения, които съответно се свързват с DP1 20 и DP2 21 рецепторите за PGD2 и инхибират тяхната сигнална трансдукция в експресиращите места.
Моделът на мишката mdx
Като контрола бяха използвани мишки от див тип C57BL/10 ScSn. Мъжки mdx мишки на 4-седмична възраст бяха разпределени на случаен принцип в 2 групи и третирани по двойно-сляп начин с носител (0,5% метил целулоза) или инхибитор на HPGDS (HQL-79; 30 mg/kg/ден в 0,5% метил целулоза ) перорално в продължение на 10 дни.
Мускулна патология и имуноцитохимия
Премахнатите мускули се потапят за една нощ при 4 ° С в 4% параформалдехид в 0,1 M/L натриев фосфат (рН 7,4) и се обработват в парафинови блокове. Както парафиновите, така и замразените секции (с дебелина 5 μm) са монтирани върху предметни стъкла с 3-аминопропилтриетоксисилан. Някои серийни парафинови секции бяха рутинно оцветявани с H&E, а други бяха имунооцветени за HPGDS; и замразените секции бяха имунооцветени за DP1, както беше описано по-горе. 22, 23
Анализ на Western Blot
Мускулът се хомогенизира в 3 обема PBS спрямо теглото. След центрофугиране при 16 000 х g в продължение на 20 минути, получената супернатанта се използва за Western blotting на HPGDS. Протеинът (10 μg/лента) се разделя чрез SDS-полиакриламиден гел електрофореза, прехвърля се в Immobilon PVDF мембрана (Millipore, Bedford, MA) и се имунооцветява, както е описано по-рано. 22.
Количествена PCR
Общата РНК се екстрахира от миши квадрицепс чрез метода гуанидиний тиоцианат-фенол-хлороформ, използвайки ISOGEN (Nippon Gene, Tokyo, Japan). Количествените PCR анализи на съдържанието на иРНК за HPGDS, DP1, DP2, CD11b (повърхностен антиген, експресиран върху макрофаги и гранулоцити 24, 25), фактор на туморна некроза (TNF) α, трансформиращ растежен фактор (TGF) β1 и глицералдехид- 3-фосфат дехидрогеназата се извършва, като се използва системата за усилване и детектиране LightCycler (Roche Diagnostics, Indianapolis, IN), както е описано по-долу. Използваните специфични за последователността праймери са както следва: HPGDS праймер, 5′-GAATAGAACAAGCTGACTGGC-3 ′; HPGDS обратен грунд, 5′-AGCCAAATCTGTGTTTTTGG-3 ′; DP1 напред грунд, 5′-TTTGGGAAGTTCGTGCAGTACT-3 ′; DP1 обратен грунд, 5′-GCCATGAGGCTGGAGTAGA-3 ′; DP2 напред грунд, 5′-TGGCCTTCTTCAACAGCGT-3 ′; DP2 обратен грунд, 5′-ACGCAGTTGGGGAATTCG-3 ′; CD11b напред грунд, 5′-CAGGGACAACCACACCTCTTG-3 ′; CD11b обратен грунд, 5′-GCAGCGTCATACCAGCACAC-3 ′; TNFα праймер, 5′-AGTGACAAGCCTGTAGCCCACG-3 ′; TNFα обратен грунд, 5′-TTTCTCCTGGTATGAGATAGC-3 ′; TGFβ1 напред грунд, 5′-TGCGCTTGCAGAGATTAAAA-3 ′; TGFβ1 обратен грунд, 5′-AGCCCGAAGCGGACTACTAT-3 ′; глицералдехид-3-фосфат дехидрогеназа праймер, 5′-TGAACGGGAAGCTCACTGG-3 ′; и глицералдехид-3-фосфат дехидрогеназа обратен праймер, 5′-TCCACCACCCTGTTGCT-3 ′.
Всички нива на иРНК са показани след нормализиране с нивото на иРНК на глицералдехид-3-фосфат дехидрогеназа. Конструкциите, използвани за създаване на стандартна крива, бяха направени чрез клониране на всеки усилен фрагмент в HindIII мястото на pGEM вектор (Promega, Madison, WI). Всички PCR продукти се визуализират под UV светлина след електрофореза в агарозен гел, съдържащ етидиев бромид и впоследствие се секвенират, за да се провери дали е настъпила само специфичната полимеризация от предвидената иРНК.
Оценка на обема на некротичния мускул чрез инжектиране на синьо багрило Evans
Боята Evans Blue (10 mg/ml PBS, Sigma, St. Louis, MO) се инжектира интравенозно в опашната вена на мишки (50 μl на 10 g телесно тегло), както е описано по-горе. 26, 27 Животните бяха умъртвени 4 часа след инжектирането. Мускулите бяха отстранени, замразени върху сух лед и лиофилизирани. Синьото багрило на Evans в мускулите се екстрахира от формамид (Nakalai Tesque, Киото, Япония) при 60 ° С за една нощ. Количеството синьо багрило на Evans в екстракта се определя количествено с абсорбционен спектрометър при 630 nm и с външни стандарти, вариращи от 10 до 1000 ng/ml.
Анализ на компютърна томография
Обемът на некротичния мускул се визуализира рентгенографски чрез използване на рентгенова компютърна томография LaTheta (CT, ALOKA, Токио, Япония) съгласно протокола на производителя. Анестезираните мишки бяха сканирани в гръбначната позиция 15 минути по време на интравенозна инфузия през дисталната вена на опашката на нейоногенна контрастна среда (Iopamiron, Bayer, Осака, Япония) при скорост на инфузия 1,2 ml/hr.
Данните за CT сканиране на изображения от всяка мишка бяха анализирани чрез софтуер за визуализация (ALOKA), който показваше данните като 2D аксиални изображения в напречно сечение. Потвърдихме линейна корелация на некротичния обем между рентгеновия CT анализ и оценката на обема на некротичния мускул, направена чрез инжектиране на синьо багрило Evans (данните не са показани). Триизмерните данни са конструирани от нарязани CT изображения чрез сумиране на тези изображения по оста Z с помощта на софтуера VGStudio MAX (Volume Graphics, Heidelbelg, Германия).
Измерване на метаболит на PGD2 в урината
11,15-Диоксо-9-хидрокси-2,3,4,5-тетранорпростан-1,20-диоена киселина (тетранор-PGDM) е идентифицирана чрез масспектрометрия като метаболит на инфузионен PGD2, който се открива в урината на мишка и човек . 28 Ежедневно се събира урина от мишки от див тип и мишки mdx и количеството тетранор-PGDM в него се определя чрез използване на течна хроматография-тандемна масспектрометрия, както е описано по-горе. 28 Концентрацията на креатинин се измерва с пробен комплект (Wako Pure Chemical, Осака, Япония).
Тест за здравина на сцепление
Силата на сцеплението се оценява с измервател на силата на сцепление, състоящ се от хоризонтална мрежа на предния крайник (Brain Science Idea, Осака, Япония). Записани са пет успешни измервания на силата на предните крайници в рамките на 2 минути. Средните стойности за всеки ден бяха използвани за последващ анализ. Измерванията на силата на сцеплението бяха събрани в сутрешните часове.
Статистически анализ
Стойностите бяха изразени като средната стойност ± SE. Данните бяха анализирани с помощта на двустранен t-тест и стойности P + имунореактивност, разпознати в некротичните влакна при индуцирана от BPVC мускулна некроза
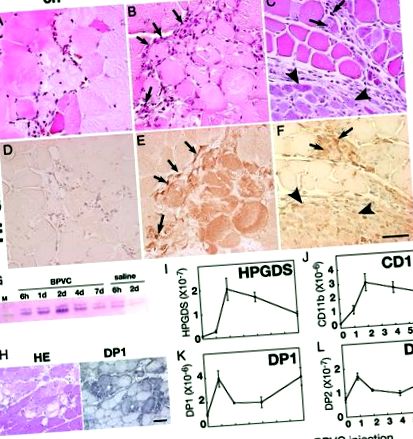
A – H: Експресия на HPGDS в некротични мускулни влакна. Резултати от оцветяване с HE (A – C) и HPGDS имунооцветяване (D – F) в 6 часа (A, D), 2 дни (БЪДА) и 4 дни (C, F) след инжектиране на BPVC. Мащабна лента = 50 μm. Стрелки и върхове на стрели посочват HPGDS-позитивни инфилтриращи макрофаги и регенериращи мускулни влакна, съответно. G: Уестърн блотинг за HPGDS. З: Експресия на DP1 в некротични мускулни влакна. Вляво, HE оцветяване; вдясно, DP1 имуноцитохимия. Мащабна лента = 50 μm. I Л: Количествена RT-PCR за иРНК на HPGDS (Аз), CD11b (J), DP1 (К) и DP2 (L). n = 4. Данните са средната стойност ± SE.
HPGDS-свръхекспресия, обострена мускулна некроза
Ние предположихме, че PGD2, произведен от HPGDS при мускулно увреждане, влошава мускулната некроза в модела на мускулна некроза, предизвикан от BPVC. За да оценим тази възможност, сравнихме BPVC-индуцираната мускулна некроза между мишки от див тип и човешки HPGDS свръхекспресиращи трансгенни (hHPGDS-TG) мишки 17 от същия генетичен произход (щам FVB), които по същество изразяват голямо количество човешки HPGDS в допълнение към ендогенния HPGDS на мишка (Фигура 2, А и В). Както е показано на Фигура 2А, Н оцветяването разкрива, че масивна мускулна некроза е настъпила на 2-ия ден при BPVC-инжектирани hHPGDS-TG мишки; и имаше мускулни пространства в мускулите, което предполага силен оток. В сравнение с тази в контролните мускули, мускулната некроза при мишките hHPGDS-TG е преувеличена и удължена. Както е показано на Фигура 2В, относителното водно съдържание е значително по-високо в hHPGDS-TG миши мускул, отколкото в дивия тип на 2 дни след инжектирането на BPVC. Тези резултати показват, че свръхпродукцията на PGD2 увеличава мускулната некроза и оток.
Фигури 3D -G представляват реконструираните 3D изображения на подобрена CT на мишки, инжектирани с BPVC, на ден 4 след лечение с носител, HQL-79, BW A868C или съответно Ramatroban, при които е показан увреденият мускул, съдържащ нейоногенната контрастна среда в червено. Изчисленият некротичен мускулен обем на ден 4 е значително намален при мишки, лекувани с HQL-79, но не и при тези, на които е даден DP1 или DP2 антагонист (Фигура 3Н). Тези резултати показват, че инхибиторът на HPGDS е по-ефективен за намаляване на мускулната некроза, отколкото самостоятелно DP1 или DP2 антагонист и че сигнализирането на PGD2 упражнява своята функция както чрез DP1, така и чрез DP2 рецепторите при мускулна некроза.
HPGDS-имунореактивни влакна, разпознати във фокусите на групова некроза в mdx мускулна мускулатура
Не е ясно как некротичните мускулни влакна изразяват HPGDS имунореактивност. Съобщава се обаче, че напоследък се наблюдава подобен на апоптоза феномен по време на мускулна некроза. 31, 32 Mizutani и Ohno 33 също съобщават, че каспаза-3, която е свързана с апоптоза, медиирана от митохондриите, се изразява в некротични мускулни влакна. Освен това, Honda et al 34 съобщават, че експресията на гена каспаза-12 участва в стресовия път на ендоплазматичния ретикулум и че гените Bax, каспаза-9 и каспаза-3 участват в пътя на митохондриалния стрес в мускула mdx masseter . Тези данни предполагат, че апоптозата възниква по време на дегенерация на mdx мускул. От тези редове на доказателства е възможно експресията на HPGDS да се индуцира в мускулните влакна по време на апоптоза.
Терапевтични последици от инхибиторите на HPGDS при мускулна некроза
В това проучване демонстрирахме, че HQL-79, инхибитор на HPGDS, потиска производството на PGD2 и подобрява мускулната сила в mdx мишката. Съобщава се, че приложението на кортикостероиди при пациенти с DMD води до клинично подобрение. 5 Кортикостероидите могат да причинят понижаване на протеазите и/или нетно повишаване на съдържанието на протеин. 39 Освен това, благоприятните ефекти на кортикостероида могат да се дължат на потискане на цитозолната фосфолипаза А2 и циклооксигеназата, които водят до цялостното инхибиране на синтеза на PG. 40 Въпреки това, продължителното приложение на кортикостероиди води до сериозни странични ефекти. Освен това кортикостероидите инхибират производството на цитопротективни простаноиди, включително простагландин Е2, 41, който е важен за заздравяването и мускулната регенерация след нараняване. От тези редове доказателства теоретично е изгодно да се лекува мускулна некроза, като се фокусира специално върху производството и сигнализирането на PGD2.
Shen et al 42 споменават, че решението да се използват нестероидни противовъзпалителни лекарства, които са инхибитори на циклооксигеназа, за лечение на мускулни наранявания, изисква критична оценка, тъй като нестероидните противовъзпалителни лекарства могат да влошат заздравяването на мускулите, като инхибират сливането на миогенни предшественици. В това проучване установихме, че HPGDS се изразява и в регенериращия мускул в ранната фаза на регенерация, въпреки че ролята на HPGDS в мускулната регенерация остава да бъде изяснена.
Молекулните и ензимните свойства на HPGDS са добре характеризирани от нас и от други групи. 43 Кристалната структура на HPGDS вече е определена. 43 Кристалните структури на HPGDS от плъх, 43 HPGDS от човека, 44 и комплексът от човешки HPGDS и HQL-79 19 вече са определени. Въз основа на кристалографската структура на човешкия комплекс HPGDS-HQL-79, нови HPGDS инхибитори се проектират от няколко фармацевтични компании, за да бъдат по-мощни и селективни към HPGDS. Както демонстрирахме тук, тъй като PGD2 увеличи мускулната некроза при BPVC-индуцирана некроза и mdx мишки, потискането на производството на PGD2 от HPGDS инхибитори може да бъде от полза за лечението на DMD. Освен това, тъй като по-рано съобщихме, че експресията на HPGDS се открива в мускулите на пациенти с полимиозит, 11 такива HPGDS инхибитори могат да бъдат предвидени да бъдат ефективни и за лечение на полимиозит.
Благодарности
Благодарим на г-жа Шигеко Мацумото, Институт по биология на Осака, за провеждането на имуноцитохимията; Г-жа Юмико Хошикава и Масуми Саката, Институт по биология в Осака, за техническа помощ; Д-р Хироши Ямамото, университет в Осака, за осигуряване на mdx мишки; Д-р Tenjo Konishi и д-р Norio Nakamura, Doshisha Women’s College of Liberal Arts, за подпомагане на измерването на тетранор-PGDM от LC-MS/MS; и г-н Masaki Kobayashi и г-н Hiroshi Shigeta, ALOKA Co. Ltd., за CT анализи.
- Инхибиране на поли (ADP-рибоза) полимераза, повишено липидно натрупване чрез модулация SREBP1 -
- Как е възможно кльощавите крака по-мощни от мускулестите крака Cyclingnews Forum
- Инхибиране на корозията на въглеродна стомана в среда с H2S, изследвано чрез метод на импедансна спектроскопия -
- Проблеми със сърцето - Новини за мускулната дистрофия
- Диетите с ниско съдържание на въглехидрати могат да причинят лош дъх