Изследователска лаборатория по биохимична патология, Институт по клинична медицина, Орхуски университет, Орхус, Дания
Кореспонденция
Доцент Нилс Йесен, Институт по клинична медицина, Изследователска лаборатория по биохимична патология, Университетска болница в Орхус, Nørrebrogade 44, DK ‐ 8000 Aarhus C, Дания.
Тел: +45 7846 2141
Факс: +45 7846 2150
Фондация Novo Nordisk Foundation за основни метаболитни изследвания, Факултет по здравеопазване и медицински науки, Университет в Копенхаген, Копенхаген, Дания
Катедра по ядрена медицина и PET център, Университетска болница в Орхус, Орхус, Дания
Изследователска лаборатория по биохимична патология, Институт по клинична медицина, Университет в Орхус, Орхус, Дания
Катедра по екология и управление на природните ресурси, Норвежки университет за науки за живота, Аас, Норвегия
Катедра по горско стопанство и управление на дивата природа, Факултет по приложна екология и селскостопански науки, Университетски колеж Hedmark, Campus Evenstad, Koppang, Норвегия
Здравен факултет, Катедра по кардиология, Университет Örebro, Örebro, Швеция
Изследователска лаборатория по биохимична патология, Институт по клинична медицина, Университет в Орхус, Орхус, Дания
Кореспонденция
Доцент Нилс Йесен, Институт по клинична медицина, Изследователска лаборатория по биохимична патология, Университетска болница в Орхус, Nørrebrogade 44, DK ‐ 8000 Aarhus C, Дания.
Тел: +45 7846 2141
Факс: +45 7846 2150
Фондация Novo Nordisk Foundation за основни метаболитни изследвания, Факултет по здравеопазване и медицински науки, Университет в Копенхаген, Копенхаген, Дания
Катедра по ядрена медицина и PET център, Университетска болница в Орхус, Орхус, Дания
Изследователска лаборатория по биохимична патология, Институт по клинична медицина, Орхуски университет, Орхус, Дания
Катедра по екология и управление на природните ресурси, Норвежки университет за науки за живота, Аас, Норвегия
Катедра по горско стопанство и управление на дивата природа, Факултет по приложна екология и селскостопански науки, Университетски колеж Hedmark, Campus Evenstad, Koppang, Норвегия
Здравен факултет, Катедра по кардиология, Университет Örebro, Örebro, Швеция
Благодарим на Свен Брунберг за отлична организация и съдействие по време на работа на терен. Това проучване беше подкрепено от безвъзмездна финансова помощ от Фондация Лундбек (грант № R126‐2012‐12408 на OF) и Фондация AP Møller за развитие на медицинската наука в Ню Джърси. Изследователският проект за скандинавска кафява мечка се финансира от Шведската агенция за опазване на околната среда, Норвежката агенция за околната среда, Шведската асоциация за лов и управление на дивата природа, WWF Швеция и Изследователския съвет на Норвегия.
Резюме
Въведение
Целта на това проучване е да се изследва експресията на протеини, свързани с липидни капчици, в мастната тъкан от свободно кафяви мечки по време на зимен сън през зимата и през активния им период през лятото. Основната хипотеза е, че кафявите мечки потискат липолизата през лятото, когато наддават на тегло чрез повишена експресия на отрицателни регулатори на активността на ATGL.
Материали и методи
Процедура за улавяне на животни и биопсия
Кръвта и подкожната мастна тъкан са събрани от обездвижени свободно кафяви мечки (снабдени с GPS нашийници) по време на хибернация през зимата (началото на февруари) и от същите мечки през активния период в началото на лятото (края на юни/началото на юли) в Даларна, Швеция. Всички улавяния са одобрени от Шведския етичен комитет за изследване на животните (C212/9 и C47/9) и Шведската агенция за опазване на околната среда и следват общите принципи на политиката на общественото здравеопазване за хуманни грижи и използване на лабораторни животни, приложими за дивата природа. Вземането на проби е направено от скандинавския изследователски проект за кафява мечка (http://www.bearproject.info/) съгласно установени протоколи (Arnemo et al. 2012).
Анализ на кръвта
Серумните FFA са анализирани с наличен в търговската мрежа комплект (CV за интрасайнинг 2–4% и CV за интрасайнинг 3–6%, граница на откриване 0,02 mmol/L) (NEFA-HR 2; Wako Chemicals, Richmond, VA).
Хистология
Биопсиите на мастната тъкан бяха фиксирани в 4% формалинов буфер (Cellpath, Newtown, UK) и вградени в парафин. 3 μm секции се нагряват при 60 ° C в продължение на 60 минути, депарафинизират се в Tissue-Clear (Sakura Finetek Europe, Alphan, Холандия) и се рехидратират.
Western blot анализ
100 mg) се хомогенизират в хомогенизатор Precellys 24 (Bertin Technologies, Montigny-le-Bretonneux, Франция) в хипотоничен буфер, съдържащ 20 mmol/L HEPES pH 7,4, 10 mmol/L NaF, 1 mmol/L Na3VO4, 1 mmol/L EDTA, 5% SDS, 50 μg/ml соев трипсинов инхибитор, 4 μg/ml леупептин, 0,1 mmol/L бензамидин, 2 μg/ml Антипаин и 1 μg/mL пепстатин. Суровите хомогенати се инкубират в термомиксер (Eppendorf, Хамбург, Германия) при 37 ° C и 1000 rpm за 1 h, последвано от центрофугиране при 14 000 × ж за 20 минути. Безлипидният инфранант беше аспириран и използван за Western blot анализ.
Протеиновите проби бяха разделени чрез SDS-PAGE (4-12% Bis-Tris гелове, система Criterion XT; Bio-Rad, Hercules, CA) и прехвърлени в поливинилиден флуоридни мембрани в съответствие с инструкциите на производителя. Използвани са следните първични антитела: anti-ATGL, anti-CGI-58 (Abcam, Cambridge, UK), anti-PLIN1, anti-HSL (Cell Signaling, Beverly, MA), anti-CIDE-C (Novus Biologicals, Cambridge, Великобритания) и анти-G0S2, анти-разединяващ протеин 1 (Санта Круз Биотехнология; Санта Круз, Калифорния). Като вторични антитела са използвани конюгирани с хрян пероксидаза магарешки анти-заешки IgG (Amersham, GE-Healthcare, Pittsburgh, PA) и кози антимиши HRP-IgG (Abcam, Cambridge, UK). Протеините се визуализират чрез хемилуминесценция (Pierce Supersignal West Dura, Thermo Scientific, IL) и се определят количествено с образната система ChemiDoc ™ MP (BioRad). Стандартите Precision Plus All Blue за протеини бяха използвани като маркер за молекулно тегло (BioRad). Контролът за натоварване с протеини беше извършен с помощта на технологията Stain-Free (Gurtler et al. 2013) и данните са изразени като съотношение към общото съдържание на протеин в мембраните.
Статистика
Нормалното разпределение беше тествано чрез оценка на QQ-графики и хистограми. Когато е възможно, непараметричните данни се трансформират в нормално разпределение посредством логаритмично преобразуване. Различията в експресията на G0S2 бяха оценени с помощта на точния тест на Fisher. Данните са представени като средно ± SEM, освен ако не е посочено друго. Статистическият анализ беше извършен чрез сравняване на хиберниращи и нехибернационни условия в рамките на една и съща мечка (сдвоени т‐Test) и P
Резултати
Характеристики на животните
Основните характеристики на животните са обобщени в Таблица 1. Мечките натрупват тегло между двата периода на вземане на проби, но увеличението е само гранично значимо (P Таблица 1. Характеристики на животните от пет мечки, уловени през зимата и лятото на 2013 г.
| Мъже/жени | 2/3 | 2/3 |
| Възраст (години) | 3 | 3 |
| Тегло (кг) | 58 (38–64,5) | 53 (40–55) * Теглото се изразява като медиана и диапазон (*P |
- Теглото се изразява като медиана и диапазон (*P
Морфология на мастната тъкан
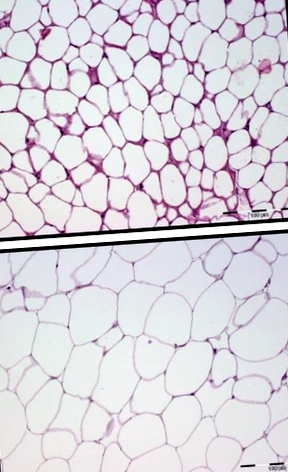
Както е показано на Фигура 1, размерът на адипоцитните клетки е по-малък по време на улавяне през лятото (A), отколкото през зимата (B). Класическите характеристики на бялата мастна тъкан с моновакуоларни клетки, съдържащи голяма липидна капка, заобиколена от слой цитоплазма, могат да бъдат разпознати и през двата сезона. Както се очакваше, не наблюдавахме плюривакуоларни клетки, характерни за кафявата мазнина, в нито една биопсия и не беше открита експресия на разединяващ протеин 1 в биопсиите (данните не са показани).
Кръвни проби
Циркулиращите нива на FFA варират значително при мечките. Средното ниво през лятото е 0,20 mmol/L (± 0,08) и 0,43 mmol/L (± 0,09) през зимата, но разликите не достигат статистическа значимост.
Инхибиторите на липолизата се увеличават в нехибертиращо състояние
Експресията на пролиполитичния кофактор CGI-58 беше през зимата
300% в сравнение с летните нива (P
Експресията на отрицателните регулатори на липолиза, G0S2 и CIDE ‐ C е изобразена на фигури 3A и B. Установихме намалена експресия на CIDE ‐ C (
50%) през зимата (P
Дискусия
Изследвайки невероятната адаптация за хибернация при свободно кафяви мечки, ние открихме доказателства за молекулен механизъм, който може да допринесе за обяснението на парадокса на повишената чувствителност към инсулин по време на наддаване на тегло, който се наблюдава при кафявите мечки, живеещи в плен. Предполагаме, че дълбокото регулиране на инхибиторите на липолизата през лятото инхибира освобождаването на FFA в циркулацията при условия, характеризиращи се с положителен енергиен баланс (Swenson et al. 2007). Инхибиторните ефекти на повишаването на плазмените нива на FFA върху стимулираното от инсулин стимулирано усвояване и окисление на глюкозата са добре установени (Belfort et al. 2005; Gormsen et al. 2007; Hoeg et al. 2011) и динамичното регулиране на липидната капчица покриването на протеини при кафяви мечки добавя доказателства за централната роля на адипоцита в контрола на метаболизма в цялото тяло.
В заключение, свободните кафяви мечки показват мощно регулиране на инхибиторите на липолизата в мастната тъкан през лятото. Това може да служи като основен механизъм за повишената инсулинова чувствителност по време на наддаване на тегло, наблюдавано преди това при мечки, живеещи в плен. Съответно, G0S2 може да служи като цел за модулиране на хомеостазата на глюкозата в цялото тяло.
- Пълнотекстовият AEDG пептид без молекули (Epitalon) стимулира генната експресия и синтеза на протеини
- Затлъстяването и расата променят генната експресия в кожата medRxiv
- Плазмените нива на оментин и генната експресия са намалени при диабет със затлъстяване
- Годишен преглед на храненето на омега-3 мастни киселини и възпаление на мастните тъкани и покафеняване
- Разлики в сайта в метаболизма на подкожната мастна тъкан при човека при затлъстяване SpringerLink