Саша У. Айзенман
1 Rutgers University, School of Environment and Biological Sciences, Department of Biology and Pathology, Cook Campus, 59 Dudley Road, New Brunswick, NJ 08901-8520, USA
Александър Пулев
1 Rutgers University, School of Environmental and Biological Sciences, Department of Plant Biology and Pathology, Cook Campus, 59 Dudley Road, New Brunswick, NJ 08901-8520, USA
Лена Струве
1 Rutgers University, School of Environmental and Biological Sciences, Department of Plant Biology and Pathology, Cook Campus, 59 Dudley Road, New Brunswick, NJ 08901-8520, USA
2 Rutgers University, School of Environmental and Biological Sciences, Department of Ecology, Evolution, and Natural Resources, 14 College Farm Road, New Brunswick, NJ 08901, USA
Иля Раскин
1 Rutgers University, School of Environment and Biological Sciences, Department of Biology and Pathology, Cook Campus, 59 Dudley Road, New Brunswick, NJ 08901-8520, USA
Дейвид М. Рибники
1 Rutgers University, School of Environmental and Biological Sciences, Department of Plant Biology and Pathology, Cook Campus, 59 Dudley Road, New Brunswick, NJ 08901-8520, USA
Резюме
Етанолните екстракти от диплоиден Artemisia dracunculus L. (див естрагон) от популации в САЩ и полиплоиден естрагон от различни източници бяха скринирани за антидиабетни съединения давидигенин; сакуранетин; 2 ', 4'-дихидрокси-4-метоксидихидрохалкон; 4,5-ди-О-кофеилхининова киселина; 5-О-кофеоилхинова киселина и 6-деметоксикапиларизин, използвайки LC-MS. Само декаплоидните растения съдържаха всичките шест целеви съединения и бяха единствените растения, които съдържаха давидигенин и 2,4-дихидрокси-4-метоксидихидрохалкон. Тези резултати показват важността на подбора на гермплазма и произхода при изучаване на растенията за лекарствена активност. Разчитането само на „правилния вид“ за последователни лекарствени дейности може да не е достатъчно, тъй като вътревидовите вариации могат да бъдат много значими.
1. Въведение
1.1 Artemisia dracunculus L
Artemisia dracunculus L. (естрагон) има дълга история на човешка употреба и подобно на много други видове от рода Artemisia, естрагонът произвежда широк спектър от фитохимикали, включително монотерпеноиди, сесквитерпеноиди, флавоноиди, кумарини, изокумарини, полиацетилени и алкалоиди [1-7 ]. Уникално ароматният сорт, френски естрагон (Artemisia dracunculus var. Sativa Besser), се използва като кулинарна билка, а див или руски естрагон (Artemisia dracunculus, многобройни сортове) е използван като лекарство в целия си местен ареал (Западна Северна Америка, Азия и Източна Европа) за лечение на голямо разнообразие от заболявания [8-12]. Френският естрагон и руският естрагон се различават драстично по своя мирис и вкус. Френският естрагон е предпочитан заради пикантния си вкус на сладник, който се дължи на високите количества (60-81%) естрагол (метил хавикол, 1-алил-4-метоксибензен) в етеричното му масло, докато в повечето Руски естрагон, естрагола почти липсва [13-21]. Видът се отличава с изобилна полиплоидия с документирани хромозомни цитотипи 2 × -10 × [22]. Френският естрагон е стерилен тетраплоид, който се възпроизвежда клонално, докато руският естрагон е открит на всички плоидни нива.
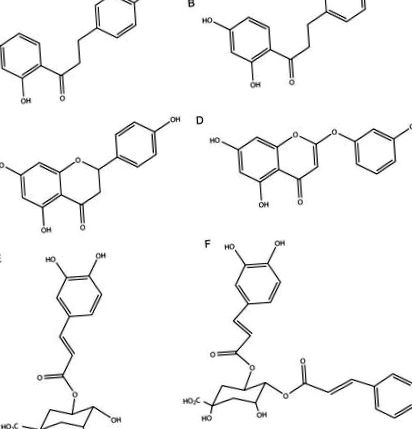
Доказано е, че екстрактите от див естрагон са активни в редица различни пътища, свързани със състоянието на диабет (вж. Раздел 1.4), и биоактивните съединения давидигенин (А), 2 ′, 4′-дихидрокси-4-метоксидихидрохалкон (В), сакуранетин (С), 6-деметоксикапиларизин (D), 5-О-кофеилхининова киселина (Е) и 4,5-ди-О-кофеоилхинова киселина (F) са били предварително изолирани чрез фракциониране, ръководено от биоанализ (Фигура 1) [23-30]. Основният фокус на това проучване беше да се оцени наличието или отсъствието на тези специфични антидиабетни съединения в екстракти от A. dracunculus, приготвени от диплоидни популации, открити в западните части на САЩ, както и клонинги от тези популации и полиплоидни растения (получени от разнообразие от източници), отглеждани в обща градина, за да се премахнат регионалните климатични различия. Анализирани са и два сродни вида.
Структури на биоактивни съединения, скринирани за Artemisia dracunculus: давидигенин (A), 2 ′, 4′-дихидрокси-4-метоксидихидрохалкон (B), сакуранетин (C), 6-деметоксикапиларизин (D), 5-O-кофеоилхинова киселина (E ) и 4,5-ди-О-кофеилхининова киселина (F).
1.2. Вътревидова вариация на фитохимикалите
Различията в химичното производство от специфични индивиди също са документирани при див естрагон. Както френският, така и дивият естрагон са анализирани, за да се определи дали има разлики във фитохимичния им състав. В допълнение към отчетливата разлика в профилите на етерично масло [13,15,16,19,48] (вж. Раздел 1.3), химичните анализи на тези сортове естрагон показват значителни качествени вариации. Установено е също така, че флавоноидите в разновидностите на A. dracunculus проявяват отчетлива сегрегация. Vienne et al. [49] изследва наличието на различни флавоноли в дивия естрагон и френския естрагон и установява, че и двата вида естрагон съдържат кверцетинови гликозиди, но само руският естрагон съдържа патулетин гликозиди. Отбелязана е и химическа вариация между цитотипите. Използвайки екстракти от корени, приготвени от различни цитотипове на A. dracunculus от различни географски източници, Greger [2] проведе анализ на съдържанието на полиацетилен и показа, че диплоидните и декаплоидните цитотипи имат сходни качествени профили, докато хексаплоидните и октоплоидите имат уникални химични съставки. Тази вариация във видовете е особено важна за документиране, тъй като разликите в химичното съдържание на колекциите на A. dracunculus вероятно ще окажат влияние върху биоактивността.
1.3. Регулаторни съображения и безопасност на естрагона
Според Smith et al. (2002) [52], проучванията ясно показват, че превръщането на естрагола в 1′-хидроксиестрагол зависи от дозата и че токсикологичният риск намалява значително при ниски нива на експозиция. Те цитират също проучвания на гризачи, които показват, че метаболизмът, метаболитното активиране и ковалентното свързване, свързани с токсичността и канцерогенността на естраголата, са минимални в дозовия диапазон от 1-10 mg/kg телесно тегло, което е приблизително 100–1000 пъти повече от очакваното при човека излагане на тези вещества. Като такива, според тях излагането на метил евгенол и естрагол в резултат на консумацията на храна не представлява значителен риск от рак.
1.4. Artemisia dracunculus и диабет
Диабетът тип 2 е сложно метаболитно разстройство, причиняващо повишени нива на глюкоза в кръвта. Обикновено това е резултат от прогресивно намаляване на инсулиновата активност (инсулинова резистентност) и намалена секреция на инсулин от панкреаса, поради неуспех на β-клетките, произвеждащи инсулин [54,55]. Според Световната здравна организация повече от 220 милиона души по света страдат от диабет и приблизително 1,1 милиона души са починали от него през 2005 г. [56]. Националният център за превенция на хроничните заболявания и насърчаване на здравето съобщава, че 23,6 милиона души или 7,8% от населението на САЩ имат диабет, а при възрастни диабет тип 2 представлява около 90 до 95 процента от всички диагностицирани случаи на диабет [57].
Допълнителни експерименти с фракциониране, ръководени от биоанализ, разкриват, че четири съединения (4,5-ди-О-кофеоилхинова киселина, давидигенин [4,2 ′, 4′-трихидроксидихидрохалкон], 6-деметоксикапиларизин и 2 ′, 4′-дихидрокси-4-метоксидихидрохалкон ), съдържащи се в екстракта от див естрагон, инхибира алдозоредуктазната активност [26]. В клетките излишъкът от глюкоза се превръща в сорбитол от ензима алдоза редуктаза, който след това се натрупва в клетките, причинявайки редица вторични заболявания, свързани със състоянието на диабет. В анализ in vitro, оценяващ биоактивността на фракции, получени от алкохолен екстракт от A. dracunculus, три съединения показват инхибиращи ефекти върху активността на протеин тирозин фосфатаза-1В. Протеиновата тирозин фосфатаза-1В е ключов ензим в инсулиновия сигнален път и действа като отрицателен регулатор, а проучванията показват, че мишките, които нямат протеин тирозин фосфатаза-1В (PTP-1B), имат повишена инсулинова чувствителност. Съединенията с инхибиторен ефект върху активността на PTP-1B са идентифицирани като сакуранетин (4,2 ′, 4′-трихидроксидихидрохалкон), 2 ′, 4′-дихидрокси-4-метоксидихидрохалкон и неговият позиционен изомер 2 ′, 4-дихидрокси-4 ′ -метоксидихидрохалкон [23,60,61].
2. Материали и методи
2.1. Подготовка на растителен материал и екстракт
- Подуване на стомаха срещу мазнини по корема Как се различават Домашни средства за отслабване и получаване на плосък
- Региони на хляба на пшеничен геном D, свързани с вариация в ключовите черти на фотосинтезата и
- Структурни вариации и микрореологични свойства на хомогенен полизахарид от пшеница
- Пенсионирани спортисти, които изглеждат по-различно от премиерите си
- Проучването предполага, че хирургията за отслабване може да освободи токсични съединения от мазнини в кръвта - 2019