Арсун Бекташ
1 клон за транслационна геронтология, Национален институт за стареене, Национални здравни институти, бул. Бейвю 251, Балтимор, MD 21224 САЩ
Пастир Х. Шурман
2 Клон за клинични изследвания, Национален институт по екологични здравни науки, Национални здравни институти, 111 TW д-р Александър, Изследователски триъгълник парк, NC 27709 САЩ
Клаудио Франчески
3 Университет Alma Mater Studiorum в Болоня, Болоня, Италия
4 Лаборатория на системната биология на здравословното стареене и Катедра по приложна математика, Държавен университет Лобачевски, Нижни Новгород, Русия
Луиджи Феручи
1 клон за транслационна геронтология, Национален институт за стареене, Национални здравни институти, бул. Бейвю 251, Балтимор, MD 21224 САЩ
Свързани данни
Резюме
Основен клиничен въпрос, тъй като светът се занимава с пандемията на COVID-19, е какви ще бъдат дългосрочните последици за милиони индивиди, които се възстановяват от свръхвъзпалителното състояние, характеризиращо COVID-19, и по-специално за стотиците хиляди, които са достатъчно болни да се нуждаят от хоспитализация и по-специално от интензивно отделение. Дори когато пандемията бъде окончателно овладяна, преживелите COVID-19 ще се сблъскат ли с преувеличени вътрешни възпалителни процеси, влошаващи се съпътстващи заболявания и повишена податливост към свързани с възрастта заболявания? Подсказки за това какво може да се случи при пациенти след COVID-19 могат да бъдат извлечени от онези, които са се възстановили от други състояния, които водят до подобни свръхвъзпалителни състояния като тежък остър дихателен синдром (SARS), синдром на остри респираторни заболявания (ARDS), синдром на цитокинова буря, и синдром след ICU. Краткосрочните и дългосрочните последици след възстановяване от всяко от тези състояния предполагат, че тези синдроми водят до ускорено състояние на хронично субклинично системно възпаление, което често се наблюдава при стареене (наричано възпаление), водещо до увеличени и влошаващи се възрастови състояния, включително слабост дори при по-млади индивиди.
Заден план
COVID-19, лек до тежък респираторен синдром, който следва инфекция с тежък остър респираторен синдром коронавирус 2 (SARS-CoV-2), е идентифициран за първи път в Ухан, Китай през декември 2019 г. и бързо се превръща в пандемия, която засяга милиони хора, причинявайки значителна смъртност по целия свят. Повечето хора, заразени с ТОРС-CoV-2, развиват грипоподобен, лек клиничен синдром (не-пневмония или лека атипична пневмония) и значителна част (
20%) изискват хоспитализация (диспнея, ниско насищане с кислород), като значителна част от тях води до критично заболяване (дихателна недостатъчност, септичен шок и/или полифункция на органите) и смърт [1, 2].
Докато механизмът, по който само някои индивиди развиват тежка респираторна патология, все още не е напълно изяснен, редица проучвания показват, че пациентите, които са достатъчно болни, за да се наложи хоспитализация, са по-възрастни хора, засегнати от мултиморбидност, включително хипертония, диабет и/или затлъстяване [3]. Тежестта на заболяването при хоспитализирани пациенти се характеризира с тежка пневмония, свързана с явна възпалителна реакция, характеризираща се с висок С-реактивен протеин (CRP) и интерлевкин-6 (IL-6), нисък албумин, висока скорост на утаяване, ниски еозинофили и лимфопения. Хоспитализираните лица също имат повишена лактат дехидрогеназа (LDH), маркер на клетъчната смърт, често свързана с променена коагулация [4, 5]. Високият LDH, ниският брой на лимфоцитите и високите нива на високочувствителен CRP прогнозират смъртността на отделните пациенти повече от 10 дни предварително с точност над 90% [6]. Няколко мета-анализа също свързват нивата на IL-6 с тежестта на синдрома на COVID-19 [7–9].
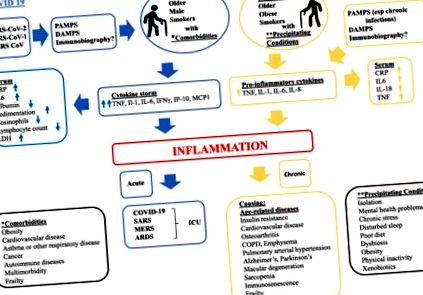
По този начин, необичайно разпространение на проучвания, публикувани през последните няколко месеца, предполага, че инфекцията с SARS-CoV-2 отприщва мощен и очевидно неконтролиран възпалителен отговор, който най-вероятно добавя към увреждането на тъканите, вече причинено от вирусна инфекция към основния COVID-19 патология. Високата концентрация на провъзпалителни медиатори, която е наречена „цитокинова буря“, уврежда сърдечната, чернодробната и бъбречната системи, което води до отказ и/или смърт на мултиорганна система, медиирана от тумор некрозис фактор (TNF) [10] . SARS-CoV-2 засяга най-вече нивата на провъзпалителни цитокини/хемокини, типични за Т-хелпер 1 (TH1) клетъчен отговор като IL-6, IFNγ, IP-10 и MCP1 [11, 12], които привличат моноцити и Т клетки към заразеното място [13, 14], което вероятно допринася за лимфопенията и повишеното съотношение неутрофил-лимфоцити, наблюдавано в
80% от пациентите [15, 16]. Забележително е, че докато тежкият COVID-19 засяга непропорционално възрастни хора, системно възпаление от SARS-CoV-2 се открива при пациенти от всички възрастови групи, включително тежък мултисистемен възпалителен синдром с признаци на болестта на Kawasaki, наскоро идентифицирани при деца [17, 18].
COVID-19 и възпаление
Наборът от механизми, описани по-горе, може да са възможни обяснения за това как бактериална или вирусна инфекция може да предизвика възпалителен отговор и как вече компрометираните механизми на стареещата биология могат да модулират тежестта и последиците от такъв отговор. Още по-подходящи са нарастващите доказателства, че имунобиографията, историята на излагане на индивида на определени микроорганизми (напр. ХИВ и CMV) или антигени, могат да обуславят степента и характеристиките на настоящия възпалителен отговор на различни стимули [24, 32–34]. Основният процес, чрез който паметта за предишни експозиции на възпалителни пристъпи модулира вродения отговор на нова експозиция на антиген, е неизвестна, но съществуването на такава памет е доказано в епидемиологични проучвания и се счита за епигенетичен характер. Всъщност имунобиографията може да бъде механизмът, чрез който затлъстяването и метаболитният синдром, които се характеризират с хронично възпаление и необичайно производство на цитокини (TNF, IL-1 и IL-6) и променен отговор на имунните Т-клетки, изглежда увеличават риска от инфекция, както и тежестта и последиците, особено по отношение на резултатите, свързани с COVID-19 [35, 36].
Озадачаващо е, че инфекцията с COVID-19 може да предразположи хората към възпаление чрез вродена имунологична памет, дори когато острият клиничен синдром е лек и клинично разрешен за няколко дни без видими непосредствени последици. Всъщност има силна обосновка в подкрепа на хипотезата, че острата инфекция на SARS-Cov-2 предизвиква натрупване на субклинични увреждания, което от една страна предразполага индивида към хронично провъзпалително състояние, а от друга намалява способността да се възползва напълно от силен имунен отговор в контекста на инфекция или травма. На настоящия етап не са натрупани достатъчно данни за справяне с този въпрос, но със сигурност с натрупването на данни ще се появи повече яснота по този въпрос. Тук ние очертаваме някои от хипотетичните механизми, които подкрепят тази гледна точка, и очертаваме бъдеща програма за изследвания, която може директно да отговори на този въпрос, като събира надлъжни данни в кохорта пациенти, които са развили COVID-19 в широк диапазон на тежест.
Изучаване на урок от дългосрочните последици от ARDS, ТОРС, синдром на цитокиновата буря: синдром след ICU
Има доказателства, че тежките инфекции са последвани от дългосрочни неблагоприятни последици, включително поддържане на повишени нива на цитокини и ускоряване на намалените функционални способности, подобни на наблюдаваните при стареене като дългосрочно физическо, когнитивно и психологическо увреждане, дори при пациенти, които изглежда са се възстановили от първоначалната си обида, като загуба на белодробна функция при синдром на остри респираторни заболявания (ARDS).
В контекста на ARDS, CSS може да се разглежда като критично събитие, което стартира този процес. CSS е наблюдаван и при ТОРС и респираторен синдром в Близкия изток (MERS), причинени също от коронавируси, и води до високи нива на противовъзпалителни цитокини, подобни на COVID-19. При ТОРС пациенти с тежко заболяване са имали високи нива на серумни възпалителни цитокини (IFN-γ, IL-1, IL-6, IL-12 и TGFβ) и хемокини (CCL2, CXCL10, CXCL9 и IL-8) в сравнение с пациенти с леко заболяване [40]. При MERS пациентите с тежко заболяване са имали високи нива на серумни възпалителни цитокини (IL-6 и IFN-α) и хемокини (IL-8, CXCL-10 и CCL5) в сравнение с леко или умерено заболяване [41]. Наличието на провъзпалителен фон, който е типичен за възпалението, вероятно изостря тежестта на CSS. Например, при модел на мишка, наличието на възпаление увеличава честотата и леталността на цитокиновата буря след стимулиране със системна имунотерапия [42].
Много пациенти в интензивно отделение, които изпитват тежко и продължително заболяване, страдат от синдром на пост-интензивно лечение (PICS), който се проявява като когнитивни, психологически и физически увреждания и голям процент от тях никога не възстановяват напълно своето благосъстояние и функционален статус [43]. Физическото увреждане при PICS често включва мускулна слабост, изключителна умора, разстройства на настроението, полиневропатия и симптоми на декондициониране, които само леко реагират на тренировъчни програми [44]. Интересното е, че тези клинични характеристики са подобни на тези, наблюдавани при възрастни индивиди с възпалителна и свързана с немощна саркопения [34, 45]. Всъщност, оцелелите от ТОРС, ARDS, CSS и PICS, всички предизвикват физически и когнитивни дефицити, които биха могли да бъдат характеризирани като ускорено възпаление, което увеличава възможността оцелелите от COVID-19 да се сблъскат и с ускорено възпаление, със значителни дългосрочни последици за тяхното кладенец -съществуване. За опита на COVID-19 дългосрочните ефекти върху здравето и функционалния статус могат да бъдат допълнително влошени от прилагането на безпрецедентно в световната история социално дистанциране, социално-икономически стрес и изолация, чиито дългосрочни последици върху индивидите и обществото ще бъде предмет на интензивни изследвания през следващите години.
COVID-19 и механизми на възпаление при възрастни индивиди
PAMPs и DAMP взаимодействат с PPR сензори, изразени на клетъчната повърхност и цитоплазмата на много видове имунни клетки, като по този начин предизвикват възпалителни реакции, които допринасят за възпалението. Изследванията на патологията на белите дробове и горната дихателна тъкан показват, че инфекцията с SARS-CoV-2 води до тежки локални увреждания на тъканите [53, 54]. Фрагментацията на клетките освобождава PAMPs и DAMPs и активира възпалението чрез локални клетки, включително, в случая на белия дроб, алвеоларни епителни клетки и алвеоларни макрофаги, които освобождават провъзпалителни цитокини и хемокини, които привличат имунни клетки, включително моноцити и Т клетки [10]. В SARS-CoV-2, подобно на SARS-CoV-1 и MERS-CoV, адаптивните механизми избягват вроденото усещане, предизвикано от ангажиране с PPR, и последваща секреция на цитокини и трансдукция на IFN сигнал. Тези механизми на избягване включват екраниране на dsRNA с мембранно отделени отделения, гуанозиново затваряне и метилиране на CoVs неструктурни протеини и кодиране на NSP15, ендорибонуклеаза, която разцепва 5 'полиуридини, които се образуват по време на вирусна репликация, която ще бъде открита от MDA5 цитозол [55]. Въпреки тези защитни сили за избягване на вроденото усещане, индуцираната от SARS-CoV-2 цитокинова буря все още е вероятно инициирана от комбинация от вирусни PAMPs и приемни DAMPs [55].
Преки опити за блокиране на провъзпалителните цитокини, освободени по време на SARS-CoV-2, индуциран CSS, се изследват, тъй като е показано, че тежестта му корелира с заболеваемостта и смъртността от COVID-19. По-специално са предложени моноклонални антитела срещу сигналния път на IL-6 [56]. Понастоящем анти-IL-6R антителата тоцилизумаб и сарилумаб и анти-IL-6 антителата силтуксимаб се тестват в 13 клинични проучвания за ефективност при управление на COVID-19 CSS и пневмония [55]. Докато някои, ако тези проучвания са открили положителен отговор при някои биомаркери и клинични стойности, все още е твърде рано да се каже дали те оказват съществено влияние върху клиничните резултати и по-специално дали намаляват риска от възможни дългосрочни последици от възпаление при пациенти в интензивно отделение.
По отношение на възможните лечения с COVID-19, които се пресичат с възпаление, интригуващи резултати от рандомизираното клинично изпитване RECOVERY (Randomized Evaluation of COVid-19 thERapY) на над 11 500 пациенти във Великобритания съобщават, че ниски дози дексаметазон (6 mg веднъж дневно за до десет дни, или през устата, или чрез интравенозно инжектиране) през
2100 пациенти намаляват смъртността с 29% при проветриви пациенти и с 11% при други пациенти, получаващи само кислород, без полза за пациенти, които не се нуждаят от дихателна подкрепа [68]. Кортикостероидите могат да се използват за овлажняване на CSS, въпреки че тяхната употреба не показва предишна полза за оцеляване с MERS и ARDS, вероятно защото кортикостероидите забавят клирънса на вируса [69]. При COVID-19 и други CSS, ползите от кортикостероидите могат да зависят от времето на приложение. Ефектът вероятно е максимален преди пълното развитие на цитокиновата буря [70]. Лечението на възпаление при свързани с възрастта заболявания може също да се наложи да балансира дозата и времето на противовъзпалителните терапевтични средства, включително стероиди или други имуномодулиращи начини, за да се възползват повечето пациенти.
Проследяването на по-възрастни пациенти с COVID-19: стратегия за обществено здраве
Въз основа на прегледа на литературата предвиждаме, че възрастните хора, излекувани от COVID-19, ще имат по-голяма вероятност да развият възпаление и неговите последици от гледна точка на прекомерна заболеваемост, увреждане и немощ. Също така тези индивиди са по-склонни да получат ускорена имуносенесценция и следователно ще бъдат по-податливи на инфекции. Ако тази хипотеза е вярна, би било важно да се установи надлъжно проследяване на пациентите с COVID-19, за да се идентифицират субектите с по-висок риск от развитие на свързани с възрастта заболявания и да се подготви за ранни интервенции, които могат да намалят срочни ефекти на остър COVID-19. Тази широка програма за научни изследвания може да включва няколко важни действия:
Създайте НАЦИОНАЛЕН РЕГИСТЪР на по-възрастни пациенти (> 60 години), които са преживели инфекция с COVID-19 в широк диапазон от тежест. В допълнение към основните демографски данни регистърът трябва да събира информация за 1) Тежестта и клиничното протичане на острото събитие и краткосрочни и дългосрочни усложнения; 2) Обширна информация за биологични, физиологични и функционални биомаркери на стареенето, включително физически и когнитивни аспекти; 3) Стандартна мярка за разпространени хронични заболявания, включително валидирана мярка за мултиморбидност; 4) информация за рисковите фактори, включително поведенчески и социални рискови фактори в околната среда.
Регистърът трябва да бъде допълнен от НАЦИОНАЛНА БИОБАНКА, включваща биологични проби (производни на кръвта, но също и други биофлуиди) за субектите, включени в регистъра.
Регистърът и биобанката трябва да са основата за НАЦИОНАЛНО ПРОДЪЛЖАВАНЕ НА НАЦИОНАЛНИ ПРЕДЛОЖЕНИЯ на пациенти, преживели инфекция с COVID-19. Проследяването трябва да събира информация за дългосрочните респираторни, неврологични и метаболитни патологични резултати, както и за физическата и когнитивната функция. Анализът на тази база данни трябва да позволи по-добра идентификация на характеристиките на индивидите, свързани с неблагоприятни здравни резултати.
Използвайки този набор от данни, трябва също така да бъде възможно да се провери хипотезата, че инфекцията с COVID-19, подобно на други видове тежка инфекция, води до ускорено биологично стареене и неговите последици.
Заключения
Принос на авторите
Проектът е иницииран от LF. Всички автори са допринесли за написването на това парче. Авторът (ите) прочете и одобри окончателния ръкопис.
Финансиране
Тази работа беше подкрепена от Програмата за вътрешни изследвания на Националните здравни институти (NIH), Националния институт за стареене и Националния институт по екологични здравни науки.
- 4 начина за използване на SMS, за да поддържат служителите здрави и продуктивни по време на извънредна ситуация в областта на общественото здраве
- Конструктивна критика на аргументите за общественото здраве за данъци върху содата срещу затлъстяване и данъци върху храните от
- Диета за артрит-чайлдърс, която го спира през нощта, лошо здраве, стареене и по-кратък живот
- Здраве на пикочния мехур за възрастни хора Национален институт за стареене
- Алкохол, тютюн, затлъстяване и новото обществено здраве Критично обществено здраве том 21, № 1