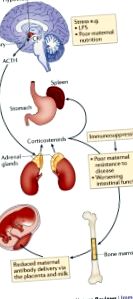
Субекти
Ключови точки
Майчината микробиота влияе върху развитието на плода и новороденото.
Метаболитна експозиция на плода вътреутробно зависи от храненето на майката и експозицията на ксенобиотици, и двете се модулират от микробния метаболизъм.
Молекулите, произхождащи от чревните микроорганизми на майката, достигат до потомството си чрез плацентата по време на развитието на плода и през майчиното мляко през постнаталния период.
Майчините антитела усилват микробния молекулен трансфер и двете вътреутробно и по време на кърмене.
Сигнализирането от микробни молекули на майката оформя развитието и функцията на имунната система в ранния живот.
Резюме
Лигавичните повърхности на бозайниците са гъсто колонизирани с микроорганизми, които обикновено се наричат коменсална микробиота. Смята се, че плодът вътреутробно е стерилен и че колонизацията с микроорганизми започва едва след раждането. Независимо от това, нероденият плод е изложен на множество метаболити, които произхождат от коменсалната микробиота на майката, които достигат до системни места на майчиното тяло. Чревната микробиота е силно персонализирана и се влияе от фактори на околната среда, включително храненето. Членовете на майчината микробиота могат да метаболизират хранителни компоненти, фармацевтични продукти и токсини, които впоследствие могат да бъдат предадени на развиващия се плод или новороденото, което кърми. В този преглед ние обсъждаме сложното взаимодействие между храненето, майчината микробиота и погълнатите химикали и обобщаваме техните ефекти върху имунитета при потомството.
Опции за достъп
Абонирайте се за Journal
Получете пълен достъп до дневник за 1 година
само 4,60 € на брой
Всички цени са нетни цени.
ДДС ще бъде добавен по-късно при плащане.
Наем или покупка на статия
Получете ограничен или пълен достъп до статии в ReadCube.
Всички цени са нетни цени.
Препратки
Блекбърн, Д. Г. Реконструиране на еволюцията на вивипарността и плацентацията. J. Theor. Biol. 192, 183–190 (1998).
Renfree, M. B., Hore, T. A., Shaw, G., Graves, J. A. & Pask, A. J. Еволюция на геномния импринтинг: прозрения от торбести и монотреми. Ану. Преподобна геномика Hum. Genet. 10, 241–262 (2009).
Millen, J. W. & Woollam, D. H. Хранене на майката във връзка с необичайно развитие на плода. Proc. Nutr. Soc. 19., 1–5 (1960).
Pacha, J. Развитие на чревната транспортна функция при бозайници. Физиол. Преп. 80, 1633–1667 (2000).
Torow, N. & Hornef, M. W. Неонаталният прозорец на възможностите: създаване на сцена за взаимодействие между гостоприемника и микробните органи и имунна хомеостаза. J. Имунол. 198, 557–563 (2017). Тази статия елегантно обобщава литературата за важността на периода от време след раждането за формирането на имунната система на индивида, неговата местна коменсална микробиота и чувствителността към болести по-късно в живота.
Buklijas, T. Храна, растеж и време: Изследванията на Елси Уиддоусън и Робърт Макканс върху пренаталния и ранния постнатален растеж. Студ Hist. Филос. Biol. Biomed. Sci. 47, 267–277 (2014).
Уолтън, А. и Хамънд, Дж. Майчините ефекти върху растежа и конформацията при кръстосванията на Shire Horse-Shetland Pony. Proc. R. Soc. Б. 125, 311–335 (1938).
Ross, M. G. & Beall, M. H. Възрастни последствия от вътрематочно ограничаване на растежа. Семин. Перинатол. 32, 213–218 (2008).
Fall, C. H. Доказателства за вътрематочното програмиране на затлъстяването в по-късен живот. Ан. Хъм. Biol. 38, 410–428 (2011).
Ravelli, A. C. et al. Глюкозен толеранс при възрастни след пренатално излагане на глад. Лансет 351, 173–177 (1998).
Денисън, Е. М. и сътр. Тегло при раждане, генотип на рецептор за витамин D и програмиране на остеопороза. Педиатър. Перинат. Епидемиол. 15, 211–219 (2001).
Thompson, C., Syddall, H., Rodin, I., Osmond, C. & Barker, D. J. Тегло при раждане и риск от депресивно разстройство в късния живот. Br. J. Психиатрия 179, 450–455 (2001).
Bateson, P. et al. Пластичност на развитието и човешкото здраве. Природата 430, 419–421 (2004).
Ho, S. M., Tang, W. Y., Belmonte de Frausto, J. & Prins, G. S. Излагането на развитие на естрадиол и бисфенол А повишава чувствителността към канцерогенезата на простатата и епигенетично регулира фосфодиестераза тип 4 вариант 4. Рак Res. 66, 5624–5632 (2006).
Zinkernagel, R. M. Майчини антитела, детски инфекции и автоимунни заболявания. N. Engl. J. Med. 345, 1331–1335 (2001).
Kearney, J. F., Patel, P., Stefanov, E. K. & King, R. G. Репертоари на естествените антитела: развитие и функционална роля при инхибиране на алергичните заболявания на дихателните пътища. Ану. Преподобен Имунол. 33, 475–504 (2015).
Newbold, R. R. Уроци, извлечени от перинаталната експозиция на диетилстилбестрол. Токсикол. Приложение Pharmacol. 199, 142–150 (2004).
Breton, J. et al. Чревната микробиота ограничава тежестта от тежки метали, причинена от хронично излагане през устата. Токсикол. Lett. 222, 132–138 (2013).
Wilson, I. D. & Nicholson, J. K. Взаимодействие с чревния микробиом с лекарствения метаболизъм, ефикасност и токсичност. Превод Рез. 179, 204–222 (2017).
Палмър, А. С. Хранително медиирано програмиране на развиващата се имунна система. Adv. Nutr. 2, 377–395 (2011).
Chen, X., Welner, R. S. & Kincade, P. W. Възможен принос на ретиноидите за регулиране на феталната В лимфопоеза. Евро. J. Имунол. 39, 2515–2524 (2009).
van de Pavert, S. A. et al. Майчините ретиноиди контролират вродени лимфоидни клетки от тип 3 и определят имунитета на потомството. Природата 508, 123–127 (2014).
Fraker, P. J. & King, L. E. Препрограмиране на имунната система по време на дефицит на цинк. Ану. Преподобни Nutr. 24, 277–298 (2004).
Benediktsson, R., Calder, A. A., Edwards, C. R. & Seckl, J. R. Плацентарна 11β-хидроксистероидна дехидрогеназа: ключов регулатор на феталната експозиция на глюкокортикоиди. Clin. Ендокринол. (Oxf.) 46, 161–166 (1997).
Backhed, F. et al. Чревната микробиота като фактор на околната среда, който регулира съхранението на мазнини. Proc. Natl Акад. Sci. САЩ 101, 15718–15723 (2004). Това е забележителен документ, който докладва за всеобхватните метаболитни последици от микробния метаболизъм и молекулярния обмен за гостоприемника.
Holmes, E., Li, J. V., Athanasiou, T., Ashrafian, H. & Nicholson, J. K. Разбиране на ролята на нарушаването на метаболитния сигнал на чревния микробиом-приемник в здравето и заболяванията. Тенденции Microbiol. 19., 349–359 (2011).
Mandal, S. et al. Приемът на мазнини и витамини по време на бременност има по-силни връзки с провъзпалителната микробиота на майката, отколкото приема на въглехидрати. Микробиом 4, 55 (2016).
Clark, A. & Mach, N. Роля на витамин D в хигиенната хипотеза: взаимодействието между витамин D, рецептори за витамин D, чревна микробиота и имунен отговор. Отпред. Имунол. 7, 627 (2016).
Holmes, E., Li, J. V., Marchesi, J. R. & Nicholson, J. K. Състав и активност на микробиотата на червата във връзка с метаболитния фенотип на гостоприемника и риска от заболяване. Cell Metab. 16., 559–564 (2012).
Ma, J. et al. Високомаслената майчина диета по време на бременност упорито променя микробиома на потомството в модел на примати. Нат. Общ. 5, 3889 (2014).
Roediger, W. E. Роля на анаеробните бактерии в метаболитното благосъстояние на лигавицата на дебелото черво при човека. Червата 21., 793–798 (1980).
Furusawa, Y. et al. Бутират, получен от коменсален микроб, индуцира диференциацията на Т-клетките на регулаторните клетки на дебелото черво. Природата 504, 446–450 (2013).
Arpaia, N. et al. Метаболитите, произведени от коменсални бактерии, насърчават генерирането на периферни регулаторни Т-клетки. Природата 504, 451–455 (2013). Референции 31–33 показват ясни ефекти на микробните метаболити върху имунното развитие и функция на гостоприемника.
Smith, P. M. et al. Микробните метаболити, късоверижни мастни киселини, регулират хомеостазата на Treg в дебелото черво. Наука 341, 569–573 (2013).
LeBlanc, J. G. et al. Бактериите като доставчици на витамин на техния приемник: перспектива за чревната микробиота. Curr. Становище. Биотехнол. 24, 160–168 (2013).
Шулман, С. Г. Основи на взаимодействието на йонизиращите лъчения с химични, биохимични и фармацевтични системи. J. Pharm. Sci. 62, 1745–1757 (1973).
Albert, M. J., Mathan, V. I. & Baker, S. J. Синтез на витамин В12 от човешки тънки чревни бактерии. Природата 283, 781–782 (1980).
Camilo, Е. et al. Фолатът, синтезиран от бактерии в горната част на тънките черва на човека, се усвоява от гостоприемника. Гастроентерология 110, 991–998 (1996).
Collado, M. C., Isolauri, E., Laitinen, K. & Salminen, S. Различен състав на чревната микробиота по време на бременност при жени с наднормено тегло и с нормално тегло. Am. J. Clin. Nutr. 88, 894–899 (2008).
Koren, O. et al. Домакин ремоделиране на чревния микробиом и метаболитни промени по време на бременност. Клетка 150, 470–480 (2012).
Rossant, J. & Cross, J. C. Развитие на плацентата: уроци от миши мутанти. Нат. Преподобни Genet. 2, 538–548 (2001).
Sulik, K. K. Генезис на алкохолно-индуциран краниофациален дисморфизъм. Опит Biol. Med. (Мейууд) 230, 366–375 (2005).
Hilbert, J. M., Ning, J., Symchowicz, S. & Zampaglione, N. Плацентарен трансфер на квазепам при мишки. Drug Metab. Диспозиции. 14., 310–312 (1986).
Coan, P. M. et al. Адаптациите в капацитета за пренос на хранителни вещества в плацентата, за да отговорят на нуждите на растежа на плода, зависят от размера на плацентата при мишки. J. Physiol. 586, 4567–4576 (2008).
Constancia, М. и сътр. Специфичният за плацентата IGF-II е основен модулатор на растежа на плацентата и плода. Природата 417, 945–948 (2002).
Li, L. et al. Регулиране на поведението на майката и растежа на потомството чрез бащин израз Peg3. Наука 284, 330–333 (1999).
Heijmans, B. T. et al. Постоянни епигенетични различия, свързани с пренаталното излагане на глад при хората. Proc. Natl Акад. Sci. САЩ 105, 17046–17049 (2008).
Eggert, H., Kurtz, J. & Diddens-de Buhr, M. F. Различни ефекти на бащиното транс-поколение имунно грундиране върху оцеляването и имунитета в стъпка и генетично потомство. Proc. Biol. Sci. 281, 20142089 (2014).
Koch, M. A. et al. Майчините IgG и IgA антитела потискат лигавичните Т хелперни клетки в ранния живот. Клетка 165, 827–841 (2016). Това проучване демонстрира присъствието на специфични за майката микробиота IgG и IgA в майчиното мляко и показва, че те се прехвърлят на потомството, за да се установи функционален мутуализъм с входящата микробиота.
Grindstaff, J. L., Brodie, E. D. 3rd & Ketterson, E. D. Имунна функция през поколенията: интегриращ механизъм и еволюционен процес при предаване на майчините антитела. Proc. Biol. Sci. 270, 2309–2319 (2003).
Gautreaux, M. D., Deitch, E. A. & Berg, R. D. Т лимфоцити в защита на гостоприемника срещу бактериална транслокация от стомашно-чревния тракт. Инфектирайте. Имун. 62, 2874–2884 (1994).
O'Boyle, C. J. et al. Микробиология на бактериалната транслокация при хора. Червата 42, 29–35 (1998).
Perez, P. F. et al. Бактериално отпечатване на новородената имунна система: уроци от майчините клетки? Педиатрия 119, e724 – e732 (2007).
Fardini, Y., Chung, P., Dumm, R., Joshi, N. & Han, Y. W. Предаване на различни орални бактерии в миша плацента: доказателства за оралния микробиом като потенциален източник на вътрематочна инфекция. Инфектирайте. Имун. 78, 1789–1796 (2010).
Yajima, М. и сътр. Бактериална транслокация при новородени плъхове: връзката между чревната флора, транслоцираните бактерии и влиянието на млякото. J. Педиатър. Гастроентерол. Nutr. 33, 592–601 (2001).
Aagaard, K. et al. Плацентата съдържа уникален микробиом. Sci. Transl Med. 6, 237ra65 (2014). Това проучване показва наличието на непатогенни коменсални бактерии в проби от човешка плацента.
Goldenberg, R. L., Hauth, J. C. & Andrews, W. W. Вътрематочна инфекция и преждевременно раждане. N. Engl. J. Med. 342, 1500–1507 (2000).
Smith, K., McCoy, K. D. & Macpherson, A. J. Използване на аксенични животни при изучаване на адаптацията на бозайниците към тяхната коменсална чревна микробиота. Семин. Имунол. 19., 59–69 (2007).
Hapfelmeier, S. et al. Обратимата микробна колонизация на мишки без микроби разкрива динамиката на IgA имунните отговори. Наука 328, 1705–1709 (2010).
Gomez de Aguero, M. et al. Майчината микробиота задвижва ранното постнатално вродено имунно развитие. Наука 351, 1296–1302 (2016). Тази статия описва механизма, чрез който майчината гестационна колонизация оформя състава и функцията на ранната имунна система.
Jacobowitz Israel, E., Patel, V. K., Taylor, S. F., Marshak-Rothstein, A. & Simister, N. E. Изискване за свързан с β2-микроглобулин Fc рецептор за придобиване на майчиния IgG от фетални и новородени мишки. J. Имунол. 154, 6246–6251 (1995).
Malek, A., Sager, R., Kuhn, P., Nicolaides, K. H. & Schneider, H. Еволюция на материнофеталния транспорт на имуноглобулини по време на бременност при човека. Am. J. Reprod. Имунол. 36, 248–255 (1996).
Neu, J. Развитие на стомашно-чревния тракт и задоволяване на хранителните нужди на недоносените деца. Am. J. Clin. Nutr. 85, 629S – 634S (2007).
Siggers, R. H., Siggers, J., Thymann, T., Boye, M. & Sangild, P. T. Хранителна модулация на чревната микробиота и имунната система при недоносени новородени, податливи на некротизиращ ентероколит. J. Nutr. Biochem. 22., 511–521 (2011).
Kramer, D. R. & Cebra, J. J. Ранна поява на „естествени“ лигавични IgA отговори и зародишни центрове при сучещи мишки, развиващи се в отсъствие на майчини антитела. J. Имунол. 154, 2051–2062 (1995).
Harris, N. L. et al. Механизми на защита на антитела срещу новородени лигавици. J. Имунол. 177, 6256–6262 (2006).
Rogier, E. W. et al. Секреторните антитела в кърмата насърчават дългосрочната чревна хомеостаза чрез регулиране на чревната микробиота и експресията на гена на гостоприемника. Proc. Natl Акад. Sci. САЩ 111, 3074–3079 (2014). Това проучване предоставя ясни доказателства, че майчините антитела в майчиното мляко имат защитна роля при потомството.
Kau, A. L. et al. Функционална характеристика на насочени към IgA бактериални таксони от недохранени деца от Малави, които произвеждат ентеропатия, зависима от диетата. Sci. Transl Med. 7, 276ra24 (2015). Това е ключова книга, показваща взаимодействията между човешките микробиоти и техните имунни системи, които определят чревната ентеропатия в околната среда, което е сериозен и като цяло недооценен проблем в развиващия се свят, който засяга дългосрочното развитие и здравето на засегнатите индивиди.
Blanton, L. V. et al. Чревни бактерии, които предотвратяват увреждания на растежа, предавани от микробиота от недохранени деца. Наука 351, aad3311 (2016).
Waterland, R. A. & Jirtle, R. L. Транспонируеми елементи: цели за ранни хранителни ефекти върху епигенетичната генна регулация. Мол. Клетка. Biol. 23., 5293–5300 (2003).
Burris, H. H. et al. Метилирането на ДНК на потомството на репресорния ген на арил-въглеводородния рецептор е свързано с ИТМ на майката, гестационна възраст и тегло при раждане. Епигенетика 10, 913–921 (2015).
McGill, J. et al. Излагането на плода на етанол има дългосрочни ефекти върху тежестта на грипните вирусни инфекции. J. Имунол. 182, 7803–7808 (2009).
Lee, G. R., Kim, S. T., Spilianakis, C. G., Fields, P. E. & Flavell, R. A. T помощна диференциация на клетки: регулиране чрез цис елементи и епигенетика. Имунитет 24, 369–379 (2006).
Schuyler, R. P. et al. Различни тенденции на моделиране на ДНК метилиране във вродената и адаптивна имунна система. Представител на клетката. 17, 2101–2111 (2016).
Lipka, D. B. et al. Идентифициране на промените в метилирането на ДНК при цис-регулаторни елементи по време на ранните етапи на HSC диференциация, използвайки базиране на тагментиране на цялостен геном бисулфит секвениране. Клетъчен цикъл 13, 3476–3487 (2014).
Cabezas-Wallscheid, N. et al. Идентифициране на регулаторни мрежи в HSC и тяхното непосредствено потомство чрез интегриран анализ на протеоми, транскриптоми и ДНК метиломи. Клетъчна стволова клетка 15, 507–522 (2014).
Moles, L. et al. Бактериално разнообразие в мекония на недоносени новородени и еволюция на тяхната фекална микробиота през първия месец от живота. PLOS ONE 8, e66986 (2013).
Arrieta, M. C., Stiemsma, L. T., Amenyogbe, N., Brown, E. M. & Finlay, B. Чревният микробиом в ранен живот: здраве и болести. Отпред. Имунол. 5, 427 (2014).
Backhed, F. et al. Динамика и стабилизация на микробиома на човешките черва през първата година от живота. Клетъчен домакин Микроб 17, 690–703 (2015).
Благодарности
Авторите благодарят на колегите в тяхната лаборатория и на У. Зауер, У. Хард и К. Мюлер за полезни дискусии по темата. Работата на A.J.M. се финансира от безвъзмездни средства от Швейцарската национална научна фондация (SNSF 310030B_160262 и SNSF Sinergia CRSII3_154414) и програмата Swiss SystemsX (GutX)); M.G.A. притежава грант Ambizione на Швейцарската национална научна фондация (PZ00P3_168012); и S.C.G.-V. се подкрепя от дългосрочна стипендия на Европейска организация за молекулярна биология (ALTF 841–2013).
Информация за автора
Принадлежности
Морис Мюлер Лаборатории, отдел Klinische Forschung, Universitätsklinik für Viszerale Chirurgie und Medizin Inselspital, Университет в Берн, Murtenstrasse 35, Берн, 3008, Швейцария
Andrew J. Macpherson, Mercedes Gomez de Agüero & Stephanie C. Ganal-Vonarburg
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
- Как здравословното хранене оформя вашата имунна система Клиниката в Орегон
- Връзки между коронавируса, храненето и имунната система World Cancer Research Fund International
- Как да подсилим имунната си система чрез диетичен елемент
- Как да поддържате имунната си система със здравословен диетичен подход
- Как да подсилим имунната си система чрез диетичен елемент