В исторически план алкохолът се използва заедно със социални дейности, включително религиозни и нерелигиозни ритуали, като хранителен компонент и като лекарствен агент. Консумацията на алкохол от различни култури предшества писмената история. Въпреки че някога е бил използван за терапевтични цели, той вече не се препоръчва като терапевтично средство поради способността му да предизвиква интоксикация. Способността на погълнатия алкохол да попадне от червата в кръвния поток и до мозъка, където той произвежда опияняващите ефекти, се дължи на неговата химическа структура и разтворимост във вода.
Химическа структура на алкохола
Алкохолите са органични молекули, събрани от атоми въглерод (С), кислород (О) и водород (Н). Когато има 2 въглерода, алкохолът се нарича етанол (известен също като етилов алкохол). Етанолът е формата на алкохол, съдържащ се в напитки, включително бира, вино и алкохол.
Научете повече за образуването на алкохол в напитките.
Химичният състав на етанола може да бъде представен като 1) молекулна формула или като 2) структурна формула. Молекулната формула на етанола е C2H6O, което показва, че етанолът съдържа два въглерода и кислород. Въпреки това, структурната формула на етанола, C2H5OH, предоставя малко повече подробности и показва, че има хидроксилна група (-OH) в края на 2-въглеродната верига (Фигура 1.1). Групата -OH е характерна за всички алкохоли.
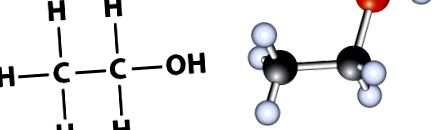
Фигура 1.1 Показани са два често срещани начина за представяне на структурата на етанола. Вляво е атомното изображение на пръчката на структурната формула, а вдясно е моделът на топката и пръчката.
Етанолът е разтворим във вода
Етанолът е интересна молекула. Той е полярен или хидрофилен (водолюбива) поради наличието на крайната хидроксилна група, така че тя се разтваря във вода. И все пак поради 2-въглеродната верига тя има малко неполярен характер. Няма разделяне на електрическите заряди между въглеродните атоми, като по този начин се минимизират междумолекулните взаимодействия във водните разтвори. Обикновено въглеродните вериги (наситени с водород) дават молекула хидрофобни (страхуващ се от вода) характер, което го прави по-малко разтворим във вода. В случая на етанол обаче въглеродната верига е достатъчно къса, така че да доминира по-полярната група -OH, придавайки на етанола полярен характер. В алкохоли с относително дълги въглеродни вериги (4 или повече), полярните ефекти на -OH групата не са достатъчни за преодоляване на хидрофобната природа на въглеродната верига, което води до алкохоли, които са постепенно по-малко разтворими във вода.
Характеристиките на разтворимост на етанола стават важни по отношение на способността му да се движи през биологичните мембрани и около тялото. Тъй като това е малка молекула (молекулно тегло = 46 g/mol), тя се вписва през порите (дупките) в биологичната мембрана. Всъщност той се разпределя във всяка област в тялото, в която се намира вода. Въпреки това, 2-въглеродната верига в етанола я прави леко липофилна (обичаща липидите), така че може да проникне и в липидните двуслойни слоеве на биологичните мембрани.
Фигура 1.2 Разтворимостта на алкохол зависи от наличието на крайна хидроксилна (OH) група и дължината на въглеродната му верига.
- Тази диаграма е полезно ръководство за пиене на алкохол на кето
- Какво се случва, когато спрете да пиете алкохол Ползи от не пиенето
- Въздействието на физическото възпитание върху затлъстяването сред децата в началното училище
- Защо трябва да опитате 30-дневна алкохолна почивка
- Какво представлява Лимпедната лимфна образователна и изследователска мрежа
