Резюме
Въведение
Инфекциозните заболявания се появяват с нарастваща скорост (Daszak et al., 2000). Някои от тези заболявания представляват пряка заплаха за хората, като ХИВ, докато болестите по дивата природа застрашават световното биологично разнообразие и следователно косвено засягат хуманното отношение към хората. Една от причините, поради които инфекциозните заболявания се появяват с по-бързи темпове, е, че екологичните взаимоотношения са променени по начин, който благоприятства предаването на болестта (Daszak et al., 2000; Keesing et al., 2006). Например, промените в географското разпределение на патогени и гостоприемници могат да доведат до огнища на болести, както се случи с вируса на Западен Нил (Allan et al., 2009). Промяната в екологичната структура на общностите също е свързана с огнища на болести. Например, честотата на бактериално причинената лаймска болест в човешката популация се е увеличила, когато относителното изобилие от алтернативни гостоприемници е намаляло (LoGiudice et al., 2003) и може да зависи от структурата на общността на конкурентни микроби във вектори на кърлежи (Clay et al ., 2006).
Структурата на общността на микробите върху и в рамките на гостоприемниците е свързана с резистентност към болести (Dethlefsen et al., 2007). Например, противогъбичните микроби могат да бъдат важни за устойчивостта на болести при различни видове (Gil-Turnes et al., 1989; Gil-Turnes and Fenical, 1992; Currie et al., 1999; Kaltenpoth et al., 2005; Scarborough et al., 2005; Scott et al., 2008). Нарушаването на противогъбичните микробни съобщества вероятно ще доведе до разрушаване на защитните ефекти на полезните микроби и може да доведе до поява на болести (Dethlefsen et al., 2007; Belden and Harris, 2007). По-позитивно е, че методите за възстановяване на защитни микробни общности могат да осигурят начин за управление на болестите в дивата природа в природата.
Възникващата инфекциозна болест, хитридиомикозата, е основен фактор, отговорен за изчезването на видове земноводни, една трета от които са застрашени от изчезване (Stuart et al., 2004; Lips et al., 2006; Skerratt et al., 2007). Причинени от хитридните видове Batrachochytrium dendrobatidis (Bd), това кожно заболяване е свързано с намаляване на популацията и изчезване на над 200 вида земноводни в райони, незасегнати от загуба на местообитания (Longcore et al., 1999; Skerratt et al., 2007). От описанието му през 1999 г. научихме значително количество за историята на живота на патогена, физиологията, популационната генетика, реакциите му към имунитета на гостоприемника и как причинява смърт (Morehouse et al., 2003; Piotrowski et al., 2004; Berger et, 2005; Rollins-Smith и Conlon, 2005; Morgan et al., 2007; Voyles et al., 2007; Woodhams et al., 2007a, 2007b, 2008). Много по-малко се знае за това как да се контролира или управлява болестта в природата. Предлагаме, че взаимодействията на общността между кожните микроби на земноводните и Bd могат да бъдат манипулирани по начин за повишаване на устойчивостта на болестта в смисъл за намаляване на въздействието на болестта.
Материали и методи
Тридесет и едно R. muscosa младите са получени от лабораторна колония, отгледана от събрани на поле яйца, в Калифорнийския университет, Бъркли. Всяка жаба беше поставена в собствен автоклавиран пластмасов контейнер, съдържащ приблизително 200 ml среда Provosoli (Wyngaard and Chinnappa, 1982) и бе произволно определена позиция на метални стелажи в контролирана от температурата стая, зададена на 17 ° C с 12-часов светлинен цикъл . Контейнерите се почистват с 10% белина и се автоклавират два пъти седмично. Всяка жаба е хранена с пет щурца седмично. Протоколите за грижа за животните бяха одобрени от Комитета по грижа и употреба на Университета на Бъркли и Джеймс Мадисън.
Направихме повторен, рандомизиран експеримент с три групи от R. muscosa: (1) Bd, излагане на Bd зооспори; (2) бактерии, излагане на J. lividum и (3) Бактерии + Bd, излагане и на двете J. lividum и Bd зооспори. В този експеримент са използвани осемнадесет жаби, като размерът на пробата за всяка обработена група е шест жаби, като всяка жаба е в отделен контейнер. Нямаше разлика в масата между трите лечебни групи в началото на експеримента (дисперсионен анализ (ANOVA): d.f. = 2.15, F = 0.943, P= 0,411). Предварителен експеримент с още 10 непълнолетни R. muscosa беше проведено, за да се получи скорост на растеж при стандартни лабораторни условия. Тази оценка е използвана като сравнение за темповете на растеж, оценени от 18-те жаби в трите манипулирани групи за лечение. Три други непълнолетни са използвани за оценка на концентрацията на вицелацеин върху лица, които не са били подложени на експериментални манипулации.
По това време индивидите в Bd и бактериите + Bd са били изложени на Bd зооспори. Този ден се счита за ден 1 от експеримента. Непосредствено преди експозицията бяха претеглени всички жаби. Жабите се поставят индивидуално в 120 ml GladWare контейнери с 300 зооспори, суспендирани в 15 ml среда Provosoli за 24 часа. Алтернативно, жабите при лечение с бактерии са били изложени само на среда. Bd щам JEL 215, изолиран от R. muscosa е бил използван за експозиция. Културите на изолата се поддържат в 1% триптон и се прехвърлят седмично. Разтворът на зооспора, използван за инокулиране на жабите, се приготвя чрез отглеждане на зооспори върху плочи, съдържащи 1% триптон и 1% агар. След период от приблизително 72 часа плочите се заливат с 6 ml среда Provosoli. След 20 минути останалият разтвор се отстранява с пипета. Концентрацията на зооспорите се определя с хемацитометър и се разрежда до 20 зооспори на ml.
Различията в средните стойности бяха тествани с ANOVA, освен ако данните не бяха нормално разпределени, като в този случай беше използван непараметричен тест на Wilcoxon. Използвана е ANOVA с повтарящи се мерки за тестване на разликите в броя на зооспорите във времето като функция от лечението. Една стойност за еквиваленти на зооспори при лечението с бактерии беше изключително отклонение (тест на Диксън: r10 = 1,0, н= 6, P
Резултати
Прилагане на анти-Bd бактерии върху незаразени жаби
Поставяне на жаби в разтвор с J. lividum доведе до успешна колонизация на кожата. Грундове, специфични за J. lividum посочи, че всички лица в експеримента са имали J. lividum върху кожите им, независимо дали са били изложени на баня от този бактериален вид. Въпреки това, метаболитът, произведен от J. lividum, виолецеин, е намерен само на жабите, къпани в J. lividum разтвор (виж по-долу), докато необработените жаби не са имали откриваем виолецеин по кожата си. Този резултат предполага, че къпането в J. lividum увеличава плътността на популацията до точката, в която се произвежда вторичният метаболит виолацеин.
Оцеляване
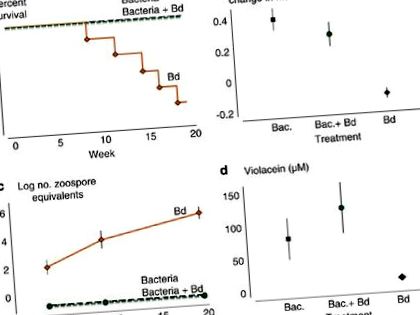
Добавяне J. lividum за неинфектирани жаби предотвратява смъртоносни последици от болестта (Фигура 1а). Пет от шест жаби по време на лечението с Bd умират, а шестата жаба показва симптоми на напреднал стадий на хитридиомикоза. Не е настъпила смъртност при лечение с бактерии и бактерии + Bd (Mantel – Cox log-rank test: d.f. = 2, χ 2 = 15.877, P= 0,0004).
Ефектът от третираната група върху (а) оцеляване, (б) пропорционален растеж на жабите, (° С) средният брой еквиваленти на зооспори от B. dendrobatidis и (д) концентрация на виолецеин върху кожите на жабите. Лентите за грешки представляват + 1 s.e. (черно, лечение с бактерии; зелено, бактерии + лечение с Bd; оранжево, лечение с Bd). Пълноцветната версия на тази фигура е достъпна на Вестник ISME на линия.
Промяна в теглото
Жабите при лечението с Bd не растат и отслабват средно (Фигура 1b). Жаби, които са били инокулирани с J. lividum или които са били инокулирани с J. lividum преди излагането на Bd нараства и набира около 33% от телесната маса (ANOVA: d.f. = 2.15, F = 17.71, P= 0,0001). Жабите при тези две по-късни обработки са имали дневна скорост на растеж, която е същата като скоростта на растеж на 10 неманипулирани жаби в предварителен експеримент (вж. Материали и методи, ANOVA: d.f. = 2.19, F = 0.81, P= 0,461), което предполага, че само добавянето на бактерии не влияе върху скоростта на растеж и че добавянето на бактерии преди излагане на Bd предотвратява загуба на тегло, свързана с Bd инфекция.
Bd изобилие
Броят на еквивалентите на зооспори, измерен чрез qPCR, е индекс на изобилието на Bd. Зооспоровите еквиваленти на жаби при лечението с Bd нарастват експоненциално с напредването на експеримента (Фигура 1в). Жабите в третирането с бактерии и бактерии + Bd не са имали откриваеми еквиваленти на зооспори по кожата си от деня на първата проба (ден 19) до последната ни проба (ден 139), което е драматична разлика от лечението с Bd (повторно - измерва ANOVA за лечението × време взаимодействие: df = 4,28, λ на Уилкс = 0,179, P= 0,0001). Освен това бактериите, добавени към кожите на жабите при лечението с бактерии + Bd, предотвратяват успешното установяване чрез Bd зооспори (тест на Kruskal – Wallis - ден 19: d.f. = 2, χ 2 = 12.645, P= 0,013; ден 62: d.f. = 2, χ2 = 16.129, P= 0,0003 и ден 139: d.f. = 2, χ 2 = 16,129, P= 0,0003).
Виолецеин
Оцеляването на жабите е силно свързано с наличието на виолецеин, анти-Bd метаболит, произведен от J. lividum (Фигура 1г). Петте жаби, умрели по време на лечението с Bd, нямат откриваема концентрация на виолецин върху кожата си. Жабата, която оцеля при лечението с Bd, няма откриваеми количества виолецеин (M); въпреки това, загубата на тегло, натоварването със зооспори и летаргичното поведение показват сериозна Bd инфекция. Средните концентрации на виолецеин са много по-високи върху кожите на жабите при третиране с бактерии и бактерии + Bd, отколкото при лечението с Bd (Фигура 1d; Тест на Крускал – Уолис: df = 2, χ 2 = 8,727, P= 0,018). Тримата непълнолетни, които не са били изложени на J. lividum или Bd не са имали забележима концентрация на виолецин върху кожите им.
Дискусия
Установихме, че заболеваемостта и смъртността, причинени от Bd, са предотвратени чрез биоаугментация на жабешки кожи с J. lividum и заключават, че екологичните взаимодействия между пребиваващи микроби и колонизиращи патогени са важен компонент на вродения им имунитет. Все повече се осъзнава, че при много видове микробен състав на общността на гостоприемник може да определи резултата от заболяването, след като патогенът се колонизира (Belden and Harris, 2007; Dethlefsen et al., 2007; Ostfeld et al., 2008) В допълнение, микробните взаимодействия във вектори на болестта могат да повлияят на разпространението на патогените и заболяването (Clay et al., 2006). Става ясно, че за да се разбере динамиката на заболяванията, трябва да се характеризират взаимодействията между гостоприемника, обитаващите го микроби и колонизиращите патогени.
В този експеримент ние изложихме младите жаби на ниска концентрация на Bd зооспори спрямо повечето други изследователи (Rachowicz et al., 2006; Retallick and Miera, 2007; Woodhams et al., 2007a). Концентрацията на зооспорите, която използвахме обаче, беше по-висока от тази, изчислена от водата в езерото в природата (Kirshtein et al., 2007; Walker et al., 2007). Например, Kirshtein et al., 2007 и Walker et al., 2007 изчисляват, че плътността на зооспорите в водоемите варира от 0,5 до 454 зооспори на литър, докато нашият протокол на експозиция е бил 20 000 зооспори на литър за 24 часа. Вземане на проби от скорошни експериментални статии разкрива, че отделни земноводни са били изложени на плътност на Bd в техните експериментални контейнери, които варират от 25 000 зооспори на литър (Rachowicz и Vredenburg, 2004) до 10 5–10 6 зооспори на литър (Rachowicz et al., 2006; Retallick and Miera, 2007; Woodhams et al., 2007a). Необходими са допълнителни експерименти, които променят нивото и продължителността на експозиция на Bd зооспори във връзка с плътността на популацията на анти-Bd бактерии, за да се определи при какви условия кожната микробиота е защитна.
Нашият експеримент тества дали бактериалните жители от един вид могат ефективно да колонизират друг вид. Използвахме J. lividum изолиран от вид саламандра за инокулация на млади жаби, използвани в този експеримент. Намерихме J. lividum На R. muscosa, предполагайки това J. lividum е резидентен микроб и това J. lividum от друг вид земноводни може да се използва за увеличаване на плътността му (Woodhams et al., 2007b). Освен това бяхме завършили проучване на анти-Bd метаболити, произведени от този щам, така че намаляването на заболеваемостта и смъртността, причинено от Bd, може да бъде свързано с неговите метаболити (Brucker et al., 2008b). Нашите резултати показват, че ще имаме потенциала да се насочим към по-широката възприемчива общност на земноводните, ако биоаугментацията като начин за контрол на Bd се премества от лабораторията в полевата среда.
Метаболитът виолацеин инхибира Bd при ниска концентрация инвитро (Brucker et al., 2008b) и се произвежда от J. lividum а не от земноводни. Този метаболит се произвежда и от други бактериални видове и има защитна функция (Yang et al., 2007; Matz et al., 2008). Анализът на виолецеин върху диви уловени саламандри показва концентрации върху кожи, достатъчно високи, за да инхибират Bd (Brucker et al., 2008b). Тъй като бактериите обикновено не произвеждат противогъбични вторични метаболити като виолецеин, докато плътността на популацията не е висока, ние предполагаме, че в нашия експеримент J. lividum е присъствал при висока плътност на популацията върху кожите на жабите. Земноводните могат да бъдат в състояние да регулират структурата на микробната общност върху кожата си чрез секрецията си на антимикробни пептиди, които се произвеждат в гранулирани жлези (Rollins-Smith и Conlon, 2005). Въпрос за бъдещи изследвания е да се определи дали тази регулация се случва и дали действа по начин, за да увеличи селективно растежа на кожни бактериални щамове, които произвеждат антибиотични метаболити, когато земноводните са изложени на кожни патогени.
Нашите резултати показват, че биоаугментацията с подходящи анти-Bd бактерии може да се използва за предотвратяване на Bd инфекции при осигуряване на оцеляване или размножаване в пленни колонии на земноводни видове. Тези колонии са важен компонент на усилията за опазване, особено ако индивидите могат да бъдат въведени отново в дивата природа. Бариера пред повторното въвеждане е, че неизменно един или повече видове земноводни в естествените си местообитания са устойчиви на Bd и служат като резервоари (Mendelson et al., 2006; Young et al., 2007). Лечението на податливи на земноводни видове с противогъбични кожни бактерии може да позволи на повторно въведените индивиди да съжителстват с Bd в местните местообитания. В този контекст е важно да се прецени колко дълго действат бактериалните обработки след освобождаването на третираните земноводни в природата. Намерихме виолецеин върху жаби в края на експеримента 20 седмици след бактериално инокулиране, което предполага, че ефектите от биоаугментацията продължават поне толкова дълго.
Амфибиите като група са изправени пред голям спад на популациите и изчезване поради хитридиомикозата, което прави изследванията в областта на управлението и превенцията висок приоритет за биолозите за опазване на земноводните. Нашите резултати показват, че разбирането на екологията на общността на земноводните кожи е ключов компонент на опитите за овладяване на тази зараждаща се инфекциозна болест. Една проста манипулация на кожната микробна общност на земноводните е обещаващ инструмент за управление за лечение на заразени индивиди. В допълнение, предишна работа показа, че популациите от R. muscosa които съжителстват с Bd, са имали по-висок дял от индивиди с поне един анти-Bd изолат на кожни бактерии (Woodhams et al., 2007b; непубликувани данни). Лечението на отделни жаби може да позволи на популациите да постигнат по-голям процент индивиди със защитни бактерии и следователно да позволят съжителство с патогена.
- Следвоенна превенция Възникващи рамки за предотвратяване на употребата на наркотици след войната срещу наркотиците
- Картофи, варени, варени без кожа, плът, без сол Хранителни факти и калории
- Упорит целулит Може ли отслабването да ви помогне да се отървете от тази портокалова кора като здравни съвети за кожата
- N95 Mask Eco Solutions Могат ли хирургическите маски да предотвратят коронавирусната енорийска болница Джаксън
- Зашеметяващо тяло, зашеметяващи процедури за ремоделиране и оформяне на кожата - действат ли