Магнезият се въвежда или с доломит, еквимоларен магнезиев/калциев карбонат, или с изгорен доломит, съответния смесен оксид, което е по-малко проблем със замърсяването.
Свързани термини:
- Алуминиев оксид
- Магнезиев атом
- Титанов диоксид
- Оксид
- Наночастица
- Цинков оксид
- Магнезиева сплав
Изтеглете като PDF
За тази страница
Реактивен магнезиев цимент
19.1 Въведение
Магнезият е осмият най-разпространен елемент в земната кора, при
2,3 тегловни%, присъстващи в редица скални образувания като доломит, магнезит и силикат. Магнезият е и третият най-разпространен елемент в разтвора в морската вода, с концентрации
1300ppm. Магнезият (магнезиев оксид, MgO) се произвежда главно от калциниране на магнезит в процес, подобен на производството на вар от варовик. По-малка част от световното производство на MgO идва от източници на морска вода и саламура. Основните фази на магнезия в морската вода са хлоридите и сулфатите и производственият процес се инициира чрез добавяне на силна основа, за да се улесни утаяването на магнезиев хидроксид (Mg (OH 2)), последвано от термично разлагане (например Gilbert, 1951). Настоящото глобално производство на MgO е
14 милиона тона годишно (USGS, 2012), в сравнение с този на Портланд цимент (PC) от над 2,6 милиарда тона, при текущи разходи около
£ 200/тон за реактивен MgO (калциниран), в сравнение с
MgO се произвежда в три основни съответни степени (Shand, 2006):
мъртво изгорено MgO или периклаза: произведени при температури от
1400–2000 ° C, представлява
60% от производството на MgO, има най-малка реакционна способност, най-висока кристалност и най-ниска повърхност, използва се широко в огнеупорни приложения и е типът, който е проблематичен за портландцимента;
твърдо изгорен MgO: произведен при температури от
1000–1400 ° C, има междинни свойства и се използва в храни за животни и торове и е широко използван като експанзивна добавка в бетонни язовири в Китай;
леко изгорен MgO, наричан още каустична магнезия, каустик-калциниран магнезит (CCM) или реактивна магнезия: произведен при температури от
700–1000 ° C, има най-висока реакционна способност, най-малка кристалност и най-голяма повърхност и приложенията му включват пластмаси, обработка на каучук, хартия и целулоза, лепила и киселинна неутрализация, за да назовем само няколко и е основната съставка на цимента, представен в тази глава.
MgO се използва при образуването на цименти или като добавка в бетона от средата на XIX век, когато Sorel през 1867 г., малко след изобретението на PC, разработва магнезиеви оксихлоридни цименти (MOC), наричани още Sorel цименти, чрез комбиниране на изгорена светлина MgO с разтвор на магнезиев хлорид (Sorel, 1867). Въпреки много технически предимства, циментите Sorel страдат от лоша водоустойчивост, което възпрепятства широкото им използване. Оттогава се появяват други подобни химически свързани цименти, включително магнезиеви фосфатни цименти, които са резултатите от реакцията между MgO, или силно изгорени, или мъртво изгорени, и киселинни фосфатни соли (Wagh, 2004) и които имат приложение като бързо втвърдяващи се ремонтни цименти . От средата на 60-те години силно изгореният MgO се използва за компенсиране на свиването в бетонни язовири в Китай (Du, 2006). Много по-наскоро реактивните MgO цименти (Harrison, 2008), които са смеси от изгорени от светлина MgO и PC, се появиха като по-устойчива алтернатива на PC и с очаквано превъзходно техническо представяне. Широкото покритие на химията и технологията на магнезия е дадено в Shand (2006) .
Анодно електроосаждане на MgO покрития за подобряване на корозионната устойчивост in vivo
6.3 Заключение
MgO покритието се приготвя върху повърхността на Mg сплав просто чрез анодно електроосаждане в 6 M разтвор на КОН, докато Mg (OH) 2 покритието се получава чрез анодизиране в 10 M разтвор на KOH, което може да се превърне в MgO чрез последваща термична обработка. Израстналите MgO защитни покрития могат да потиснат процеса на корозия, като предотвратяват пренасянето или дифузията на корозионните йони върху основата от магнезиева сплав, като по този начин подобряват устойчивостта на корозия. Анодното електроосаждане може да бъде алтернативен метод на PEO за получаване на слоеве, които могат да осигурят по-добра защита от корозия на магнезиевите сплави. MgO/PLA композитен филм върху повърхността на Mg сплав може да бъде по-ефективен за подобряване на корозионната му устойчивост.
Свързващи материали за втвърдяване на въздуха
3.3.3 Приложения на Магнезия
Магнезият и растителните влакна се свързват силно, което може да избегне разграждането на влакната. Следователно, той винаги се смесва с дървесни стърготини и дървесни влакна, за да се получи ксилолитен под, дърво-циментова плоскост и ксилолитова плоча.
В допълнение към дървесния чипс и дървесните влакна, към магнезий се добавят френски тебешир, азбест, фин кварцов пясък, тухлен прах и други пълнители, за да се подобри здравината и устойчивостта на износване на продуктите. Подът за шлайфане от магнезия ще бъде направен чрез използване на мрамор или скала със средна твърдост като инертни материали.
Магнезиевият под е устойчив на топлина, без прах, устойчив на износване, огнеустойчив, гладък и еластичен. Това е добър подов материал, който може да се оцвети чрез добавяне на устойчиви на алкали минерални пигменти.
Магнезиевата плоча има висока плътност, висока интензивност, звукопоглъщане и топлоизолация, която може да се използва като вътрешна стена, таван и други строителни материали.
Подсилената магнезия има висока интензивност и може да се използва като конструктивен елемент вместо дърво, като дървена подложка и колона.
Магнезият може да се превърне в лек и порест топлоизолационен материал чрез добавяне на разпенващ агент.
Водоустойчивостта на магнезия е лоша, така че нейните продукти не трябва да се съхраняват на влажни места за дълго време. И неговите продукти не трябва да се използват със стоманени пръти, тъй като в процеса на използване на магнезия обикновено се използва разтвор на магнезиев хлорид и хлоридните йони могат да разрушат стоманените пръти.
Синтез, характеризиране и приложения на нанобиоматериали за антимикробна терапия
Читял Ганеш Кумар,. Sankalp Vinod Agarwal, в нанобиоматериали в антимикробната терапия, 2016
4.4.4 NP на магнезиев оксид (MgO)
СЪЕДИНЯВАНЕ НА СИЛИКА В НЕОПРЕН
6.2 NSM (ТИП W) НЕОПРЕН: ОКСИДНО КРЕССИНКИНГ
Магнезият и цинковият оксид обикновено са необходими за ефективно омрежване, но не е задължително в традиционните концентрации 4 и 5 phr. Вариациите в съдържанието на магнезий предизвикват много по-големи колебания на свойствата, отколкото тези на цинковия оксид. В основно съединение, силно напълнено със силициев диоксид и глина, варирането на магнезий влияе върху свойствата на втвърдяване, както е показано в таблица 6.2 .
Таблица 6.2. Ефекти на магнезиевия оксид в NSM неопрен
| Магнезия, phr | 0 | 2 | 5 | 10 |
| Скорост на втвърдяване на ODR, 155 ° C, dN-m/5 минути | 16. | 20. | 12 | 7 |
| Муни изгаря 121 ° C, T5 мин | 15 | 20. | 19. | 30 |
| Комплект за компресия, 70 часа, 100 ° C,% | 64 | 50 | 59 | 67 |
Оптималната ниска зададена стойност при 2 phr показва, че стабилността на омрежване е най-висока при тази концентрация. Тази концентрация също така осигурява най-бързата степен на излекуване и най-изгарящата безопасност (с изключение на 10 phr). Други свойства, включително абсорбцията на вода, са относително незасегнати от вариацията на магнезий, въпреки че при 0 phr полученото силно натрупване на топлина и 1000% удължаване показват твърде ниско състояние на втвърдяване. Вторият етап на добавяне на магнезия, за разлика от нормалния ранен първи етап, забавя скоростта на излекуване без съответно повишаване на безопасността от изгаряне; Модулът M300 и дурометърът са намалени.
Вариацията на цинков оксид (магнезия при 2 phr) в диапазона от 2 до 8 phr не показва ефект върху каквото и да е свойство, с изключение на старо удължаване. Удължаването след стареене на фурната при 121 ° C значително намалява при 2 phr.
Каучукови нанокомпозити с метални оксиди като нанопълнители
9.2.6 Наночастици от магнезиев оксид
MgO наночастиците са получени по различни методи, включително зол-гел процес [97-100] и воден мокър химичен подход [101,102]. Процесът зол-гел се извършва с използване на магнезиев алкоксид като предшественик, който се обработва с етанол и се хидролизира с различни водни неорганични или органични киселини и основи [100, 103]. Хидролизата доведе до производството на Mg (OH) OR, а не Mg (OH) 2. Етапът на калциниране е важен за получаване на MgO. Рой и сътр. [104] са използвали процедурата за самоизгаряне зол-гел за приготвяне на MgO наночастици. Тази техника включва добавяне на лимонена киселина в разтвор на магнезиев нитрат [Mg (NO3) 2 · 6H2O]. Добавя се и разтвор на амоняк, за да се коригира стойността на рН до около 4. След изсушаване на разтвора материалът се калцинира, като по този начин се получават наночастици със среден размер от 20 nm до 80 nm.
Мокрият химичен подход е прост и евтин метод за получаване на MgO наночастици. При този метод разтвор на магнезиев нитрат се обработва с разтвор на амониев хидроксид, като се получава бяла утайка, която след процеса на калциниране води до наноразмерен MgO [101,102]. Също така разграждането на магнезиевите хелати и ацетат е описано от Chhor et al. [105] като икономичен метод за получаване на наномащабен MgO.
MgO, MgAl2O4, α-Al2O3, LiAlO2, LiGaO2, NdGaO3 и SrLaGaO4: Насипен растеж
2.2 Растеж на кристали
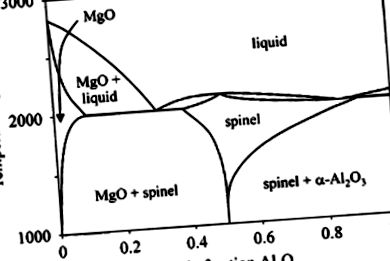
MgO показва висока температура на топене от 2827 ° C (Hallstedt, 1992) и лесно се изпарява при 3260 ° C (Kubaschewski and Alcock, 1979). При температура на топене равновесното налягане на парите е 0,22 бара. Това прави получаването на монокристали MgO по метода на Чокралски невъзможно; следователно се използват други методи като топене в студен тигел и растеж на дъгообразно сливане. MgO образува твърди разтвори с много други двувалентни или дори тривалентни метални йони, напр. Al 3+ (вижте фигура 1).
Фигура 1 . Фазова диаграма на MgO – Al2O3 (по Hallstedt, 1992). Точки на конгруентно топене (състави в мол.% Al2O3): T m MgO = 2827 ° C (0.0), T m MAO = 2105 ° C (49.9), T m Al 2 O 3 = 2054 ° C (100.0). Евтектична точка MgO/MAO: T = 1996 ° C (30.2). Конгруентна минимална течност/МАО: T = 1991 ° C (83,6).
Бътлър и сътр. (1971) използва техниката на дъгово сливане за отглеждане на монокристали за търговски цели. Други методи като химически транспорт на пари и нарастване на потока произвеждат кристали с размер само няколко милиметра. Растежът на магнезиев оксид както по хидротермален, така и по флуиден метод беше изследван и при двата метода бяха наблюдавани само повърхности. Това показва, че растежът е изотропен и проблемите, свързани с образуването на клетъчна структура при условията на конституционно преохлаждане, всъщност не се отнасят за този материал.
При метода на дъгообразно сливане не е необходим тигел, тъй като MgO прахът обикновено се уплътнява преди употреба и дъгата се удря в центъра на заряда, образувайки стопен пул, поддържан от остатъчния прах (Butler et al., 1971). Три въглеродни електроди със спектрографски клас са сближени към дъното. Газът се вкарва в областта на дъгата през аксиални отвори във всеки електрод и захранването се доставя и контролира от трифазен реактор с наситен сърцевина.
Кристалите растат като масивно тяло в дъното на сферичния контейнер. Отделните кристали в басейни от по-големи кухини обикновено са с диаметър 1–3 cm и дължина 4–6 cm. По този начин могат да се получат висококачествени монокристални MgO субстрати с площ до 4–5 cm 2. В чисти кристали MgO обикновено се наблюдава известна облачност, причинена от мехурчета. Оптичната непрозрачност (облачност, мехурчета) може значително да се намали чрез въвеждане на някои видове газове (аргон, въздух) в областта на дъгата по време на растежа на кристалите. Наличието на мехурчета е свързано с образуването на хидроксиди в резултат на реакцията между MgO и вода.
Дислокационните плътности могат да бъдат определени чрез ецване в разтвор, съставен от равни обеми наситен воден разтвор на амониев хлорид и концентрирана сярна киселина. Дислокационните плътности обикновено са 1–2 × 10 5 cm −2 в джантите и 5–10 × 10 5 cm −2 във вътрешността на кристалите. Рентгеновите люлеещи се криви, взети върху площи от няколко квадратни милиметра, показват мозаечни разпространения от 1–4 arcmin. В наши дни методът на потопената дъга е подобрен и монокристалите MgO стават търговски достъпни.
Първично производство на магнезий
1.3.1 Химична основа в магнезиев оксид като суровина
Суровината за магнезиев оксид може да се получи от (а) магнезиев хидроксид, (б) от магнезиев карбонат или (в) от доломит СаСО 3 · MgCO3. Възможно е да се получи утаен магнезиев хидроксид от морска вода - което ще изисква калциниран варовик или калциниран доломит. Калцинирането на варовик или доломит е ендотермичен процес, който протича около 1000 ° C, изразходвайки значителна енергия. Горивото или въглеродният материал, като въглища, отделя допълнително въглероден диоксид в димните газове освен въглеродния диоксид, отделен от основния минерал.
За разлика от много цветни метали е трудно да се намали магнезиевият оксид с въглерод. Карботермичната редукция на магнезиевия оксид протича над 1900 ° C.
Продуктът магнезий е в газообразно състояние, както и въглеродният окис. Това изисква специални техники за разделяне. Hansgirg разработи бързо охлаждане на газообразните смеси, заедно с други газове като водород или метан, за да предизвика кондензация на магнезий. Този процес, дори след 20 години търговски операции и разработки от Hansgirg, все още продължава да бъде труден, тъй като имаше значителни странични реакции и обратни реакции, водещи до допълнителни енергоемки схеми за пречистване.
Използването на калциев карбид като редуктор също е полезно при производството на качествен магнезий, тъй като кислородът от магнезиевия оксид се поема от калций, а не от въглерод, както е показано в уравнение [1.5], без обратни реакции, както при карботермичния подход.
Трябва да се спомене, че реакцията се провежда във вакуумни реторти.
Също така се предполага от Bleecker и Morrison, че магнезиевият оксид може да бъде редуциран при високи температури с помощта на метали като силиций или алуминий съгласно уравнения [1.7] и [1.8] (Bleecker and Morrison, 1919)
Тези реакции изискват температури по-високи от 1400–1500 ° C, за да имат стойност като реакция на атмосферното налягане. Реакциите са сложни поради образуването на междинни съединения на магнезиев ортосиликат или магнезиеви алуминати - в зависимост от редуктора. Това беше допълнително усъвършенствано, за да бъде вакуумно подпомогната реакция около 1200 ° C под формата на добре познатия процес на Pidgeon. Процесът Pidgeon допълнително установи полезността на доломита с по-ниска цена, който при калциниране ще доведе до CaO · MgO и ще образува реактанта заедно с по-евтиния феросилиций на мястото на силициевия метал. Уравнение [1.9] показва реакцията, която се провежда в евакуирани реторти.
Направени са няколко подробни проучвания относно термодинамиката на процеса на Pidgeon за това защо реакцията е възможна на основата. (Hopkins, 1954; Kubaschewski, 1967; Ray et al., 1985; Thompson, 1997). Партидният силикотермичен процес е надграден, за да бъде полунепрекъснат процес от процеса Magnetherm в началото на 60-те години, чрез превръщане на твърдия продукт силикат от Pidgeon процес в разтопена шлака чрез добавяне на алуминиев триоксид и/или алуминий. Това улеснява топенето на електрошлаки с помощта на водно охладен електрод, позволявайки непрекъснато подаване на калциниран доломит и феросилиций в стопения басейн и непрекъснато отстраняване на магнезиевите пари в големи кондензатори.
Трябва да се отбележи, че тези металотермични реакции са непреки карботермични реакции, тъй като въглеродът се използва за получаване на редуктора. Алуминият се произвежда от алуминиев оксид (електролитен метод), използвайки въглеродни аноди. Силицият и въглеродът правят силициев редуктор и въглеродни оксиди чрез електротермичен подход. Предварителното отстраняване на въглеродния оксид в газообразна форма осигурява металния редуктор, който би направил твърд или течен продукт, когато отнема кислорода от магнезиевото съединение, позволявайки на чистите магнезиеви пари да кондензират.
Керамика на основата на глинозем и цирконий за носещи приложения
Корадо Пикони,. Томаж Космач, в Разширена керамика за стоматология, 2014
11.3.1.2 Магнезия Частично стабилизиран цирконий (Mg-PSZ)
Mg-PSZ се състои от относително големи кубични зърна (напр. 40 до 70 µm в диаметър), съдържащи дисперсия на заоблени тромбоцити от тетрагонална фаза с диаметър 100 до 200 nm и дебелина от 10 до 30 nm. Типичен производствен път включва синтероване на Mg-PSZ (8-10 мол.% MgO) прахови уплътнения при около 1800 ° C (т.е. в еднофазната кубична област) и бързо охлаждане до двуфазната c + t област при около 1400 ° C. След това компактът се държи при тази температура, за да позволи зародиш и растеж на тетрагоналните утайки в кубичните зърна. След това механичните свойства при стайна температура могат да бъдат допълнително подобрени чрез второ задържане при около 1100 ° C.
Температурата на синтероване и времето на задържане, както и скоростта на охлаждане и условията на отгряване са най-критичните параметри на процеса, тъй като те контролират размера на тетрагоналните утайки, които не трябва да нарастват повече от около 200 nm. Над този праг те спонтанно ще се трансформират в моноклинната структура, като по този начин намаляват механичните свойства на продукта.
Досега Mg-PSZ никога не е бил сериозен конкурент на Y-TZP (Фигура 11.7) като биоматериал, като едно изключение е материалът Denzir-M (Decim AB, Skellefteå, Швеция), който се използва в стоматологията. Това може да звучи странно, защото Mg-PSZ е първата закалена с трансформация керамика, правена някога. Няколко критични точки вероятно са намалили интереса към Mg-PSZ като биоматериал. Взискателната и сложна технология на производство изисква точен контрол на температурата и много високи температури на синтероване. Последните са много по-високи от тези, използвани за Y-TZP, което предполага и по-високи производствени разходи, които заедно с нуждата от прахове без Si, принудиха общността да премине към Y-TZP. 51
Фигура 11.7. SEM изображение на микроструктура Y-TZP.
(От Piconi C, Rimondini L, Cerroni L, Donati C, Mutone V. La circonia in odontoiatria. Milano: Elsevier, 2008).
- Тревисто растение - общ преглед на ScienceDirect теми
- Манган - общ преглед на ScienceDirect теми
- Здраве на стадото - преглед на ScienceDirect теми
- Малтодекстрин - общ преглед на ScienceDirect теми
- Hypericum perforatum - общ преглед на ScienceDirect теми