Свързани данни
Резюме
Затлъстяването е рисков фактор за астма. Както разпространението, така и честотата на астма са увеличени при затлъстели индивиди (1–3). Освен това, както хирургично, така и индуцираната загуба на тегло намаляват симптомите на астма при пациенти със затлъстяване с астма (4, 5). Все по-добре е установено, че астмата е силно плейотропно заболяване с множество фенотипове (6). Дори в рамките на подкатегорията „астма със затлъстяване“ съществуват поне два различни фенотипа. Един фенотип включва предимно женски, неатопични субекти с късна астма. В тази група затлъстяването изглежда причиняващ фактор за астма и загубата на тегло намалява хиперреактивността на дихателните пътища (AHR) (5). Другият фенотип на затлъстела астма включва субекти с атопична астма, обикновено с ранно начало. Изглежда затлъстяването влошава симптомите на астма при тази група пациенти с астма, но изглежда не причинява тяхната астма: загубата на тегло подобрява контрола на астмата, но не намалява AHR (5).
В сравнение с пациенти, страдащи от астма, които не страдат от затлъстяване, пациентите със затлъстяване с астма не реагират добре на стандартните терапии за контрол на астмата (7-9). По-добро разбиране на механистичната основа за астма при пациенти със затлъстяване е необходимо за разработването на терапевтични средства, които са ефективни при тази популация. Такова разбиране ще изисква подходящи животински модели. Неатопичната астма е по-често при затлъстели, отколкото при слаби индивиди (10–12). Освен това, докато затлъстяването е рисков фактор за астма, то не засяга други атопични заболявания, поне не при възрастни (13). Следователно, нашата изследователска група се фокусира върху модели, при които затлъстелите мишки са изложени на неалергичен задействащ астма.
Замърсителят на въздуха озон (O3) е един от тези тригери. O3 причинява симптоми на астма, намалява белодробната функция и причинява AHR (14–16). Посещенията в спешното отделение и приемането в болница за астма са по-чести след дните на висока околна среда O3 (15, 16). Важното е, че индуцираните от O3 симптоми на астма са по-големи при затлъстели, отколкото при слаби деца (17), а индуцираните от O3 намаления в белодробната функция са по-големи при възрастни със затлъстяване и наднормено тегло, отколкото при сухи възрастни, особено когато тези субекти вече имат AHR (18, 19 ).
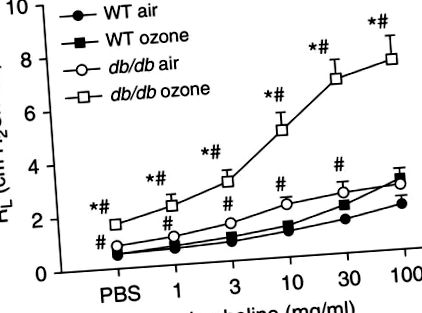
Затлъстелите мишки също показват преувеличени белодробни реакции към O3. O3 причинява повишаване на белодробната резистентност (RL) при затлъстели, но не и при слаби мишки, а индуцираният от O3 AHR е по-голям при затлъстелите, отколкото при слабите мишки (20–27) (Фигура 1). Нещо повече, наблюдава се свързано със затлъстяването увеличение на степента на A3-индуциран AHR, независимо от причината за мишкото затлъстяване. Всички следващи мишки имат увеличени отговори на O3: затлъстели ob/ob и db/db мишки, които нямат хормона на ситост лептин или неговия рецептор; Cpe мастни мишки с генетичен дефицит на карбоксипептидаза Е (Cpe), ензим, който регулира невропептидите, участващи в хранителното поведение; и мишки с индуцирано затлъстяване (28).
Схематично представяне на предложената роля на IL-33 в отговорите на затлъстели мишки на озон. AHR = хиперреактивност на дихателните пътища; CXCL1 = хемокин (C-X-C мотив) лиганд 1; ILC2 = вродени лимфоидни клетки тип 2.
Роля на TNF-α
Циркулиращите концентрации на TNF-α са повишени при затлъстяване (20, 57), а данните, получени от животински модели, показват, че TNF-α допринася за етиологията на някои състояния, свързани със затлъстяването, включително инсулинова резистентност (58–62). TNF-α може също да бъде от значение за астма при затлъстяване, тъй като затлъстяването носи по-голям риск за астма при субекти с TNF-α полиморфизми, които насърчават експресията на TNF-α, особено сред неатопични пациенти с астма (63). Екзогенното приложение на TNF-α може да индуцира AHR (64) и за TNF-α се знае, че допринася за A3-индуциран AHR при слаби мишки (65, 66). Взети заедно, тези данни предполагат, че TNF-α може да допринесе за повишаване на отговора на O3, свързано със затлъстяването. За да отговорим на тази хипотеза, ние отгледахме затлъстели Cpe мастни мишки, които са с дефицит на TNF-α (Cpe мазнини/TNF-α -/-) и сравнихме техните отговори с отговори на остра експозиция на O3 при затлъстели TNF-α-достатъчни Cpe мазнини мишки и постни мишки TNF-α -/- или WT (27). Подобни експерименти бяха проведени при Cpe мастни мишки с дефицит на TNF-α рецептор 2 (TNFR2; Cpe мазнини/TNFR2 -/- мишки) (26).
Резултатите показват сложна роля на TNF-a в увеличените отговори на О3, характерни за затлъстелите мишки. O3-индуцираното AHR и O3-индуцирано увеличение на BAL неутрофилите са по-големи в Cpe мазнините, отколкото при WT мишки (26, 27), както беше обсъдено по-горе. Дефицитът както на TNF-α, така и на TNFR2 намалява индуцираното от O3 увеличение на BAL неутрофилите при затлъстели, но не и при слаби мишки и ефективно премахва свързаните със затлъстяването разлики в набирането на неутрофили (26, 27). Данните показват, че TNF-α е необходим за усилените ефекти на острото излагане на O3 върху набирането на белодробни възпалителни клетки при затлъстели мишки. За разлика от това, дефицитът на TNF-α и TNFR2 увеличава индуцирания от O3 AHR при мишки с мазнини Cpe, въпреки че дефицитите в сигнализирането на TNF-α намаляват индуцирания от O3 AHR при слаби контролни мишки (26, 27). Тези резултати показват, че TNF-a предпазва от A3-индуциран AHR при затлъстели мишки. Те също така подчертават различните роли на TNF-α в O3 реакциите на слаби и затлъстели мишки. И накрая, тези резултати показват, че индуцираните от O3 AHR и възпалението са механично дисоциирани: неутрофилите и/или техните продукти не допринасят за индуцирания от O3 AHR при затлъстели мишки.
- Диета с високо съдържание на мазнини и висок холестерол увеличава честотата на гастрит при LDL рецептор-отрицателни мишки
- Въздействие на компютърно-медиирани, свързани със затлъстяването интервенции за обучение по хранене за юноши A
- Хетерогенност сред депата на бяла мастна тъкан при мъжки мишки C57BL6J - Sackmann ‐ Sala - 2012 -
- Диетата с високо съдържание на мазнини влошава увреждането на паметта, предизвикано от арсен при мишки, подхронично in vivo
- Обогатеното с високо съдържание на линолова киселина топлено масло (избистрено масло) увеличава антиоксиданта и