Ейми Карол Уокър
UMASS Medical School, Worcester, MA Съединени щати
Резюме
Мастният черен дроб е сложно заболяване, често придружаващо метаболитния синдром и диабет тип II. Хепатостеатозата може да има корени в множество метаболитни аномалии. Въпреки това, метаболитната дисфункция в 1-въглеродния цикъл (1CC), която произвежда метиловия донор s-аденозилметионин (SAM) и фосфатидилхолин (PC), индуцира чернодробна липогенеза в моделни системи. Човешки заболявания, при които синтезът на 1CC или PC е нарушен, като алкохолизъм, вродена липодистропия или муковисцидоза, често се срещат с мастен черен дроб. Тъй като 1CC е ясно свързан с това заболяване, от решаващо значение е да се разбере как отделните метаболити задвижват механизми, увеличаващи съхраняваните чернодробни липиди. Този преглед обобщава доказателства, които свързват 1CC с мастна чернодробна болест, заедно с данни, предлагащи механизми за повишена липогенеза или намален износ на липиди от фосфатидилхолин.
Въведение
Натрупването на липиди при метаболитни заболявания не е проблем само в мастната тъкан. Излишните мазнини в черния дроб (хепатостеатоза) също допринасят за метаболитната дисфункция, допринасяйки за инсулиновата резистентност, която води до диабет тип II [1]. Мастният черен дроб се среща при множество човешки синдроми, от алкохолно или безалкохолно мастно чернодробно заболяване (ALD или NAFLD) [2, 3] и може да присъства и при пациенти с муковисцидоза [4], тези, хранени интравенозно [5], или при пациенти с генетична липодистрофия [6]. Въпреки че физиологичните корени на мастния черен дроб не са напълно разбрани, има ясна връзка с цикъла с 1 въглерод или фолиева киселина (1CC), тъй като мутациите или лекарствата, засягащи ключови ензими, водят до хепатостеатоза [7].
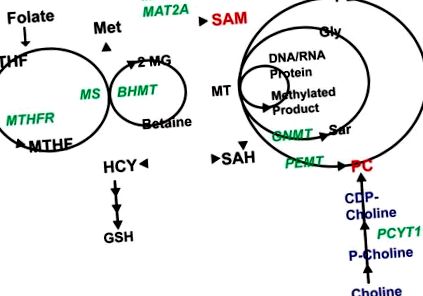
Цикълът с 1 въглерод (1CC) се състои от множество взаимно свързани пътища. Фолатът навлиза в цикъла, водещ до превръщане на MTFH (метил тетрахидрофолат) в метионин чрез MS (метионин синтаза). Метионинът се използва за получаване на SAM, който може да се използва от MT за производство на метилирани протеини (включително хистони), нуклеинови киселини, фосфатидилхолин (PC) или метаболити като саркозин (Sar). Страничният продукт от тези реакции, s-аденозилхомоцистеин (SAH), може да се използва за регенериране на метионин. Хомоцистеинът (HCY), който се произвежда по време на процеса на преобразуване, също може да бъде пренасочен към производството на глутатион (GSH). Ензимите, обсъдени в текста, са в зелено, ключовите метаболити в червено.
Ензими: MTHFR (метил тетрахидрофолат редуктаза), MS (метионин синтаза), MAT (метионин аденозил трансфераза), BHMT (бетаин хидрокси метилтрансфераза), GMNT (глицин n-метилтрансфераза), PEMT (фосфатидифтохлорметилтрансферантитрафенпрофенпрофенпрометилпропилметилфенолтрансформантрантетраламин метилтрансформантрансформантратилатметилтрансформантратилатметилтрансформантратилатметилтрансферантрансформантранфеналтранфеналтранфеналтрантетраламин ензими. Метаболити: THF (тетра-хидрофолат), MTHF (метил тетра-хидрофолат), HCY (хомоцистеин), Met (метионин), GSH (глутатион), SAM (s-адозилметионин), SAH (s-аденозил хомоцистеин), PE (фосфатидилетаноламин) ), Gly (глицин), Sar (саркозин), 2-MG (2-метил глицин), MT (метилтрансфераза).
маса 1
Важни метаболити, процеси и физиологични ефекти на 1CC.
| SAM | Производство на компютър | Човек, мишка C. elegans, дрозофила | Черен дроб Черен дроб Черво S2 клетки | [10] |
| Производство на спермидин | Мишка | Чернодробна мастна | [32] | |
| Метилиране на хистон | Човек |
Нивата 1CC, PC и затлъстяването на черния дроб при човешки заболявания
Връзката между метаболитните пътища, свързани с метилирането и мастната чернодробна болест, е отбелязана през 30-те години на миналия век, когато д-р Винсент дю Виньо открива, че гризачите, хранени с диета с дефицит на метилови групи, развиват мастен черен дроб [13]. Понастоящем алкохолната и безалкохолната стеатоза имат добре дефинирани връзки към 1CC [8, 14]. Консумацията на алкохол предизвиква 1CC функция на множество нива. Първо, етанолът инхибира експресията на ключови ензими по пътя [15], намалявайки функционалната мощност на 1СС. Второ, диетичните фолати често не се поглъщат на препоръчаните нива, адсорбцията/съхранението на фолати се намалява и отделящата се продукция се увеличава [15]. Диетичните добавки с бетаин или SAM са предложени като терапевтични интервенции при това заболяване [15].
Натрупването на 1CC, Low-PC и липиди в животински модели
Миши модели
Ако производството на PC е връзка за стимулиране на чернодробното натрупване на липиди, мастният черен дроб също трябва да се появи в модели, при които синтезът се инхибира директно. Всъщност интерференцията с нивата на PC чрез зависими от метилирането или независими пътища на синтез води до натрупване на чернодробни липиди (прегледано в [11, 30]). Както бе споменато по-горе, PC е свързан с 1CC чрез активността на PEMT, който използва SAM в три последователни реакции на метилиране, за да произведе PC от PE [11]. Тъй като метилозависимото производство на PC е преобладаващо в черния дроб, PEMT нокаутите на цялото тяло могат да се използват за изследване на физиологичните роли на мишките. Въпреки това, фенотипите на PEMT -/- мишките бяха сложни. Първо, синтезът по пътя на Кенеди компенсира производството на компютър на диета с чау [12]. Предизвикателството на тези животни с диета с недостиг на холин, от друга страна, доведе до натрупване на чернодробни липиди и бърза чернодробна недостатъчност [12].
Синтезът на компютър по пътя на Кенеди е от съществено значение за жизнеспособността; мишки без лимитиращ скоростта ензим Холин-фосфат цитидилилтрансфераза А (PCYT1a, известен също като CCT/CTa) умират рано в ембрионалното развитие [31]. Въпреки това, мишките с тъканно специфични делеции в PCYT1a също натрупват чернодробни липиди. Jacobs, et al. създаде специфичен за черния дроб нокаут на PCYT1a и установи, че въпреки че PEMT-зависимото производство на PC се е увеличило 2 пъти, PC също е намалял, докато TAG се е увеличил [31]. По този начин и двата директни блока в PC синтеза или намаляването на PC след ефектите върху SAM и 1CC функцията имат дълбока връзка с липидното натрупване в миши модели на чернодробно заболяване.
1CC може също да бъде свързан с липидно натрупване в адипоцити чрез алтернативни механизми. Кан и колеги са установили промени в няколко метаболита, свързани с 1CC в бяла мастна тъкан (WAT) от затлъстели мишки. Те открили, че използването на SAM от ензима никотинамид n-метилтрансфераза (NMNT) влияе върху метаболизма на полиамина. Синтезът на полиамини, които са важни за енергийния метаболизъм, също консумира SAM и нивата им падат, тъй като NMNT използва наличните донори на метил [32]. Авторите показват, че намаляването на NMNT в WAT и чернодробната тъкан увеличава енергийните разходи при затлъстели мишки, тъй като нивата на SAM нарастват и синтезът на полиамин се възстановява [32].
Безгръбначни модели
Взаимодействията между 1CC, PC и липогенезата също са интензивно изследвани в модели на безгръбначни, където генетичните екрани или други безпристрастни инструменти са допринесли значително за нашето разбиране. В новаторско проучване Guo и съавтори извършват siRNA скрининг в клетки на Drosophila S2 за модулатори на образуването на липидни капчици и класифицират резултатите според техния размер и морфология [33]. От този екран, ензимите за биогенеза на PC са определени като ключови играчи при образуването на големи липидни капчици, заедно с гени с важна роля в липогенезата (Drosophila melanogaster SREBP) и тези, за които по-късно е доказано, че имат важна механистична роля в образуването на липидни капчици (ARF1/COP 1 компоненти) [33].
Caenorhabditis elegans също се оказа важен модел за разбиране на връзките между 1CC и липогенезата, въпреки че два аспекта на пътя на бозайниците са не напълно запазени. Първо, етапите на метилиране, произвеждащи PC, се случват по-рано по пътя, превръщайки фосфо-етаноламин във фосфо-холин, както при растенията [34]. Второ, изглежда, че C. elegans липсва BHMT ортолог, което предполага, че холинът не може да се използва като донор на метил [35] и би допринесъл само за PC синтеза чрез пътя на Кенеди. Въпреки това, блокирането на 1CC чрез инактивиране на SAM-синтазата sams-1 или директна намеса в производството на PC чрез RNAi на фосфо-етаноламин метилтрансферазата pmt-1 или pmt-2 имат ясни ефекти върху липогенезата; увеличаване на видимите липидни капчици и съхраняваните TAG, които могат лесно да бъдат спасени, когато пътят на Кенеди се поддържа чрез диетичен холин [36]. Интересното е, че C. elegans трябва да синтезира всички РС, необходими за растежа и размножаването, тъй като лабораторният източник на храна, Е. coli, няма този мембранен фосфолипид [37]. Способността да се използват безпристрастни генетични екрани при Drosophila и C. elegans подобри нашето разбиране за механизмите, предизвикващи липидно натрупване, когато 1CC е нефункционален.
Механизми на ниско-PC действие върху липогенезата: самият PC или метаболити надолу по веригата?
1CC (1-въглероден цикъл) има множество връзки с натрупването на липиди в черния дроб. SAM, основният донор на метил, може потенциално да повлияе на генната експресия, ако моделите на метилиране на хистон или ДНК са чувствителни към нивата на SAM. Освен това, чрез промени в нивата на фосфатидилхолин (PC), активирането на SREBP-1-зависими гени за липогенеза или LHR-1 зависими гени за износ на жлъчка може да повлияе на натрупването на липиди в черния дроб. И накрая, по-ниските нива на PC също могат да ограничат износа на липопротеинови частици, увеличавайки общите чернодробни липидни нива.
1CC (1-въглероден цикъл), PC (фосфатидилхолин), LHR-1 (чернодробен хомологичен рецептор 1) SREBP-1 (стерол регулаторен елемент, свързващ протеин -1), VLDL (липопротеин с много ниска плътност), LHR-1 (хомолог на чернодробните рецептори 1).
Като структурен компонент на клетъчните мембрани, метаболитен предшественик на други липиди, субстрат за фосфолипази и лиганд за ядрени хормонални рецептори, нивата на PC могат да повлияят на различни клетъчни механизми [30]. Ранните проучвания предполагат, че намаляването на диетичния метионин или холин повлиява секрецията на липопротеинови частици като VLDL [11]. По-късни миши модели, насочени към производството на РС по пътя на Кенеди [31] или чрез метилиране на РЕ [43], установяват, че секрецията на VLDL намалява и в двата случая, улавяйки липопротеинови частици, натоварени с TAG в черния дроб. Авторите показват в отделно проучване, че VLDL частиците имат необичайно ниски съотношения PC/PE и наблюдават деградация в отделението след ендоплазмен ретикулум [44]. Не беше ясно обаче, че ниските ефекти на РС се дължат на непълно образуване на мембрана в липопротеиновите частици или ако може да повлияе и на сигналните компоненти, контролиращи секреторните процеси.
SREBP са важни регулатори на експресията на липогенни гени, но други транскрипционни фактори също регулират липогенните гени и могат да бъдат повлияни от PC чрез различни механизми. Ядрените хормонални рецептори, като хомолог-1 на чернодробните рецептори (LRH-1), са вътреклетъчни рецептори, които се превръщат в активни транскрипционни регулатори при свързването на лиганда [54]. NHRs могат да свързват различни лиганди, но е доказано, че два NHRs, които могат да действат в черния дроб, свързват специфични видове PC. PPARα има добре установена роля като регулатор на окисляването на мастните киселини, липидния транспорт и глюконеогенезата [55] и е цел на терапевтичните средства [56]. Лабораторията на Semenkovich използва тандемна масспектрометрия за идентифициране на ендогенни лиганди за PPARα в черния дроб на мишката и установява, че специфичен вид фосфатидилхолин (16: 0/18: 1 GPC) е свързан с активния транскрипционен фактор [57]. Генерирането на този лиганд изисква не само синтаза на мастни киселини (FAS), но и непокътнатия път на Кенеди, показващ, че е необходим PC синтез. Тъй като увреждането на PPARα намалява β-окислението и измества клетката към съхранена енергия [57], по този начин намалените нива на този лиганд също могат да допринесат за съхранението на липидите в черния дроб.
Неотдавнашно проучване показа, че LRH-1 също е от решаващо значение за експресията на 1CC гени, повлиявайки развитието на хепатостеатоза при диета с изчерпване на метил-донори [62]. Вагнер и сътр. установи, че мишките с дефицит на LRH-1 са защитени от затлъстяване на черния дроб при диети с дефицит на метионин-холин и че намаляването на SAM и PC, възникващо при тези диети, е притъпено [62]. Освен това те откриват, че LRH-1 е директен транскрипционен регулатор на Gmnt1 [62], ензим, който консумира излишни метилови групи и че местата за свързване на LRH-1 са разположени в промоторите на много 1CC гени [63]. По този начин LRH-1 може да бъде важен регулатор на нивата на донорите на метил в черния дроб. И накрая, авторите заявяват, че лигандът за LRH-1, DLPC, не е вероятно да бъде синтезиран чрез пътя 1CC-PEMT [62], което предполага, че в този случай веригата за обратна връзка не е вероятна. LHR-1 обаче представлява интригуваща връзка между нивата на 1СС метаболити и натрупване на липиди в черния дроб.
Заключителни бележки и бъдещи перспективи
1CC има много роли в клетката, допринасяйки за нуклеотиден синтез, окислително-възстановителна защита, хистон/ДНК метилиране и фосфолипиден синтез [8]. Промените във функцията на 1CC са силно свързани с натрупването на чернодробни липиди [11], но разбирането кои 1CC метаболити влияят на този процес и как те пряко въздействат върху клетъчните механизми се появява едва сега. Дешифрирането на молекулярните механизми, движещи развитието на метаболитни заболявания, има допълнителното предизвикателство да се определи как метаболитите влияят пряко върху сигналните и транскрипционни механизми или функцията на органелите. Проучвания, изследващи функцията 1CC и липогенезата, са идентифицирали множество механизми, които могат да допринесат за излишното съхранение на липиди в черния дроб, когато 1CC метаболитите или PC са ниски, от контрол на ядрените хормонални рецептори, необходими за износа на липиди, до активиране на транскрипционни фактори, активиращи програмата de novo липогенеза. От решаващо значение е да се добавят повече механистични подробности към тези модели, да се разберат други физиологични ефекти от 1СС дисфункция и да се определи дали тези механизми действат съгласувано или са достатъчни, за да причинят чернодробно заболяване сами. По този начин можем да започнем да разбираме как се развива хепатостеатозата и как да разработим нови инструменти за нейното лечение.
Кутия с неизпълнени въпроси
Как отделните метаболити влияят на молекулярните механизми? В случай на липиди като фосфатидилхолин, има ли първични ефекти чрез мембранната структура, взаимодействието на специфични видове PC с транскрипционни регулатори или афектите идват, тъй като нивата на липиди, получени от PC, се променят? В случая на SAM какви промени в метилирането са тясно свързани с нивата на SAM? Освен това, кои промени в метилирането на хистона или ДНК са достатъчни, за да променят експресията на липогенни гени?
Кои физиологични ефекти на PC са свързани с общите промени в този клас липиди или големи групи видове и кои се дължат на промени в няколко или отделни видове?
Какви са процесите, които регулират производството на 1-въглероден цикъл или нивата на PC? Достатъчни ли са хранителните промени, за да се променят нивата на SAM или PC по физиологично значим начин? Какви промени в околната среда също могат да причинят смущения?
Кутия за тенденции
Ниските нива на метаболити на 1 въглероден цикъл или на метилирания фосфолипид фосфатидилхолин (PC) съпътстват натрупването на липиди при безгръбначни модели, черен дроб на гризачи и човек.
Нивата на s-аденозилметионин (SAM), основният донор на метил, и PC имат най-силните връзки като ефектори на мастния черен дроб.
SAM-зависимото метилиране на ДНК или хистон може да има ефект върху генната експресия.
Ниският PC може да повлияе на сигнализирането, контролиращо вътреклетъчния транспорт, активирайки липогенния транскрипционен фактор (SREBP-1). Освен това са необходими специфични PC изоформи за активиране на рецептор на ядрен хормон (LRH-1), който стимулира износа на жлъчна киселина от черния дроб.
Благодарности
Благодарим на д-р Йосиф Вирбасий за критичното четене на ръкописа. A.K.W. се поддържа от R01 DK084352. Извиняваме се на онези, чиято работа не е цитирана поради краткостта на рецензията.
Бележки под линия
Отказ от отговорност на издателя: Това е PDF файл на нередактиран ръкопис, който е приет за публикуване. Като услуга за нашите клиенти ние предоставяме тази ранна версия на ръкописа. Ръкописът ще бъде подложен на редактиране, набиране и преглед на полученото доказателство, преди да бъде публикуван в окончателния си вид. Моля, обърнете внимание, че по време на производствения процес могат да бъдат открити грешки, които биха могли да повлияят на съдържанието, и всички правни откази от отговорност, които се отнасят до списанието, се отнасят до.
- Основан на доказателства преглед на употребата на статини при пациенти с безалкохолна мастна чернодробна болест
- Ръководство за дебел дроб на супата от броколи с детокс
- Анализ на експресионните спектри на piRNA в модел на мишка без алкохолна мастна чернодробна болест, индуциран от
- 12 стратегии за отстраняване на мастни чернодробни заболявания - пазари на начин на живот
- Благоприятни ефекти на китайските билки при лечението на мастни чернодробни заболявания - ScienceDirect