Сандра Джей Питърс
1 Факултет по приложни здравни науки, Университет Брок, Сейнт Катринс, Онтарио, Канада L2S 3A1
Paul J LeBlanc
1 Факултет по приложни здравни науки, Университет Брок, Сейнт Катринс, Онтарио, Канада L2S 3A1
Това е статия с отворен достъп, разпространявана при условията на лиценза за приписване на Creative Commons (http://creativecommons.org/licenses/by/2.0), която позволява неограничено използване, разпространение и възпроизвеждане на какъвто и да е носител, при условие че оригиналното произведение е правилно цитиран.
Резюме
След диета с ниско съдържание на въглехидрати има промяна към повече мазнини и по-малко окисляване на въглехидрати, за да се осигури енергия на скелетните мускули, както в покой, така и по време на тренировка. Този преглед обобщава неотдавнашната работа върху човешките скелетни мускулни въглехидратни и мастни метаболитни адаптации към диета с ниско съдържание на въглехидрати, като се фокусира главно върху пируват дехидрогеназа и пируват дехидрогеназа киназа и как тези промени са свързани с капацитета за окисляване на въглехидратите по време на тренировка.
Преглед
Източниците на химическа енергия, която задвижва скелетните мускули, са достъпни чрез ендогенни депа (интрамускулен гликоген и триглицериди) или екзогенни източници (плазмена глюкоза и свободни мастни киселини). На свой ред тези екзогенни и ендогенни източници на гориво се попълват чрез хранителен прием. В резултат на това съществува важна връзка между диетата и метаболизма на горивата в скелетните мускули.
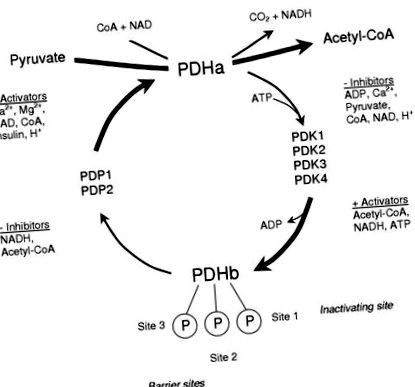
Диетите с ниско съдържание на въглехидрати стават все по-популярни като метод за отслабване. Тези диети, които ограничават дневния хранителен прием на въглехидрати, се наричат нисковъглехидратни диети (LCD). Когато се оценяват ефектите на LCD, трябва да се имат предвид няколко фактора, тъй като те могат да повлияят на измерения резултат. Те включват състава на диетата (тъй като LCD може да замести липсващите СНО с протеини или мазнини) и продължителността на диетичния период. За целите на този преглед LCD ще се отнася предимно до изокалорични диети с високо съдържание на мазнини с ниско съдържание на въглехидрати с фиг. 1) 1) Тъй като е силно регулиран, той играе ключова роля при определяне на дела на ацетил-CoA, който се получава от въглехидратни източници, като по този начин регулира потока чрез въглехидратно окисление и индиректно определя степента на окисляване на мазнините. Количеството PDH в активната му форма (PDHa) определя неговата активност и регулирането се постига чрез обратимо фосфорилиране, катализирано от присъщата PDH фосфатаза (PDP), която дефосфорилира и активира PDH, и PDH киназа (PDK), която фосфорилира и инхибира PDH [5]. Е1 субединицата на PDH има три известни места на фосфорилиране, като първото място е необходимо за инактивиране на комплекса, а другите две места действат като бариерни сайтове, които възпрепятстват активирането на фосфатазата [6].
Активиране на контрола на ензимен комплекс на пируват дехидрогеназа чрез цикъл на фосфорилиране и дефосфорилиране.
Всеки от ковалентните регулаторни ензими на PDH е обект на алостерична регулация. Фосфорилирането на комплекса се катализира от семейство от четири PDK изоформи (PDK1-4), които се различават по своята реакция на алостерично инхибиране чрез пируват или активиране чрез енергиен заряд (съотношение ATP/ADP), редокс (NADH/NAD + съотношение) и съотношение ацетил-CoA към свободно CoA (вж. [7] за преглед). Освен това киназите се различават по своята специфичност за различните места на фосфорилиране [7]. По този начин относителните дейности на популацията на PDK изоформа ще определят отговора на комплекса PDH в остри ситуации. Вътрешна двойка фосфатази (PDP1 и 2) катализира дефосфорилирането и активирането на PDH [8]. PDP1 е изоформата, която се активира в присъствието на нарастващи концентрации на Ca 2+ йони (както би се очаквало по време на тренировка), докато PDP2 се активира, когато нивата на инсулин се повишат по време на диетични манипулации [8].
В покой PDH е основно фосфорилиран и неактивен поради високо енергийно зареждане, редокс и съотношение ацетил-КоА към свободно CoA и ниска концентрация на пируват, които поддържат висока PDK активност. Активността на фосфатазата е ниска в покой, поради ниските интрамускулни нива на Ca 2+. По време на тренировка, освобождаването на Ca 2+ от саркоплазмения ретикулум е основният стимул, който грубо активира PDH, докато промените в концентрацията на пируват, енергийния заряд и евентуално редокс фино настройват това активиране (вж. [9] за преглед), за да съответства на PDH активиране към търсенето на CHO окисляване [10].
В допълнение към важността на интрамитохондриалните ефектори за острото регулиране на активирането на PDH през първите няколко секунди или минути, дългосрочни или хронични промени в състоянието на активиране на PDH могат да бъдат постигнати чрез стабилни промени в абсолютните нива на PDK и/или PDP. Скоростта на активиране на PDH зависи от съотношението на активност на PDK и PDP и промените в експресията на ковалентния модификатор биха променили скоростта на активиране или инактивиране на PDH. Тези хронични промени се случват в продължение на часове или дни и не зависят от остри промени в интрамитохондриалните ефекторни концентрации.
Ефекти от нисковъглехидратната диета
Скелетна мускулатура пируват дехидрогеназа в активната си форма (PDHa) в покой и по време на тренировка при диети с ниско съдържание на въглехидрати (LCD) и високо съдържание на въглехидрати (HCD). * означава значение от LCD. Адаптирано от Putman et al. [11].
Последващи проучвания показват адаптивни промени на нивото на PDK с произтичащи промени в активирането на PDH. Активността на PDK се повишава адаптивно в скелетните мускули на човека след 6 дни на LCD [12] (Фиг. (Фиг. 3). 3). Активността на PDK се увеличава само за 24 часа и продължава да нараства линейно по време на 6-дневната диета [13]. Повишената активност на PDK в скелетните мускули на човека е свързана с повишена експресия на иРНК на PDK4 и протеини, която е била максимално увеличена след 24 часа [13]. Тези проучвания предполагат селективно увеличаване на експресията на PDK4 с LCD. Увеличението на активността на PDK по време на LCD е свързано с нарушен глюкозен клирънс от кръвта в отговор на орално натоварване с глюкоза при здрави млади мъже [14]. След само 56 часа на LCD, 90-минутната зона под кривите на концентрацията на глюкоза в кръвта и плазмата в зависимост от времето се увеличи съответно 2 пъти и 1,25 пъти по време на орален тест за толерантност към глюкоза [14].
Активност на пируват дехидрогеназа киназа (PDK) по време на шест дни на LCD. a Значително различен от ден 0. b Значително различен от ден 1. Адаптиран от Peters et al. [12,13].
Тези повишени нива на PDK4 протеин и PDK активност ще се очаква да направят комплекса устойчив на активиране по време на тренировка, както се наблюдава от Putman et al. [11] поради две причини: 1) повишено фосфорилиране на много места на PDH комплекса и/или 2) намалена чувствителност на комплекса към регулиране от пируват. Повишената активност на PDK би могла да засили фосфорилирането на много места на субединицата Е1 и да направи комплекса по-устойчив на дефосфорилиране и активиране от фосфатазата [6]. При нормални диетични условия преобладаващата изоформа в скелетните мускули на човека е PDK2, която има по-голям афинитет към фосфорилиране на място 1 (инактивиращото място) на Е1 субединицата [15-17]. Тъй като обаче популацията на PDK4 изоформа се увеличава, ще има засилено фосфорилиране на второто (бариерно) място, тъй като тази изоформа има по-голям афинитет както към сайт 1, така и към сайт 2 [15-17]. Освен това PDK2 има по-голяма чувствителност към инактивиране от пируват, отколкото PDK4 [18]. По този начин в началото на упражнението с повишен гликолитичен поток, повишените нива на PDK4 протеин биха направили комплекса по-устойчив на активиране поради повишената активност на PDK4 киназа дори в лицето на повишени концентрации на мускулен пируват [19].
Объркващ фактор в проучването на Putman е, че субектите са били подложени на интензивни протоколи за изчерпване на гликоген преди двете диетични интервенции, така че първоначалните нива на използване на гликоген и гликоген в скелетните мускули са значително по-ниски след LCD [11]. В последващо проучване субектите бяха помолени да се въздържат от интензивни упражнения през цялото проучване и LCD (
3% въглехидрати) е сравнено със смесена диета (
55–60% въглехидрати) вместо диета с високо съдържание на въглехидрати [20]. Субектите следват всяка 6-дневна диетична интервенция с 30 минути упражнения при малко по-малко натоварване (65% VO2max). Целта на проучването беше да се съпостави възможно най-точно използването на гликоген по време на тренировка между двете проучвания. Въпреки че първоначалната концентрация на гликоген в скелетните мускули все още е била
50% по-ниско в LCD в сравнение със смесената диета, използването на гликоген в скелетните мускули и натрупването на пируват са сходни по време на 30-минутно упражнение и в двете проучвания. За разлика от атенюираното активиране на PDHa в началото на упражнението, което се наблюдава в изследването на Putman [11], тези автори отбелязват, че активирането по време на тренировка е идентично между двете условия. По този начин, въпреки факта, че се очаква PDK активността и PDK4 изоформата да се увеличат в подобна степен като предишните проучвания [13], тези ефекти са отменени, когато първоначалните нива на гликоген в мускулите са по-високи и гликолитичният поток към пируват се поддържа [20] . От тези проучвания става ясно, че интензивността и продължителността на упражнението играят роля в регулаторните промени, наблюдавани по време на тренировка след LCD. Тъй като интензивността на упражненията се увеличава, търсенето на мускулна и чернодробна гликогенолиза и окисляване на мускулни въглехидрати се увеличава. Тези запаси не се попълват напълно след много нисковъглехидратна диета и поради това по време на интензивни тренировки гликогенолитичният поток и активирането на PDH намаляват след LCD.
Ефект на състава на мастните киселини при диета с ниско съдържание на въглехидрати
Изследванията, представени в този преглед, показват, че LCDs намаляват активирането на PDH в скелетните мускули в покой и по време на тренировка, медиирано чрез повишена активност на PDK и експресия на изоформа. Не всички LCD обаче са създадени еднакво и нараства интересът към състава на консумираните мастни киселини. Наскоро беше доказано, че само заместването
12% от мазнините в LCD (
Активност на пируват дехидрогеназа киназа (PDK) преди и след три дни на LCD със и без n3 мастни киселини. a Значително различен от предварителната диета. b Значително се различава от диетата след LCD. Адаптирано от Turvey et al. [21].
Ефект от повторното хранене на въглехидрати след диета с ниско съдържание на въглехидрати
При хората има малко информация за това колко бързо може да се обърне приспособеното към LCD увеличение на активността на PDK и протеина PDK4 с повторно хранене с въглехидрати. Повечето проучвания за повторно хранене използват продължително гладуване като смущение и е направена много малко работа върху човешките скелетни мускули. При гризачи ранните проучвания на сърдечния мускул показват, че повторното хранене след 6 часа глад възстановява активността на PDHa до
75% от нормалните нива само за 1-2 часа. Тъй като обаче продължителността на периода на гладуване се увеличава, ходът на реакцията на повторното хранене е по-дълъг, така че след 48 часа глад активността на PDHa се възстановява само до
25% от контролните стойности след 4 часа [24]. В по-късни проучвания върху гризачи тази нарастваща резистентност към активиране на PDH комплекс е придружена от повишена активност на PDK, което корелира с продължителността на бързата или високомаслена диета [25,26]. След 48 часа гладуване и повторно хранене, PDK активността и PDK4 протеинът в скелетните мускули намаляват
50–60% за приблизително 4 часа повторно хранене [27]. Въпреки това, малко е известно за обръщането на времевата активност на PDK и експресията на PDK изоформа след LCD в скелетните мускули на човека.
Регулиране на окисляването на мазнините чрез диета с ниско съдържание на въглехидрати
Има малко информация относно адаптацията на скелетните мускули от "мастната страна" към LCD. В човешките скелетни мускули повечето проучвания ограничават измерванията си до генна експресия или концентрации на иРНК на съответните ензими, участващи в окисляването на мазнините, и много малко са измервали по-физиологично значимите концентрации на ензимна активност или концентрация на протеин. И все пак има доказателства в скелетните мускули на човека за повишена активност на няколко регулаторни ензими и протеини в усвояването и окисляването на мастните киселини в скелетните мускули след диети с високо съдържание на мазнини или LCD. Основните стъпки включват доставяне на мастни киселини до мускулите чрез мускулна липопротеинова липаза (LPL), сарколемални транспортери на мастни киселини и плазмено-мембранни протеини, свързващи мастни киселини (FAT/CD26 и FABPpm съответно), поемане и окисляване на митохондрии чрез карнитин палмитоил трансфераза I (CPT I ), бета-окисление на мастни киселини (маркерен ензим β-хидрокси ацил КоА дехидрогеназа (β-HAD)) и общ оксидативен капацитет (маркер ензим цитрат синтаза (CS)).
В отговор на 4-седмична адаптация към високо съдържание на мазнини (
62% мазнини) умерен LCD (
20% CHO), активността на LPL на скелетните мускули се е увеличила почти 2 пъти, увеличавайки наличността на мастни киселини в мускула и увеличавайки значително съдържанието на мускулни триглицериди [30]. По отношение на усвояването на мастните киселини в мускулите, има доказателства, че FAT/CD36 протеинът и mRNA са се увеличили умерено (1,25 пъти) само след 5 дни на умерен LCD (20% CHO), докато експресията на гена FABPpm и съдържанието на протеин не са били засегнати от диетата [31]. Като цяло, мускулното усвояване на мастни киселини и липопротеиновите триглицериди с много ниска плътност, както и окислението на мастните киселини в плазмата са по-високи по време на тренировка след богат на мазнини LCD (21% CHO), когато тренировъчното упражнение се комбинира с диетичното смущение [32].
В проучвания при хора, скелетните мускули CPT I не се влияят от LCD. Това беше демонстрирано на нивото на максимална ензимна активност след 6 d LCD (
- Метаболитни ефекти на диетите с много ниско съдържание на въглехидрати Неразбраните злодеи на човешкия метаболизъм
- Метаболитни горива и затлъстяване Въглехидратен и липиден метаболизъм в скелетната мускулатура и мастната тъкан
- Наука зад диетозната кетоза на Dukan, ограничаване на въглехидратите и метаболитни ефекти; Диета на Дюкан
- Част 2 Може ли кетогенните диети с ниско съдържание на въглехидрати да инхибират рака Експериментирайте
- Метаболитни и тестикуларни ефекти от дългосрочното приложение на различни високомазнинни диети през