Резюме
Заден план
Чревната микробиота и гостоприемникът съществуват в мутуалистична връзка, като функционалният състав на микробиотата влияе силно върху здравето и благосъстоянието на гостоприемника. Поради това е важно да се разработи синтетичен подход за едновременно изучаване на транскриптома на гостоприемника и микробиома. Ранната микробна колонизация при кърмачета е от решаващо значение за насочване на новороденото чревно и имунно развитие и е особено привлекателна за изучаване на развитието на взаимодействията човек-коменсал. Тук отчитаме резултатите от едновременно изследване на чревния микробиом и транскриптома на епитела на гостоприемника на тримесечни кърмачета и кърмачета, хранени с адаптирано мляко.
Резултати
Наблюдавани са вариации както в експресията на тРНК на гостоприемника, така и във микробиомния филогенетичен и функционален профил между кърмачета и кърмачета. За да се изследва взаимозависимата връзка между генната експресия на епителни клетки на гостоприемника и профилите, базирани на бактериални метагеноми, данните за транскриптома на гостоприемника и функционално профилираните микробиоми бяха подложени на нови многовариантни статистически анализи. Характеристиките на вирулентността на метагеном на чревната микробиота варират едновременно с свързаната с имунитета генна експресия в епителните клетки между кърмените с кърма и кърмените бебета.
Заключения
Нашите данни дават представа за интегрираните отговори на гостоприемния транскриптом и микробиома към хранителни субстрати в ранния неонатален период. Ние демонстрираме, че разликите в диетата могат да повлияят чрез колонизация на червата върху експресията на гостоприемник на гени, свързани с вродената имунна система. Освен това, методологията, представена в това проучване, може да бъде адаптирана за оценка на други взаимодействия гостоприемник-коменсал и гостоприемник-патоген, като се използват геномни и транскриптомни данни, като се предоставя синтетична геномна картина на взаимоотношенията гостоприемник-коменсал.
Заден план
Чревната микробиота има дълбоки ефекти върху здравето и здравето на гостоприемника. Например, проучвания при прасенца без микроби ясно илюстрират променен чревен растеж [1], активност на храносмилателните ензими [2] и развитие на свързаната с червата лимфоидна тъкан [3]. Изследванията на молекулярно ниво, разрешени от метагеномни, метатранскриптомични и метапротеомични аналитични техники, преоформят нашето разбиране за това как чревният микробиом модулира стомашно-чревното морфологично, имунното развитие [1–4], генната експресия [5] и биологията на гостоприемника като цяло [6, 7]. Въпреки че много проучвания показват ефект на диетата върху микробиотата на бебето [8–10], малко се знае за кръстосания разговор на ниво геном и транскриптом между развиващите се черва на бебето и колонизиращата микробиота. При раждането чревният тракт на човешкото бебе е функционално незрял и стерилен. Съответно ранният неонатален период е критична фаза както за храносмилателното развитие на червата, така и за колонизацията от коменсалната микробиота.
Резултати
За проучването са назначени общо шест майки на бебета с BF и шест майки на деца с FF. Накратко, проби от изпражнения от всяко бебе са събрани и микробната ДНК е извлечена и секвенирана. В допълнение, иРНК е изолирана от изпражнения, съдържащи ексфолирани клетки на червата на гостоприемника и обработена за анализ на микрочипове [12]. Тези две едновременни операции предоставиха суровите микробни метагеномни и транскриптомни данни на хоста. Впоследствие анализирахме данните за последователността и микрочиповете независимо и след това едновременно, за да идентифицираме многовариантни корелации между транскриптома на чревния епител и микробния метагеном. Процедурата е описана в Допълнителен файл 1 (вж. Материали и методи за подробности). Както е показано в Таблица 1, данните за бебета и майки са били подходящо балансирани при FF и BF бебета.
Ефект на диетата върху транскрипционните отговори на гостоприемника
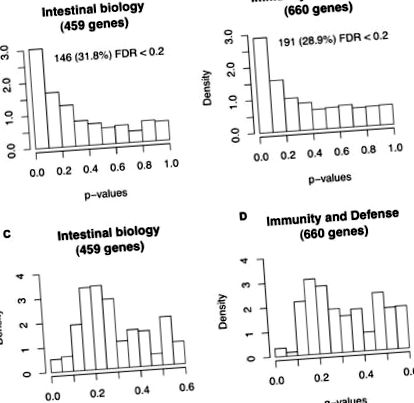
Както е показано в Допълнителен файл 2, като цяло, пробите от клетъчни клетки FF показват по-ниски стойности на генна експресия спрямо BF проби от гостоприемни клетки. Тези данни са в съответствие с проучване на маймуна резус, при което храненето с формула за регулиране на цялостната експресия на чревния ген в сравнение с маймуните на кърмачки [14]. Гени от две подгрупи данни - 459 гена, свързани с чревната биология и 660 гени, свързани с имунитет и защита - бяха тествани за диференциална експресия между BF и FF новородени, използвайки пермутационен тест с честота на фалшиво откриване (FDR) [15] корекция на множество тестове. Както се вижда на Фигура 1, очакваните гени априори да бъдат отзивчиви към диетата са обогатени за диференциално изразяване. Това предполага нашето априори знания, позволени за откриване на съответните гени. Като последващо изследване, 146 от 459 гена на чревната биология и 191 от 660 гена на имунитет и отбрана, показващи Q-стойност на FDR Фигура 1
Ефект на диетата върху чревния микробиом
Таксономичен анализ
Както се вижда на Фигура 2а, б, има значителни разлики в таксономичното разпределение на идентифицируемата 16S rRNA в FF и BF бебешка микробиота. Детската микробиота на FF е много хомогенна в разпределението на ниво филум. По-конкретно, имаше приблизително еднакъв дял на Firmicutes и Actinobacteria (около 40% всеки), а останалите бактерии, съставени предимно от протеобактерии. Една бебешка микробиота на FF е явно отклонена и е доминирана от Actinobacteria. За сравнение, BF бебетата са много по-разнородни по отношение на техния състав. Микробиотата на три бебета с BF е била доминирана от Actinobacteria, едно е било доминирано от Proteobacteria, едно е било доминирано от Bacteroidetes, а едно е било много балансирано във филата. Както се вижда на фигура 2в, с изключение на отдалечената микробиота на бебето FF, микробиотата на бебето BF показва по-високо алфа-разнообразие от микробиотата на бебето FF, количествено определена от индекса на Шанън-Винер.
Ефект на диетата върху бебетата микробиота. BF (кърмените) бебета (зелени) показват по-голяма хетерогенност от FF (хранени с адаптирано мляко) (синьо) по отношение на филогенетичния състав. а) Променливост на присвояване на таксони (ниво филум) за проби BF и FF, използващи подравняване на 16S rRNA към GreenGenes (вж. Материали и методи). Тест за пермутация на етикет за диета, използващ статистиката ∑s | ∑iεBF pis/6 - ∑iεFF pis/6 |, където s индекси phylum и iεBF и iεFF означават, че проба i е съответно BF или FF бебе, а p означава свързания таксон пропорция, отхвърли нулевата хипотеза, че променливостта във филогенетичния състав не е свързана със статуса на BF/FF с P-стойност от 0,011. б) Присвояване на таксони за всички четения на пушка (не само за 16S rRNA хомолози) с помощта на PhymmBL [17]. (° С) Индексът на Шанън-Уайнър за бебета BF и FF, показващ алфа-разнообразие за всяка проба.
За да потвърдим констатациите си, използвахме PhymmBL, за да класифицираме таксономично четене на последователност от пушки. PhymmBL [17] е подход за класификация на метагеномичните данни, който използва интерполирани модели на Марков (IMMs) и Основен инструмент за търсене на локално подравняване (BLAST), за да класифицира таксономично ДНК последователностите. Четенията бяха възложени на phyla, както е обобщено в Допълнителни файлове 4 и 5. Въпреки че имаше общо съгласие между анализа, базиран на 16S, и целия анализ, базиран на четене на пушка, ние идентифицирахме някои несъответствия. Те съответстваха на подобни несъответствия, открити в Кьониг и др. [18] и вероятно се дължат на недостатъчно представяне на 16S рРНК от Actinobacteria. Като цяло и двата анализа са в съответствие с предишен доклад, показващ високо ниво на актинобактерии и протеобактерии при кърмачета на 3-месечна възраст [18].
Функционален анализ
Функционален анализ на метагеномни данни. Най-горен панел: Категории SEED ниво 1, за които всички BF или всички FF проби са картографирали поне 200 четения. Най-малко 2% от общия брой картографирани четения са тествани за разлики между BF (кърмени) бебета (зелено) и FF (хранени с адаптирано мляко) (синьо). Извършен е пермутационен тест на тестовата статистика ∑iεBF pi/6 - ∑iεFF pi/6, където iεBF и iεFF означават, че проба i е съответно BF или FF бебе, а p означава свързаната пропорция на таксоните. Коригираната с FDR стойност на q за категорията на вирулентност е 0,058. Долен панел: разликите между новородените BF и FF в присвояването на вирулентност на ниво SEED 2 (в категорията на вирулентност на ниво SEED 1) бяха оценени с помощта на пермутационен тест на тестовата статистика ∑s | ∑iεBF pis/6 - ∑iεFF pis/6 |, където s индексира категориите на вирулентност SEED ниво 2, и P = 0,0140.
Въз основа на каноничните корелации от генните тройни анализи на CCA, индивидуално експресираните гени на гостоприемници са класирани спрямо тяхната емпирична мултивариантна връзка с честотата на гените в метагенома. За да изградим списък с най-обещаващите гени гостоприемници, ние изследвахме дела на генните тройки, чийто първи каноничен коефициент на корелация е най-малко 0,85 и чиято втора канонична корелация е най-малко 0,5. Те бяха избрани, за да подчертаят обогатяването на първия и втория каноничен резултат на корелация, наблюдаван в североизточния квадрант за имунитета и защитния ген (Фигура 4а). Получените резултати за гените на имунитета и защитата, гените на чревната биология и примерният набор от гени са показани на фигура 5 (допълнителен пример и репрезентативни парцели на случайни генни набори са налични в допълнителен файл 7). Гените, показващи най-силната емпирична мултивариантна връзка с метагенно-получените променливи на вирулентност, са от имунитета и защитния ген.
Честота на гените гостоприемници, които се появяват тройно. Набори от генни тройки бяха включени, когато първата канонична корелация беше най-малко 0,85, а втората канонична корелация беше най-малко 0,65. Тези нива са избрани произволно, за да представят силна многомерна структура, идентифицирана от CCA. Гените се класираха по преобладаването на тройки с най-добри резултати. Това осигури качествен профил за избор на гени, които емпирично показват най-силния потенциал за свързване с характеристиките на вирулентност на микробиома. (а, б) Гените, свързани с имунитета и защитата, далеч надминават останалите функционални категории. Например, най-добрите два гена, изпълняващи чревната биология, всъщност също са включени в списъка като гени на имунитет и защита. (° С) За разлика от това, произволно избраните гени не показват силна многовариантна структура по отношение на характеристиките на вирулентност на микробиома.
Изброени са 11-те най-обещаващи идентифицирани гена-гостоприемници, заедно с тяхната функционална анотация и свързания с тях биологичен отговор; VAV2 (ангиогенеза), ALOX5 (възпалителен отговор), SP2 (транскрипционен фактор), BPIL1 (бактериоциден), DUOX2 (генериране на пероксидаза), KLRF1 (цитотоксичност), IL1A (възпалителен отговор); AOC3 (съдова адхезия), NDST1 (възпаление и защита на лигавицата), REL (чревна пролиферация и апоптотична хомеостаза) и TACR1 (подвижност на червата). Както се вижда, повечето от тези гени са свързани с имунен отговор. Относителните нива на експресия на гени в BF спрямо FF бебета след 3-месечен период на хранене са показани в Таблица 2. Тъй като каноничните корелации се приписват на тройки, а не на единични гени, ние също изследвахме кои гени заедно показват най-обещаващата мултивариантна връзка с микробиома променливи. Фигура 6 показва кои гени най-често имат най-добрите канонични корелации (размер на възела) и кои двойки гени заедно в една и съща тройка най-често имат най-добрите канонични корелации (размер на ръба). Тази визуализация дава представа за синергичната сила между гените по отношение на подобряването на характеристиките на мултивариантната връзка на микробиома.
Дискусия
Първоначално изследвайки метагеномните данни, ние отбелязахме, че „устойчивостта на антибиотици и токсични съединения“, „тип III, тип IV, системи за секреция на ESAT“, „механизми за отстраняване на желязо“ и „вирулентност“ на микробиома показват доказателства за диференциална чувствителност към кърмата в сравнение с адаптираното мляко. По-конкретно, докато други характеристики на микробиома не предоставят сериозни доказателства за диференциация между BF и FF бебета при корекция за многократно тестване, свързаните с вирулентност микробни гени остават силни. Поради това фокусирахме нашите транскриптомични анализи върху имунитета на гостоприемника и свързаните с отбраната гени. Освен това, тъй като изучавахме развиващите се човешки черва, бяха изследвани и гени, за които се знае, че участват в чревната биология. Нашият първоначален анализ на диференциална експресия предполага, че нашите генетични набори от предишни знания са насочени към съответните генни набори.
След това метагеномните и транскриптомичните набори от данни бяха аналитично комбинирани в многовариатен анализ, който ни позволи да оценим силата на многовариантната връзка между променливите на вирулентността на микробиома и изследваните гени на чревните транскриптоми. Класирането на най-ефективните разглеждани гени показва, че най-силната мултивариантна връзка с характеристиките на вирулентност са гените на имунитета и защитата. Достоверността на тази констатация беше подкрепена от априори очакване, че най-силните връзки с характеристиките на вирулентност на микробиома ще бъдат гените на имунитета и защитата, и сравнението с 1000 произволни генни набора, към които наборът от имунитет и защитен ген се класира на 96,9-ия процентил по отношение на мярката на транскриптома/многомерна сила на микробиома. Докато чревната биология показва някои силни мултивариантни връзки с характеристиките на микробиома на вирулентност, те не са необичайни в сравнение със случайните генни набори и със сигурност не са толкова силни, колкото тези на имунитета и защитните гени (Фигура 4).
Заключение
Материали и методи
Декларация за етика и набиране на субекти
Експерименталният човешки протокол беше одобрен от Университетския съвет на Университета в Илинойс и Тексас A&M за институционални прегледи и беше получено информирано съгласие от родителите преди участие в проучването. Подробности за критериите и протоколите за прием в проучването са описани по-рано [12]. Здрави, доносени бебета, които са били кърмени или хранени с търговска формула за кърмачета (Enfamil LIPIL, Mead Johnson Nutrition, Evansville, IN, USA) и са медицински сертифицирани като здрави, са били допустими за включване в проучването. За всяко бебе в проучването се вземат проби от изпражненията три месеца след раждането.
Изолиране на ДНК на изпражненията
Геномната ДНК беше извлечена с помощта на модификация на метода на Ю и Морисън [40]. Отклонението от протокола включваше използването на стъклени стъпала. Накратко, 250 mg (мокро тегло) изпражнения се претеглят в епруветка от 2,0 ml, съдържаща стъклена матрица Е (MP Biomedicals, Solon, OH, USA). Лизисен буфер (1 ml; 500 mM NaCl, 50 mM Tris-HCl, 50 mM EDTA, 4% натриев додецил сулфат) се добавя към епруветката и се разклаща в продължение на 30 s. След това пробите се инкубират при 70 ° С в продължение на 15 минути. След центрофугиране при 16 000 ж за 5 минути супернатантите се събират в епруветки от 2,0 ml. Впоследствие се добавя лизисен буфер (300 ul) и горните стъпки се повтарят. Нуклеиновите киселини в супернатантата се утаяват последователно с амониев ацетат и изопропанол и се разтварят в ТЕ буфер. След това утаените нуклеинови киселини бяха третирани с без-ДНКаза RNase, протеиназа К и допълнително пречистени на QIAamp спинна колона от QIAgen DNA Mini Stool Kit (Qiagen, Валенсия, Калифорния, САЩ). Качеството на ДНК се проверява на 1% агарозни гелове, последвано от оцветяване с етидиев бромид. ДНК от три до четири екстракции на проба се обединява и нейната концентрация се определя количествено с помощта на спектрофотометър NanoDrop 1000 (NanoDrop Technologies, Wilmington DE, САЩ).
Последователност на чревните микробиоми
ДНК от фекални проби е подадена в звеното за секвениране и генотипиране с висока производителност в Центъра за сравнителна и функционална геномика Keck, Университет на Илинойс Пробите бяха секвенирани с помощта на 454 Life Sciences Genome Sequencer FLX с реагенти от GS FLX от титанова серия (Roche, Nutly, NJ, USA). Накратко, ДНК беше фракционирана (фрагменти от 500 до 800 bp) и полирана. Впоследствие баркодовете, съдържащи адаптери A и B, бяха лигирани до краищата според инструкциите на Roche. Адаптер В съдържа 5'-биотинов маркер за имобилизиране на ДНК библиотеката върху стрептавидинови мъниста. След поправка на ник, небиотилираната верига беше освободена и използвана като едноверижна шаблонна ДНК (sstDNA) библиотека. Количеството на библиотеката беше оценено с помощта на Qubit реагенти (Invitrogen, Калифорния, САЩ) и обединено с еднаква моларност. Оптималното ниво на ДНК за емулсионна PCR се определя чрез титруване. Мъниста бяха заредени на устройство PicoTiterPlate за последователност на пушките. Обработката на сигнала е извършена с помощта на софтуера на Roche.
Анализ на транскриптом на мРНК на приемната черва
От всеки субект поли А + РНК се изолира от изпражненията, както беше описано по-рано [12, 41]. Поради високото ниво на бактериална РНК във фекални проби, поли А + РНК е изолирана, за да се получи силно обогатена популация от РНК на бозайници [12]. В допълнение, Agilent 2100 Bioanalyzer беше използван за оценка на целостта на ексфолираните клетъчни поли A + RNA и количественото определяне беше извършено на NanoDrop Spectrophotometer. Пробите се обработват в строго съответствие с ръководството за анализ на генната експресия на CodeLink ™ (Applied Microarray, Tempe, AZ, USA) и се анализират с помощта на човешкия цял геномен експресионен биомасив, както вече описахме [13].
Анализ на метагеномни данни
Данните за четене на пушка 454 бяха предварително обработени по следния начин: (i) четенията с ниско качество бяха премахнати, ако средната стойност на четене Phred беше
- Магазин за бразилски диетични хапчета - Global Study UK
- Кърмата и микробиотата на майчините черва засягат устойчивите на антибиотици бактерии в червата на бебето
- Alopecia Areata Казус - Елитно обучение
- Бариатрична емболизация, оценена в проучване за затлъстяване BEAT - Endovascular Today
- Ечемичната захар при диета намалява риска от диабет, показват проучвания