Пол Крейг Търнър
Институт за приложно екологично здраве в Мериленд, Училище за обществено здраве, Университет в Мериленд, Колидж Парк, MD 20742, САЩ
Резюме
1. Въведение
Гъбичните токсини, известни още като микотоксини, са чести замърсители на хранителните продукти в голяма част от света. Счита се, че тези мощни хранителни токсини замърсяват 25% от световните зърнени култури [1], което прави излагането често сред много популации. Сред стотиците идентифицирани микотоксини, тези, които са от основно значение за общественото здраве, включват афлатоксини, произведени от гъби Aspergillus, както фумонизините, така и трихотецените (напр. Дезоксиниваленол (DON), ниваленол и Т2-токсин) от гъби Fusarium. Афлатоксините и фумонизините са по-чести замърсители на посевите в горещ и влажен климат, както в Централна Америка, тропическа Азия и Африка на юг от Сахара, където основните храни като царевица и фъстъци (фъстъци) често са замърсени. Трихотецените са склонни да се срещат по-често в по-умерените региони, включително части от Азия, Европа и Северна и Южна Америка [1].
Този преглед ще се съсредоточи върху токсикологията на афлатоксините, необходимостта от разработване на биомаркери за експозиция, за да подобри нашето разбиране за етиологията на хроничните заболявания, задвижвани с афлатоксин, и по-специално в този преглед използването на биомаркери за експозиция на афлатоксини при разкриване на ролята на афлатоксините в забавянето на растежа при кърмачета и малки деца, роля, която вече е добре установена във ветеринарната и друга животинска литература [2–18]. Неотдавнашната поява на нови инструменти за експозиция на фумонизини и DON ще бъде обсъдена накратко, тъй като те също могат да имат важен принос за част от цялостната глобална тежест на микотоксиновите нарушения на растежа, въпреки че фокусът тук ще бъде предимно върху семейството афлатоксини на микотоксините.
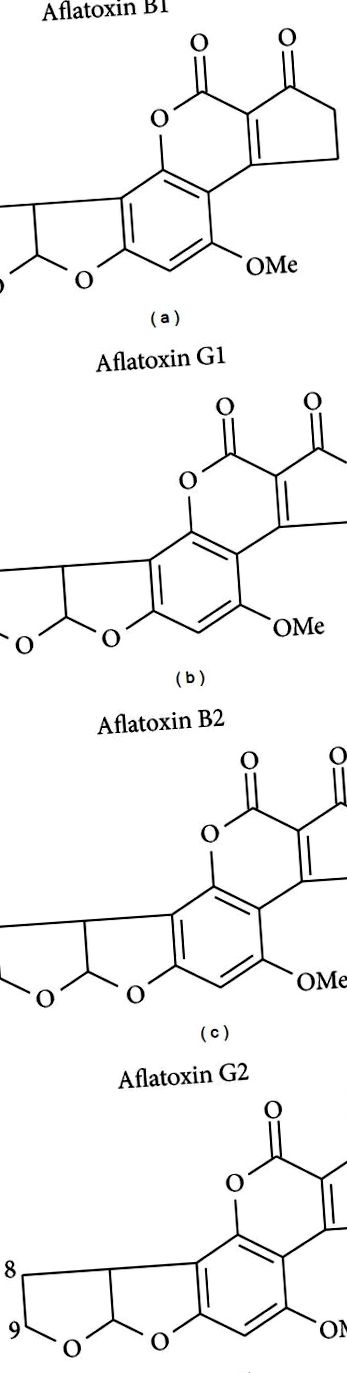
Афлатоксините са семейство от силно заместени кумарини, съдържащи кондензиран дихидрофурофуранов остатък. Афлатоксин В1 (AFB1) е най-често срещаният и най-токсичен и канцерогенен, докато други членове на семейството включват AFB2, AFG1 и AFG2; вижте фигура 1. Редица щамове Aspergillus произвеждат афлатоксини в горещ и влажен климат, въпреки че A. flavus (произвеждащи AFB1 и AFB2) и A. parasiticus (произвеждащи AFB1, AFB2, AFG1 и AFG2) доминират в естествената продукция [19]. A. flavus се среща по целия свят, докато A. parasiticus е ограничен предимно в Африка, Южна Америка, Централна Америка и Северна Америка. За афлатоксините както растежът на полето, така и дългосрочното съхранение, особено в регионите на развиващите се страни, допринасят за тежестта на замърсяването на храните. Царевицата и фъстъците са два от най-често замърсените хранителни източници в тези региони и често са хранителни продукти. Устойчивостта на афлатоксини към обработката и тяхната стабилност по време на готвене също допринасят за честотата на излагане на диети [20]. Популациите, които са особено склонни да имат хронични и високи нива на експозиция, обикновено са бедни, имат ограничено разнообразие в диетата и разчитат на царевица или фъстъци като хранителни продукти [21, 22].
Структури на основните естествени афлатоксини. Афлатоксин В1 доминира в естествената среда и е най-токсичен и канцерогенен.
Въпреки че токсичността на много микотоксини е ясно демонстрирана в животински модели, опасенията за общественото здраве при експозиция остават слабо проучени за повечето, отчасти поради липсата на полезни инструменти за оценка на експозицията [21-25]. Нашето разбиране за хроничните ефекти на афлатоксините е може би изключението, задвижвано силно от желанието да се разбере тяхната роля в човешката канцерогенеза и беше значително подпомогнато от разработването и валидирането на биомаркери на експозиция. Въпреки че обикновено се признава като канцерогени за човешкия дроб, подозиран от няколко десетилетия и демонстриран преди две десетилетия [26], този преглед ще се съсредоточи върху по-скоро възникващата загриженост за този клас токсини. Инструментите за експозиция, използвани за оценка на ролята на афлатоксините при рак, се оказаха полезни в това отношение и тяхното развитие е описано по-долу.
2. Биомаркери за експозиция на микотоксини
2.1. Биотрансформация на афлатоксин и биомерки на афлатоксин
AFB1 изисква активиране преди да прояви токсичност и се метаболизира от редица различни ензимни системи, въпреки че няколко ензима цитохром Р450 играят основна роля [28–30]. Разпознават се серия от монохидроксил (например AFM1, AFQ1, AFP1 и афлатоксикол (AFL)) и два вида епоксид; AFB1-екзо-8,9-епоксид и AFB-ендо-8,9-епоксид са доминиращите токсични метаболити; вижте фигура 2. Докато повечето от тези реакции включват окислителен процес с добавяне на хидроксил, образуването на AFL е редукционен процес на кетонната част. По принцип хидроксилните метаболити се считат за по-малко токсични и могат да претърпят допълнителни реакции от фаза 2, включващи конюгация с глюкуронидни и/или сулфатни групи, за да подпомогнат екскрецията. Двата епоксида също могат да претърпят реакции на детоксикация фаза 2 чрез свързване с трипептида глутатион (GSH), улеснено от семейство глутатион-S-трансферазни ензими и последващо образуване на афлатоксин-меркаптурат, който лесно се екскретира.
Структури на двата основни епоксида на афлатоксин В1. Екзоепоксидът е едновременно токсичен и канцерогенен; ендо-епоксидът е само токсичен.
Има многобройни други проучвания, които са измервали AFM1 или AFB1 в серума, включително проучвания в Нигерия, Кения, Гана, Судан, Египет, Турция, Обединени арабски емирства, Аржентина, Сингапур, Непал, Япония и Тайланд [31–51]. Като цяло, районите с очаквано по-високо замърсяване с храни с афлатоксини имат по-висока честота и/или нива на тези биомерки, въпреки че към днешна дата мерките за серумен афлатоксин не са били количествено свързани с приема. По този начин те остават добри мерки, които показват някаква експозиция, но осигуряват ограничено количествено определяне на този риск.
Структурата на измерения вид афлатоксин е валидирана експозиция на биомаркери. Афлатоксин-лизинът е смилаемият продукт на афлатоксин-албумин, открит в серумите, AFM1 е хидрокси метаболитът, открит в урината, а афлатоксин-N7-гуанинът е продуктът на дефурирането на афлатоксин-ДНК адуктите.
Избрани пътища за биотрансформация за афлатоксините. Фокусирайте се върху биотрансформациите на AFB1, които са подчертани и посочват пътя към конкретните биомаркери. Биотрансформацията на AFB2 до AFB1 ще бъде умерена и вероятно ще представлява по-малко от 1% от дозата на AFB2. Пътят на AFG2 е предвиден, но вероятно с нисък или много скромен принос. Променено от [21, 22].
маса 1
AF-албуминът адуктира разпределение на концентрацията от проучвания 1–4 за оценка на растежа и данни от Канада и САЩ. Представените данни са процентът във всяко проучване в рамките на една от групите за концентрация на pg/mg (модифициран от [21, 22, 95, 98]: [102–104]; [120]).
| Канада | Възрастни (n = 200) | 100 | 0 | 0 | 0 | 0 | 0 | 0 | |
| САЩ | Възрастни (n = 10 000) | 100 | 0 | 0 | 0 | 0 | 0 | 0 | |
| Проучване 1 | Гамбия | 6–9 години (n = 478) | 8 | 45 | 28 | 13 | 4 | 2 | 0 |
| Проучване 2 | Бенин и Того | 3 години (n = 192) | 2 | 24 | 38 | 15 | 14. | 6 | 1 |
| Проучване 3 | Гамбия | Майчина (n = 113) | 0 | 30 | 35 | 20. | 12 | 5 | 0 |
| Пъпна кръв (n = 109) | 54 | 41 | 1 | 2 | 2 | 0 | 0 | ||
| Седмица 16 (n = 110) | 89 | 9 | 2 | 0 | 0 | 0 | 0 | ||
| Седмица 52 (n = 113) | 7 | 49 | 16. | 11. | 9 | 9 | 0 | ||
| Проучване 4 | Бенин и Того | 16–38 месеца (n = 197) | 2 | 34 | 22. | 18. | 15 | 7 | 1 |
| 21–43 месеца (n = 194) | 3 | 29 | 25 | 25 | 12 | 6 | 1 | ||
| 24–46 месеца (n = 193) | 1 | 16. | 17 | 18. | 22. | 18. | 8 |
3.1. Проучване 1
Първото проучване е проведено в Гамбия между май 1998 г. и февруари 1999 г. и включва събиране на единична кръвна проба и антропометрични мерки от 472 деца на възраст 6–9 години [95]. Адуктите на AF-албумин са открити при 93% от децата (средно геометрично ниво 22 pg/mg; диапазон 5–456 pg/mg), а нивото на AF-албумин варира в зависимост от месеца на вземане на проби (P Фигура 5. В едно такова проучване намалено наддаване на тегло при плъхове се наблюдава при третирани с AFB1 в сравнение с контролни животни, ефект, частично възстановен чрез третиране на животни с пробиотик, който намалява бионаличността на афлатоксин [8]. Докато механизмът на индуцирания от афлатоксин растеж остава неизяснен, демонстрация на подобрен растеж на бебето следните интервенции, които могат да ограничат експозицията на афлатоксин в някои от високорисковите региони по света, са от решаващо значение. Разбирането на механизма на тези ефекти би предоставило допълнителни доказателства за причинно-следствената връзка на тези събития.
График за откриване и идентифициране на афлатоксин и ключови проучвания върху животни и хора върху растежа, съответно във връзка с дозирането или естествената експозиция. Данните за хора включват само валидирани проучвания, управлявани от биомаркер; допълнителни изследвания върху хора, публикувани между 1989 и 2010 г., допълнително подкрепят тези наблюдения (вж. текста). Променено от [21, 22, 136].
Може би си струва да се опитаме да поставим тези съобщени наблюдения върху афлатоксина върху детския растеж в малко по-глобален контекст. Изчислено е, че около 165 милиона деца на възраст под пет години, предимно в страни с ниски доходи, страдат от хронично недохранване. Тези деца са или закърнели (HAZ 2 = 0,83, P 2 = 0,24, P 2 = 0,27, P 2 = 0,22, P = 0,02), вариацията на деоксиниваленол в урината беше слабо и скромно обяснена с проста оценка на диетата [100, 207, 208]. По този начин силата на този биомаркер на експозиция разчита на демонстрираната силна количествена мярка на действителния прием спрямо измерването на урината [206]. В допълнение, интервенция за ограничаване на консумацията на пшеница показа значително 11-кратно намаляване на средните нива на биомаркер в превенцията [101], средно геометрично 7.2 ng DON/mg креатинин (95% CI: 4.9-10.5 ng/mg), до ниво след четири дни диетично ограничаване на пшеницата от 0,6 ng на mg (95% CI: 0,4-0,9 ng/mg).
Предприето е и разработването на биомаркер, излагащ фумонизин. Най-новата работа е фокусирана върху измерването на уринен фумонизин В1 [25, 209-211]. Фумонизин B1 в урината често се наблюдава при лица, зависими от царевицата като хранителен продукт, в региони с доказано или подозирано замърсяване с царевица с фумонизин. Съобщава се за значителна връзка между консумацията на тортила и уринарната мярка (FB1 pg/ml урина или FB1 pg/mg креатинин) за проучване сред 75 мексикански жени, предварително избрани да представят ниско, средно и високо потребление, въз основа на данни за консумацията от по-голямо проучване (P 2 = 0,25, P 2 само за базовата фаза е 0,31. При интервенция, която намалява нивата на замърсяване с фумонизин в царевицата, които тези жени консумират, незначително (P> 0,05) намаляване на пикочната биоизмерване от изходни нива (средно геометрично 470 pg/mg: 95% CI 295, 750 pg/mg) в сравнение с тези след интервенция (средно геометрично 279 pg/mg: 202, 386 pg/mg) е наблюдавано [209]. Китай, разлики в уринарния фумонизин са наблюдавани между предсказвания регион с висока и прогнозирана ниска експозиция; средното ниво без FB1 в урината при лица от Huaian, n = 43 (3,9 ng/mg; диапазон без откриване - 253,6 ng/mg) спрямо субекти от Fusui, n = 34 (0,4 ng/mg; диапазон без откриване - 3,7 ng/mg), (P 0,05).
Проведено е проучване за контролирано дозиране с фумонизин В1 при здрави жители на САЩ, n = 10 [211]. В това проучване средният прием на фиксирано количество FB за няколко дни се сравнява с отделянето с урината. Основното наблюдение беше, че средно около 0,5% от екскретирания фумонизин се прехвърля в урината, което е около 7 пъти по-голямо от изчисленото за проучването в Южна Африка [209]. Базираното в САЩ проучване също отчита широк диапазон в прехвърлената сума. Тази широка вариация в кинетиката на екскреция в много контролирана ситуация поражда известна загриженост относно използването на този експозиционен биомаркер в епидемиологични проучвания в сравнение, например с тези, използващи афлатоксинови биомаркери. Очевидно съществуват някои взаимоотношения, но липсата на обща сила в отношенията, съобщени от проучвания до момента, предполага, че ще се изискват допълнителни грижи при изчисляване на размера на извадката за епидемиологични изследвания, които използват тази мярка. Независимо от това, афлатоксинът и фумонизините вероятно ще се появят често и ще бъде важно да се разберат ефектите от такива събития [119]. Мултимикотоксиновите методи могат също да спомогнат за по-бърза оценка на многократни експозиции, включително тези от афлатоксини, фумонизини и дезоксиниваленол [212–214].
И двете нови мерки са уринарни маркери и по този начин ще отразяват само скорошно излагане на токсините. Важно е да се оцени временният характер на тези мерки при отделните лица. За разлика от тях AF-албуминът представлява експозиция за продължителен период, макар че идеалното би било да има инструменти, които да показват експозицията в продължение на години. Такива инструменти предстои да бъдат разработени.
6. Заключение
- Защо Pediasure може да направи вашето дете; s Нарушение на растежа по-лошо - Хранене за деца
- Ефектите на Nigella sativa върху функцията на щитовидната жлеза, серумен фактор на съдовия ендотелен растеж (VEGF
- Каква диета да се спазва при хроничен гастрит; Ledmain
- Какво правите, ако детето ви се оплаква от киселини
- Вегетарианската диета и хроничната бъбречна болест - DaVita