Даниел Алехандро Лерман
1. Кралската болница за болница в Единбург (NHS Lothian), Университетът в Единбург, Великобритания
Сай Прасад
1. Кралската болница за болница в Единбург (NHS Lothian), Университетът в Единбург, Великобритания
Насри Алоти
2. Окръжна болница Зала, Печски университет, Унгария
Резюме
Прогресивно удебеляване на аортните клапи и стесняване на аортния пръстен води до повишено механично натоварване на лявата камера и намалява сърдечния дебит, което води до допълнителни усложнения. [1–3] Делът на засегнатата популация се увеличава със средната възраст на страната или регионът се издига. Приблизително 2–4% от хората на възраст над 65 години ще развият калциална аортна стеноза, като 25% от хората в тази възрастова група се проявяват с признаци на заболяването, което води до 50% повишен риск от сърдечно-съдови събития. Освен това съществува асоцииран риск от 80% за 5 години прогресия до сърдечна недостатъчност, подмяна на аортна клапа или смърт. [4]
Анатомия и хистология
Нормалната аортна клапа поддържа еднопосочен кръвен поток от лявата камера в аортата. Това е гъвкава мембрана, която се отваря и затваря с всеки сърдечен ритъм повече от 100 000 пъти на ден. Здравата аортна клапа включва три листчета и е разположена на кръстовището между изходния тракт на лявата камера и аортния корен.
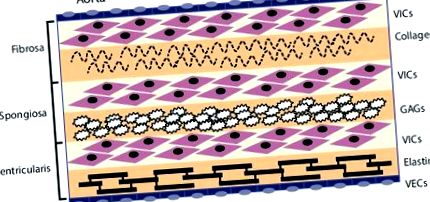
Клапните ендотелни клетки (VECs) облицоват външната повърхност на клапата и функционират като бариера за ограничаване на възпалителната клетъчна инфилтрация и натрупване на липиди. Трите средни слоя на клапата са фиброзата, спонгиозата и вентрикуларисът. Тези слоеве съдържат клапни интерстициални клетки (VIC) като преобладаващ тип клетки. Фиброзата е най-близо до аортната страна на клапата, съдържа фибриларен колаген от тип I и тип III и изпълнява носеща функция. Спонгиозата съдържа гликозаминогликани (GAG), които смазват фиброзните и вентрикуларните слоеве, докато се срязват и деформират по време на сърдечния цикъл. Вентрикуларисът съдържа еластинови влакна за намаляване на радиалното натоварване. Източник: Раджаманан, 2011. [10]
Клапаните интерстициални клетки (VIC) се намират във всеки от тези слоеве и имат отделни субпопулации, които регулират хомеостазата в клапаните. [10–12] В допълнение към общата трикуспидална анатомия на аортната клапа, вродена бикуспидална клапа е открити при 0,5–1,4% от общата популация, пораждащи диференциални биомеханични сили - както върху клапата, така и върху аортната стена. [13–15]
Патофизиология и механизъм на калциране
През последните няколко десетилетия етиологията на калциалната болест на аортната клапа (CAVD) се е променила значително. По-ниското разпространение на ревматичните сърдечни заболявания и увеличеното дълголетие в индустриализираните страни доведоха до промяна в модела от ревматична към дегенеративна калцификация като най-честата причина за CAVD и последваща калциална аортна стеноза. [16–18] CAVD е третата по честота сърдечна болест в западния свят, [19] след коронарна болест на сърцето и хипертония. Разпространението му при пациенти в напреднала възраст (≥65 години) варира от 2–4%, когато се има предвид само тежка аортна стеноза, като се увеличава до 25%, когато е включена аортна склероза. [9] Въпреки това, относително малцинство от възрастни индивиди развиват калцификация на аортната клапа, което предполага, че патологични влияния, различни от възрастта, играят роля.
Калциалната аортна стеноза е втората най-разпространена причина за сърдечни операции и е причина за около 15 000 смъртни случая годишно в Северна Америка. [18] Калциалната аортна стеноза е добре позната болест и ние сме в състояние да оценим множество хемодинамични параметри, използвайки сърдечна катетеризация или ултрасонография, както и сърдечна компютърна томография и сърдечно-магнитен резонанс. [20] При CAVD първоначално се наблюдават калцирани възли в основата на венците и тяхното присъствие постепенно се разширява към отвора. Обикновено и трите издатини обикновено са засегнати, но една или повече може да са доминиращи. Когато притокът на кръв през стенозния аортен отвор стане значително ограничен, може да настъпи хемодинамично увреждане, свързано със сериозни симптоми на застойна сърдечна недостатъчност и внезапна сърдечна смърт. Тежката симптоматична аортна стеноза е индикация от клас I за хирургична подмяна на клапата, според Американската кардиологична асоциация и Американския колеж по кардиология за клапни сърдечни заболявания. [21]
Понастоящем CAVD се разглежда като активно регулирано и прогресиращо заболяване, характеризиращо се с каскада от клетъчни промени, които първоначално причиняват фиброзно удебеляване, последвано от обширно калциране на аортните клапани. Това от своя страна води до значителна стеноза на аортната клапа и евентуална обструкция на изтичане на лявата камера (вж. Фигура 2), [10,22], за която хирургичното заместване остава единствената жизнеспособна възможност за лечение. Понастоящем няма одобрено фармакологично лечение за спиране на прогресията на CAVD. [23] Описателни проучвания, използващи човешки образци, демонстрират отличителните черти на това заболяване, включително ранна атеросклероза, клетъчна пролиферация и експресия на остеобласти. [24–26]
О: Прогресиране на хистологичните промени по време на процеса на калциална аортна стеноза. B: Трикуспидална аортна клапа, показваща нарастващо отлагане на калций и намаляване на аортната пръст. BMP = костен морфогенетичен протеин; LDL = липопротеин с ниска плътност; TNF = фактор на туморна некроза; TGF = трансформиращ растежен фактор. Източник: Ото, 2008. [22]
CAVD и традиционни рискови фактори за атеросклероза
Стенозата на аортната клапа е описана за първи път от Lazare Riviere през 1663 г. [27] В началото на 1900-те години, известни патолози като Монкеберг, описаха CAVD като пасивен дегенеративен процес, свързан с ревматична треска или стареене, по време на който серумният калций се прикрепя към повърхността на клапата и се свързва с листчето, за да образува възли. [28]
През последните десетилетия няколко проучвания са включили традиционните рискови фактори за сърдечно-съдова атеросклероза в развитието на CAVD. Атеросклерозата е сложен и многофакторен процес, при който се получава лезия, съставена от липиди, [29,30] макрофаги, [31] пролифериращи гладкомускулни клетки [32] и апоптоза. [33] Регулира се от ендотелната азотна оксида синтаза, [34–38] и с течение на времето причинява запушване на диаметъра на съда. Съобщава се, че общият холестерол, повишеният холестерол с ниска плътност (LDL), повишеният липопротеин (а), повишените триглицериди, намаления холестерол на липопротеините с висока плътност, мъжкият пол, пушенето на цигари, хипертонията и захарният диабет увеличават честотата на аортна стеноза и вероятно допринасят за ендотелната дисфункция и увреждане на листовките [2,3,39–43] Наличието на LDL и атеросклероза в калцирани клапи при хирургични патологични изследвания подкрепя хипотезата за общ клетъчен механизъм. [44,45] Освен това, пациентите с фамилна хиперхолестеролемия развиват агресивно периферно съдово заболяване, коронарна артериална болест и лезии на аортната клапа, които се калцират с възрастта. [39,46–48]
Молекулните и клетъчните процеси, които допринасят за стенозата на аортната клапа, не са напълно характеризирани, но биха могли да дадат представа за развитието на нови терапевтични подходи.
Сърдечните клапи включват хетерогенна популация от клапни ендотелни клетки и VIC, които поддържат хомеостазата на клапата и целостта на структурните листовки. VICs, най-разпространеният тип клетки в сърдечната клапа, играят ключова роля в прогресията на CAVD. [73] Различни VIC фенотипове са идентифицирани в болни човешки сърдечни клапи, [74] включително неподвижни фибробластоподобни VIC, които по патологични признаци могат да се диференцират в активирани миофибробластоподобни VIC; и остеобласт-подобни VIC, които са отговорни за активното отлагане на калций в CAVD. [53,62,74] Освен това няколко проучвания демонстрират способността на VIC да претърпят остеогенна диференциация. [26,67,75]
CAVD и напрежение при срязване
Въпреки че атеросклеротичната коронарна артериална болест и CAVD имат общи черти, те имат различия в реологията. Тази разлика може да осигури поне частично обяснение за разликите в патофизиологията и отговора на терапията. [76–80] CAVD се характеризира с пулсиращо напрежение на срязване от вентрикуларната страна и ниско и възвратно напрежение на срязване от аортната страна, [81] докато коронарната артерия е изложена на продължителен ламинарен кръвен поток при нормални обстоятелства. [82] С напредването на стенозата напрежението на срязване на стената през аортната клапа драстично се увеличава. [76] Ahamed и колегите му демонстрират, че in vitro напрежението на срязване може да активира латентен трансформиращ растежен фактор (TGF) -β1, [82] критичен про-фиброзен растежен фактор, който може да предизвика фиброза и калцификация. [83] Те също така показаха, че активният TGF-β1 може да се елуира от тромби, образувани в отговор на съдово увреждане в каротидната артерия на мишки, при което частичното запушване може да е довело до висок локален стрес на срязване. [82] Впоследствие Albro et al. независимо потвърди, че напрежението на срязване може да активира латентен TGF-β1 в синовиалната течност. [83] Тези данни повишават възможността за връзка между активирането на циркулиращ латентен TGF-β1 при високо напрежение на срязване и развитието на CAVD. Тъй като тромбоцитите допринасят
45% от изходното ниво на циркулиращо ниво на TGF-β1 [84] и имат 40–100 пъти по-латентен TGF-β1 от всички други клетки [85], възможно е срязващият стрес да има два отделни ефекта - предизвикване на освобождаване на латентен TGF-β1 от тромбоцитите и активиране на освободения латентен TGF-β1. Този механизъм може да допринесе за прогресирането на CAVD, тъй като стеснението на аортната клапа увеличава напрежението на срязване, което води до по-голямо освобождаване на тромбоцитни активиране на TGF-β1 и TGF-β1. Това от своя страна може да доведе до прогресивно стесняване на клапата и фиброза и по този начин дори по-голямо напрежение на срязване.
Калцифициращите клапи първоначално имат макрофаги и Т-клетъчни инфилтрати в резултат на ендотелно увреждане. [74] След това костният морфогенетичен протеин (BMP) -2 и BMP-4 се експресират от миофибробласти и преостеобласти, съседни на тези лимфоцитни инфилтрати. [74] Освен това сърдечните клапи изразяват маркери на остеобластична диференциация, включително свързващ ядро фактор алфа 1 и остеокалцин. [26] Тези клапи също се калцират по начин, подобен на остеогенезата, с ламеларна кост, очевидна при повечето изследвани патологични проби. [85] Вродените бикуспидални аортни клапи показват равномерно признаци на калцификация до достигане на възраст от 30 години, [86] което отчасти може да се дължи на конкретните механични стресори, на които са подложени тези клапани. [87] Наскоро бе разрешен молекулярният механизъм, залегнал в основата на калцирането на бикуспидната аортна клапа. Мутациите в транскрипционния регулатор NOTCH1 доведоха до аномалии на аортната клапа и тежка калцификация, поради нарушена репресия на транскрипционния фактор 2 (RUNX2) на остеобластния стимулатор. [88]
Последните данни сочат, че CAVD е резултат от активен възпалителен процес, засягащ клапата и водещ до остеобластична трансформация с костно образуване на VICs чрез активиране на рецепторния активатор на ядрен фактор-кВ (RANK). [89]
Регулаторни пътища
Има все повече доказателства, че регулаторните пътища, които контролират развитието на сърдечната клапа, също са активни с патогенезата на клапата по-късно в живота. CAVD включва активиране на VIC в допълнение към повишената експресия на транскрипционни фактори, които регулират най-ранните събития на валвулогенезата в развиващия се ембрион. [90] В допълнение към пътищата за развитие на клапата, регулаторните протеини, които насърчават развитието на хрущялната и костната линия също са активни в болните клапи. По този начин, познаването на молекулярните регулаторни пътища, които контролират развитието на клапата, вероятно ще бъде информативно при определяне на молекулните механизми на патогенезата на клапата.
Етиология
CAVD има многофакторна етиология. Много фактори са съсредоточени върху възпалителен процес, засягащ клапата и водещ до калцификация, [74,85], включително отлагане на LDL, [44,45] остеобластична трансформация с костно образуване на клапни интерстициални клетки, синтез на съединителната тъкан и ремоделиране на тъканите. На микроскопично ниво аортните листчета съдържат дезорганизирани колагенови влакна, хронични възпалителни клетки, протеини на извънклетъчната костна матрица, липидни протеини и костни минерали. [5] Калцификацията на клапата се случва след транс-диференциация на VICs през миофибробластен стадий и в остеобластни клетки. [71,92]
Половината от възрастните, подложени на подмяна на аортна клапа, са свързани с бикуспидна аортна клапа и почти всички от тях ще трябва да имат нова клапа. [93] Срязващият стрес, възникващ при всяка сърдечна систола, е по-голям при бикуспидална клапа, отколкото при трилистна структура и тези клапани се калцират по-рано. [93]
Интересното е, че експресията на RANK лиганд (RANKL) от остеобластните клетки ще участва активно в активирането и диференциацията на остеокластните клетки. [89] Нивата на RANKL обикновено се повишават с възрастта и могат да предскажат сърдечно-съдови събития при хората, докато дефицитът на остеопротегерин (физиологичен инхибитор на RANK) може да доведе до калцификация на съдовете при животински модели. [94,95] Това проучване подчертава in vitro модел за оценка на механизмите на калцификация на аортната клапа. [95]
Молекулни механизми на калциране
Процесите на аортна клапна стеноза и калцификация споделят много прилики с атеросклерозата, а патологиите на двете състояния имат сходни рискови фактори и хистопатология. [2] Активирането на VIC и пътищата на калциална аортна стеноза е резултат от механичен и срязващ стрес, ендотелни увреждания и отлагане на LDL, предизвикващи възпалителни събития и привличащи възпалителни клетки (моноцити, макрофаги и Т клетки).
Тези клетки произвеждат цитокини, включително TGF-β, който регулира клетъчната пролиферация и диференциация; фактор на туморна некроза-α, чиято основна функция е регулирането на имунните клетки; и интерлевкин 2, който се произвежда от активирани Т лимфоцити с активност на растежния фактор. [1]
VICs, активирани от възпалителния процес, са обозначени като миофибробласти. [5] Тези клетки ще развият ангиогенна активност и ще произведат матрични металопротеинази, протеини, които участват в ремоделирането на тъканите и подпомагат активирането и трансформацията на VIC. [96,97] По време на този процес активираните VIC се диференцират в остеобласти.
Ин витро изследвания
Неотдавнашните ни непубликувани проучвания демонстрираха регулиране на ключовите молекули по време на спонтанно калциране на свински VIC с повишаване на активността на калций, колаген и алкална фосфатаза (ALP). in vitro калциране се определя, като се използват стандартни анализи за оцветяване и ензимна активност. Калцификацията в прасета VICs се индуцира с натриев фосфат. Клетките експресират маркери както за съдовите гладкомускулни клетки, така и за остеобластите, което предполага трансдиференциране на фенотипа. Беше отбелязано повишено регулиране на α-актин, RUNX2, TGF-β и RhoA и понижаване на регулирането на калпонин, без да се наблюдават промени в експресията на RANKL. Натриевият фосфат увеличава образуването на нодули до ден 7 и активността на ALP на свински VIC до ден 14. Констатациите предполагат, че свините VICs могат да бъдат добър модел за изследване на процеса на CAVD. [100]
Денозумаб като потенциален инхибитор на VIC калцификация In Vitro
Денозумаб е човешко IgG2 моноклонално антитяло, предназначено да се насочи към RANKL, [101] което се експресира върху мембраната на остеобластите и остеокластите. Денозумаб се използва за лечение на остеопороза. Освен това, благодарение на своя механизъм, който блокира рецептора RANKL, той неутрализира активирането на RANK рецепторите върху мембраната на пред-остеокластните клетки.Необходими са повече изследвания за разглеждане на взаимодействието между RANK рецептора и денозумаб в свински VICs.
Благодарности
Искаме да благодарим за цялата подкрепа на д-р Нийл Макензи, който за съжаление почина след падане по време на ледено катерене в Канада (RIP).
- Лекарства против затлъстяване минали, настоящи и бъдещи модели на заболяванията; Механизми
- Подмяна на аортната клапа - Възстановяване - NHS
- Аортна клапа регургитация PeaceHealth
- Адаптиране към живот с механична аортна сърдечна клапа, феноменографско проучване - PubMed
- Терапевтична диета с ниско съдържание на въглехидрати