Амод Шарма
Катедра по физиология, болница Siriraj, университет Mahidol, Банкок, 10700 Тайланд
Катедра по биохимия, Медицински факултет, Университет Khon Kaen, Khon Kaen, 40002 Тайланд
Резюме
Проучванията при животни показват, че приемът на хроничен мононатриев глутамат (MSG) предизвиква бъбречно увреждане от оксидативен стрес. Въпреки това, основните механизми все още са неясни, въпреки нарастващите доказателства и консенсус, че α-кетоглутарат дехидрогеназата, глутаматните рецептори и цистин-глутаматният антипортер играят важна роля за регулиране на оксидативния стрес при индуцирана от MSG бъбречна токсичност. Този преглед обобщава доказателства от проучвания за причинено от MSG бъбречно оксидативно увреждане, възможни механизми и тяхното значение от токсикологична гледна точка.
Въведение
Мононатриевият глутамат (MSG) е често използвана добавка в преработената храна и азиатската кухня, за да се увеличи вкуса. Няколко проучвания върху животни обаче показват, че MSG е токсичен за различните органи като черния дроб, мозъка, тимуса и бъбреците [1–3]. Публикуваните данни показват, че бъбречната фиброза е свързана с хроничната консумация на MSG [4] и оксидативният стрес е основната причина за бъбречно увреждане [5].
Оксидативният стрес се причинява от прекомерното производство или намаленото елиминиране на свободните радикали в клетките, повечето от които са кислородни радикали и други реактивни кислородни видове (ROS) [6]. Хранителният метаболизъм и няколко извънклетъчни и вътреклетъчни фактори като хормони, цитокини и процеси на детоксикация допринасят за оксидативния стрес [7–9]. Следователно прекомерният бъбречен метаболизъм на глутамат, както при хроничен прием на MSG, може да бъде източник на ROS. Намалени нива на основните антиоксидантни ензими и повишена липидна пероксидация са демонстрирани в бъбреците на хронични плъхове, изложени на MSG [10, 11]. Също така е доказано, че високите дози глутамат предизвикват значителна токсичност в клетките на бъбречната култура [12].
Изобилието от дълговерижни полиненаситени мастни киселини в състава на бъбречните липиди прави бъбреците податливи на увреждане от ROS [13]. Това прави бъбречните тъкани податливи на увреждания чрез различни механизми като насърчаване на липидната пероксидация, модифициране на протеини и увреждане на ДНК, водещи до клетъчна смърт [14–16]. Съответно се съобщава за участието на ROS в гломерулни, тубуларни и тубуло-интерстициални промени [17, 18].
Множество проучвания обясняват оксидативното увреждане, предизвикано от глутамат в тъкани като мозък или неврони, където а-кетоглутарат дехидрогеназата, глутаматните рецептори и цистин-глутаматният антипортер са жизненоважни играчи [19–21]. Тези молекули могат да допринесат за окислителния стрес чрез, различни механизми, но малко се знае за тяхното участие в индуциран от MSG бъбречен оксидативен стрес. Установено е повишено ниво на а-кетоглутарат дехидрогеназа в бъбреците на плъхове, хранени с MSG [5] и съответно се разработва силен консенсус срещу α-кетоглутарат дехидрогеназа, глутаматни рецептори и цистин-глутамат антипортер за тяхната потенциална роля в свързаният с MSG бъбречен оксидативен стрес. Целта на този кратък преглед е да очертае индуцираното от MSG окислително увреждане на бъбреците и възможните механизми.
Преглед
Индуцирано от MSG увреждане на бъбреците
Връзката между диетичните фактори, включително MSG и риска от бъбречно заболяване, е хипотезирана в многобройни проучвания. Бъбреците са силно чувствителни към исхемия, токсични обиди и други химикали. Като такива, процеси, водещи до директни или индиректни нарушения на енергийния метаболизъм на бъбречните клетки, ще доведат до увреждане на клетките и остра бъбречна недостатъчност [22].
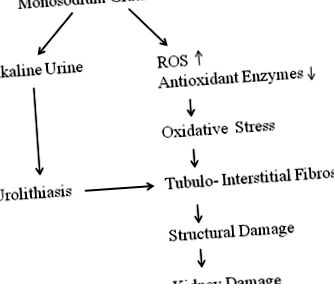
Обобщение на хроничните бъбречни промени, предизвикани от MSG, е илюстрирано на фиг. 1. MSG може да предизвика промени в бъбречната цитоархитектура, да увеличи гломерулната хипер-клетъчност, инфилтрация на възпалителни клетки в бъбречната кора, оток на тубуларните клетки и в крайна сметка дегенерация на бъбречните тубули [10, 11, 23]. Въпреки че инфилтрацията на възпалителни клетки сочи към патология, точната патофизиология не е напълно изяснена. Клетъчната дисфункция се счита за важна причина за последващото развитие на по-голямата част от морфологичната промяна, независимо от токсичния принцип, действащ върху бъбреците. Следователно, ултраструктурното изследване на бъбреците в експериментални модели с хронично лечение с MSG може да допринесе за по-добро разбиране на механизма на нарушения при бъбречно увреждане.
Очертаване на хронични бъбречни промени, предизвикани от MSG в бъбреците. Алкалната урина и оксидативният стрес поради хроничен прием на MSG могат да увредят бъбреците по неизвестни механизми. Уролитиазата също може да допринесе за интерстициалната фиброза, като произвежда възпалителни цитокини и ROS
Експериментални доказателства за бъбречно увреждане, медиирано от хроничен прием на MSG, ще бъдат обсъдени допълнително при оксидативен стрес, уролитиаза и интерстициална фиброза.
Оксидативен стрес
Освен това, проучвания, използващи тиолови антиоксиданти като N-ацетилцистеин (NAC) и липоева киселина, демонстрират терапевтична защита срещу индуцирана от глутамат невротоксичност [28, 29]. Въпреки че няма експериментални доказателства в подкрепа на защитния ефект на тези молекули при индуцирана от MSG бъбречна оксидативна токсичност, е доказано, че NAC намалява нивата на MDA в бъбреците при модел на мишка с диабет [30]. В култивирани човешки проксимални тубуларни епителни клетки, NAC намалява липидната пероксидация и поддържа митохондриалния мембранен потенциал, като по този начин предотвратява апоптозата след прилагане на водороден пероксид [31]. Също така, липоевата киселина е била ефективна в защитата на бъбреците от оксидативен стрес и митохондриална дисфункция [32]. В различен контекст е демонстриран подобряващият ефект на селена върху индуцираната от MSG окислителна токсичност на тестисите [33]. Тези важни открития добавят допълнителни перспективи към терапията на MSG-индуциран бъбречен оксидативен стрес с помощта на антиоксиданти.
Уролитиаза и интерстициална фиброза
Съобщава се за обструктивна нефропатия, дължаща се на хроничен хранителен MSG при възрастни плъхове, вероятно поради алкална урина и намалени нива на каменни инхибитори като магнезий и цитрат в урината [4]. Механизмът, причинен от алкализирането на урината, причинена от MSG, все още е неизвестен, но този ефект е докладван за първи път от de Groot et al. (1988) [34]. Вероятно третираните с MSG животни могат да генерират по-високо катаболни продукти на глутамат в бъбречните клетки и неговият въглероден скелет се превръща във въглероден диоксид и след това в бикарбонатни аниони [35, 36]. След това генерираните бикарбонати се абсорбират обратно в кръвообращението и в крайна сметка в бъбреците за екскреция на извънгалкалията, което води до алкална урина [37, 38]. Алкалната урина може да повлияе на капацитета на бъбреците по отношение на секреция или реабсорбиране на метаболити, които могат да допринесат за образуването на камъни, докато инхибиторите на образуването на камъни играят основна роля в естествената защита. Продуктът с повишена йонна активност на калциев фосфат в алкалната урина на MSG-хранени мишки показва риска от образуване на калциево-фосфатни камъни [4].
Освен това, ROS може да причини увреждане на клетките, което води до клетъчна смърт и образуване на мембранно-свързани мехурчета, които поддържат кристално нуклеиране [39, 40]. На този фон се съобщава за хидронефроза с големи промени като фиброза в тубуло-интерстициалното отделение при лекувани с MSG бъбреци на плъхове от Sharma et al. (2013) [4]. Тук е важно да се отбележи, че 2/10 от лекувани с MSG животни демонстрират наличие на хидронефроза и 3/10 с бъбречни камъни в проучването. Въпреки това, всички лекувани с MSG плъхове са имали значително високи нива на бъбречна фиброза в сравнение с контролите, което предполага фибротичния ефект на MSG, а не само бъбречна обструкция. Трудно е да се обяснят тези различни находки сред лекуваните с MSG животни, но отделните фактори биха могли да играят роля. В различен експеримент нашата група не успя да забележи променената бъбречна функция или камъни при плъхове на 1 месец, 3 месеца и 6 месеца лечение с MSG (непубликувани данни). Пол и др. Обаче съобщават за променена бъбречна функция и патология, но не и за бъбречните камъни. (2012) след 6 месеца перорално лечение с MSG с по-висока доза. Това показва, че дозата и продължителността на експозицията на MSG са жизненоважни за нейните нефротоксични ефекти, включително камъни и запушване.
Механичното нарушение в резултат на пълна обструкция на уретерите причинява тубулно увреждане, което води до провъзпалителни цитокини и тубуло-интерстициална фиброза [41]. Съответно, в експеримент с модел на плъхове с обструкция на уретера, изследователите установиха повишено 4-хидроксинонеално (4-HNE) оцветяване за ROS продукти в бъбречно тубуло-интерстициалното отделение [42]. Следователно може да се предположи, че уролитиазата и оксидативният стрес поради MSG могат да причинят фиброза в бъбреците, тъй като ROS може да индуцира трансформацията на фибробластите в миофибробласт [43]. Тубуларната интерстициална фиброза е силно свързана с развитието на бъбречните заболявания [44].
MSG-индуцирано генериране на ROS в бъбреците
Възможните механизми на индуцирана от MSG продукция на ROS в бъбреците са илюстрирани на фиг. 2. ROS възниква като страничен продукт от аеробния метаболизъм [45]. Основните места за производство на ROS са митохондриалната електронна транспортна система, пероксизомална мастна киселина, цитохром Р-450 и фагоцитни клетки [46, 47]. Едно проучване предполага, че митохондриалната електронна транспортна верига е основен източник на ROS в оксидативната глутаматна токсичност [48] и че извънклетъчното ниво на глутамат увеличава образуването на хидроксилни радикали [49]. Повечето клетъчни ROS възникват поради изтичане на електрони от митохондриалната дихателна верига. При нормални физиологични условия ROS, произведени като страничен продукт от метаболитните процеси, са напълно инактивирани от клетъчните и извънклетъчните защитни механизми. Хранителният метаболизъм може да повлияе на производството на оксидативен стрес в бъбреците, като промени енергийния метаболизъм. В този сценарий, α-кетоглутарат дехидрогеназата (α -KGDH) е основното място за контрол на метаболитния поток през цикъла на Кребс [50].
Предложен модел на индуцирано от MSG производство на ROS в бъбреците на плъхове. Глутаматът при хронична експозиция на MSG може да повиши активността на α-кетоглутарат дехидрогеназата, потенциален генератор на ROS. Освен това, повишеното вътреклетъчно ниво на калций чрез глутаматните рецептори може да стимулира генерирането на свободни радикали и липидната пероксидация. Инхибирането на поемането на цистин води до намалени нива на GSH, което може допълнително да насърчи ROS-медиирано увреждане на бъбречните клетки
α-кетоглутарат дехидрогеназа: ROS генератор
Неотдавнашно проучване показа, че повишената активност на α-KGDH е свързана с стимулираното от глутамат производство на ROS в бъбреците на плъхове [5]. Според това проучване глутаматът допринася с гориво за цикъла на Кребс и модулира редокс състоянието на клетката. Високата концентрация на глутамат може да увеличи градиента на митохондриалния протон в резултат на свръхпроизводството на електронен донор от цикъла на Кребс, което от своя страна може да увеличи производството на митохондриален супероксид. Този предложен механизъм се подкрепя от доказателства от мозъчни тъкани, където α-KGDH е потенциално място за генериране на ROS срещу глутамат [21]. E3 субединицата (липоамид дехидрогеназа) на α-KGDH може да активира кислород, което води до производството на супероксид и/или водороден прекис [51–53].
α-KGDH е ключов и може би ограничаващ скоростта ензим в цикъла на Кребс. Ензимът се инхибира от собствения си продукт, сукцинил-КоА, или от високо съотношение NADH/NAD +, както и от високо съотношение дихидролипоат/липоат, като по този начин играе важна роля в клетъчната редокс регулация [52, 54]. Въпреки това, повишеното ниво на сукцинил КоА лигаза в третираната с MSG бъбречна тъкан [5] може да благоприятства активирането на α-KGDH чрез консумация на сукцинил КоА, инхибитор. В допълнение, по време на оксидативния стрес сегмент от цикъла на Кребс се поддържа от глутамат чрез α-кетоглутарат [55]. Повишените нива на глицералдехид-3-фосфат дехидрогеназа, както се съобщава при лекуван с MSG бъбрек [5], също могат да причинят оксидативен стрес, тъй като е доказано, че изолираната глицералдехид-3-фосфат дехидрогеназа катализира NADH-зависимото производство на супероксид [56]. За отбелязване е, че NADH е един от регулаторите за активността на α-KGDH. Възможно е прекомерният метаболизъм на глутамат в бъбреците да отстрани бариерите пред α-KGDH и по този начин да промени редокс състоянието на клетката. По-нататъшни проучвания, изследващи връзката между енергийния метаболизъм и оксидативния стрес в лекувани с MSG бъбреци, са необходими за изясняване на това явление.
Глутаматни рецептори
Повечето изследвания в литературата свързват оксидативен стрес и увреждане на тъканите чрез глутаматния рецептор (N-метил-D-аспартат, NMDA) чрез калций (Ca 2+) при индуцирана от MSG бъбречна токсичност. На разположение на глутамата са две категории рецептори: йонотропни и метаботропни рецептори [57]. Почти всички известни глутаматни рецептори и много от взаимодействащите им протеини са открити в бъбреците [58–60]. Повечето от функционалните изследвания на бъбреците са изследвали NMDA рецептори, подтип на йонотропни рецептори и метаботропни глутаматни рецептори от група 1 (mGluRs).
NMDA рецепторите са Ca 2+, благоприятстващи затворените от глутамат йонни канали, докато mGluRs са свързани с G протеинови каскади [19, 61]. Функционалното значение на тези рецептори за нормалната физиология на бъбреците не е добре разбрано. Но повишената експресия на NR1 и NR2C на NMDA рецепторната субединица корелира с бъбречното увреждане при плъхов модел на нефтотоксичност на гентамицин [62]. Освен това, проучване, прилагащо NMDA рецепторни агонисти (глицин, глутамат) и антагонисти (MK 801, CPP) в клетки на бъбречна култура, демонстрира, че прекомерната стимулация или блокада на бъбречния NMDA рецептор води до клетъчна смърт [12]. Устойчивото активиране на тези рецептори предизвиква промени в клетъчната динамика на Ca 2+, които могат да предизвикат множество клетъчни реакции, включително активирането на азотен оксид синтаза и протеин киназа C [63, 64]. Те от своя страна могат да активират генерирането на свободни радикали и липидната пероксидация [65], което води до увреждане на клетките. Този механизъм на възбудотоксичност е описан не само в невроните, но и в белите дробове [19, 64]. В литературата обаче няма преки доказателства за проучвания, изследващи ролята на глутаматните рецептори срещу индуцирано от MSG увреждане на бъбречните клетки; експериментите с блокадата на NMDA рецептора за предотвратяване на MSG-индуцирана токсичност могат да бъдат убедителни.
Цистин-глутаматен антипортер
Цистин-глутаматният антипортер, обозначен като система xc -, обменя извънклетъчния цистин за вътреклетъчен глутамат в различни клетки [66]. Поглъщането на цистин в резултат на обмен между цистин и глутамат е от решаващо значение за поддържане на нивата на глутатион, критичен антиоксидант [67]. В условията на оксидативен стрес транспортната активност на този носител изглежда е регулирана нагоре [68, 69].
Като се има предвид факта, че системата xc - е силно изразена в бъбреците [70] и намалените нива на GSH са видни при индуцирана от MSG бъбречна токсичност, нашата група изследва нивото на експресия на системата xc - при остър и хроничен MSG-третиран бъбрек. Въпреки това, не са наблюдавани значителни промени на нивото на иРНК (непубликувани данни). За отбелязване е, че има и други незначителни транспортери за прием на цистин в клетката. В друго проучване се наблюдава значително инхибиране на поемането на цистин от глутамат в петдневно култивираните бъбречни тубулни клетки на плъхове, но не и в некултивирани клетки [71]. Въпреки тези констатации са необходими повече проучвания, за да се установи възможното участие на цистин-глутаматния антипортер в предизвиканото от MSG окислително увреждане на бъбреците. Тук е важно да се отбележи, че глутаматната токсичност в невронните клетки включва инхибиране на системата xc -, което води до оксидативен стрес [20].
Заключения
През последното десетилетие стана ясно, че хроничният прием на MSG има потенциални ефекти върху периферните органи като бъбреците. Намалените антиоксидантни ензими, повишената липидна пероксидация и тубуло-интерстициалната фиброза, предизвикани от високия прием на MSG, силно подкрепят теорията, че оксидативният стрес е от основно значение за индуцираната от MSG бъбречна токсичност, с α-KGDH като ключов играч. Също така, сега има доказателства, че прекомерното активиране на NMDA рецептора е токсично за бъбречните клетки. Трябва обаче да се установи по-ясна връзка между α-KGDH, глутаматните рецептори, цистин-глутаматния антипортер и хроничния прием на MSG, за да се осигури по-всеобхватен механизъм на бъбречния оксидативен стрес. Подходите, използващи високопроизводителни in vitro методи, са от решаващо значение.
Благодарности
Авторът би искал да благодари на асистент професор Убон Ча’он, доцент Витун Прасонгватана и доцент Сирират Реунджуй, медицински факултет, Университет Хон Каен, Тайланд за техните ценни коментари по време на редактирането на ръкописа. Специални благодарности на д-р Namraj Goire за прегледа на ръкописа.
Съкращения
| GSH | Глутатион |
| HNE | Хидроксинонеален |
| MDA | Малондиалдехид |
| MSG | Мононатриев глутамат |
| NAC | N-ацетилцистеин |
| NAD + | Никотинамид аденин динуклеотид |
| NMDA | N-метил-D-аспартат |
| ROS | Реактивни кислородни видове |
| α-KGDH | α-кетоглутарат дехидрогеназа |
Бележки под линия
Конкуриращи се интереси
Авторът заявява, че няма конкуриращи се интереси.
Принос на автора
AS концептуализира и написа ръкописа.
Информация за автора
В момента AS е докторант в болница Siriraj, медицински факултет, Университет Mahidol, Тайланд. AS има повече от три години опит по време на докторската си степен в университета Khon Kaen, Тайланд, в работата с свързаните с MSG бъбречни ефекти при плъхове. AS и неговите колеги публикуват статии, съобщаващи за причинено от MSG увреждане на бъбреците и оксидативен стрес в PLoS ONE.
- Бъбречна фиброза при котешки хронични бъбречни заболявания Известни медиатори и механизми на нараняване -
- Окислително увреждане на ДНК в кръвта на пациенти със ССЗ, приемащи Detralex
- Възстановяване на увреждане на бъбреците Dr
- Редки заболявания - по-рядко срещаните заболявания могат да причинят увреждане на бъбреците - Американски бъбречен фонд (AKF)
- Намалете увреждането на хроничното бъбречно заболяване с тези наблюдатели на промените в диетата