Wirginia Krzyściak
катедра по медицинска диагностика, Ягелонски университет, Медицински колеж, Фармацевтичен факултет, Краков, Полша
b Катедра по радиолиганд, Катедра по фармакобиология, Ягелонски университет, Медицински колеж, Фармацевтичен факултет, Краков, Полша
Агнешка Черняк
c Катедра по обща биохимия; Факултет по биохимия, биофизика и биотехнологии, Ягелонски университет, ул. Гроностайова 7, 30-387 Краков, Полша
Мариуш Козка
d Катедра по обща хирургия, Медицински колеж на Ягелонския университет, ул. Коперника 21, 31-501 Краков, Полша
Йоана Козиел
Катедра по микробиология, Факултет по биохимия, биофизика и биотехнологии, Ягелонски университет, ул. Гроностайова 7, 30-387 Краков, Полша
Резюме
Основната цел на докладваната тук работа е да се определи степента на окислителни/алкално-лабилни увреждания на ДНК в периферната кръв, както и в застоя на кръв от разширени вени на пациенти с хронично венозно заболяване. Освен това беше оценено определянето на въздействието на употребата на Detralex върху нивото на (окислителни) увреждания на ДНК при пациенти със ССЗ.
Степента на окислителни увреждания на ДНК е изследвана в група, състояща се от тридесет пациенти с диагностицирана хронична венозна недостатъчност (ХСН) във 2-ра и 3-та степен, според клиничното състояние, етиологията, анатомията и патофизиологията (CEAP) и са квалифицирани за хирургична процедура. Контролната група се състоеше от нормални доброволци (кръводарители), квалифицирани по време на стандартни прегледи в Регионални центрове за кръводаряване и кръвотерапия.
Анализът на кометите се използва за определяне на увреждания на ДНК.
Анализите на получените резултати показват повишаване на нивото на окислително/алкално-лабилно увреждане на ДНК в лимфоцити, произхождащи от антебрахиална кръв на пациенти със ССЗ в сравнение с контролната група (Контрол) (p Ключови думи: Реактивни кислородни видове (ROS), хронична венозна недостатъчност (CVI), микронизирана пречистена флавоноидна фракция (MPFF).
ВЪВЕДЕНИЕ
Хроничните венозни заболявания (ССЗ) представляват едно от най-старите известни хронични човешки заболявания. Най-ранните данни, описващи разширените вени, един от основните синдроми на хронична венозна недостатъчност (CVI) и лечението му, са датирани в древността [1].
В рамките на теориите, които се опитват да обяснят развитието на хронична венозна неефективност, ключовата роля играе „капанът на левкоцитите“. В това явление изключително важна роля играят активните кислородни видове (ROS) и реактивните азотни видове (RNS). Супероксидният анион (O2 -.), Хидроксилният радикал (OH˙), хидропероксидният радикал (HO2˙), хидроксипероксидът (H2O2), кислородният синглет (O2˙) участват в увреждането на околотъканните структури [2]. Окислителното увреждане на дезоксирибонуклеиновата киселина възниква поради действието на хидроксилните радикали (OH˙). Това явление се обяснява с две понятия. Първата концепция казва за реакция на генетичен материал с OH˙, който се генерира при реакция на Фентън с участието на йони Cu 1+ или Fe 2+. Втората концепция посочва повишено вътреклетъчно ниво на свободни Ca 2+ йони, което води до активиране на Ca 2+-зависими нуклеази, отговорни за разграждането на ДНК [3, 4]. Инициираните окислителни увреждания на ДНК причиняват нестабилност на генетичния материал поради мутация и накрая може да доведе до клетъчна смърт.
Човешките организми се опитват да бъдат защитени от окислителни промени по различни начини. На нивото на ДНК защитата се основава на два механизма за елиминиране на индуцираните от свободните радикали увреждания на ДНК. Първият от тях, основен ексцизионен ремонт (BER) премахва модифицирани нуклеотидни основи чрез хидролиза на N-гликозидна връзка чрез моно- и бифункционални гликозилази. Монофункционалните гликозилази прекъсват връзката между нарушената нуклеозидна основа и дезоксирибозната част, причинявайки генериране на непуринови и непиримидинови места. Освен отстраняването на модифицирана база и генерирането на непуринови и непиримидинови места, бифункционалните гликозилази имат лиазни свойства, които позволяват отстраняване на гореспоменатите места чрез β-терминация. След този механизъм в структурата на ДНК остава единична нуклеотидна празнина. От друга страна, NER механизмът не е толкова специфичен, колкото BER механизмът и изисква много енергия чрез ATP хидролиза. Следните модификации в конформацията на ДНК се отстраняват чрез NER механизъм: фотодимери, пиримидини, адукти с различни заместители, като 1, N2-пропано 2'-дезоксигуанозин адукт. Механизмът NER разчита на разцепване на неправилен фрагмент, съдържащ увреждане от нуклеаза и елиминиране на този фрагмент [5].
Разликата между тези два възстановяващи механизма се основава на факта, че BER възстановява уврежданията на ДНК, което не засяга спиралната структура на ДНК, докато NER е активен механизъм към увреждания, които променят конформацията на ДНК.
Във фармакотерапията на CVI се прилагат лекарства с естествен произход. Detralex (450 mg диосмин и 50 mg хесперидин) играе ключова роля тук. В други страни това лекарство се предлага на пазара под името Daflon 500. Ефективността на лекарството е проучена и потвърдена в многобройни клинични проучвания, включително проучване RELIFE, обхванало 23 държави [6].
ЦЕЛ НА РАБОТАТА
Целта на работата е проверка на изследователската хипотеза, ако нивото на увреждане на ДНК (алкално-лабилни/окислителни увреждания) в периферните кръвни лимфоцити (PBL) на пациенти с хронично венозно заболяване е по-високо, отколкото в контролна група (нормална популация).
Освен това се опитвахме да отговорим на въпроса дали терапията с флеботропно лекарство (Detralex) на пациенти с ХВН е свързана по някакъв начин с намаляване на нивото на тези увреждания.
МАТЕРИАЛИ И МЕТОДИ
Степента на окислителни увреждания на ДНК е изследвана в група, състояща се от десет пациенти с диагноза хронична венозна недостатъчност, във 2-ра и 3-та степен, според клиничното състояние, етиологията, анатомията и патофизиологията (CEAP). Тези пациенти са били квалифицирани за хирургическа процедура от февруари до май 2010 г. във II отделение по обща хирургия в Краков. Квалификацията на пациента за изследването е извършена от флеболог по време на ултразвуково изследване (USG) на венозни съдове на долните крайници (DOPPLER).
Биоетичният комитет на Ягелонския университет в Краков (KBET/162/B/2009) изрази положително одобрение за проучването.
Контролната група се състоеше от 30 нормални доброволци (кръводарители), квалифицирани по време на стандартните прегледи в Регионалните центрове за кръводаряване и кръвна терапия. Анализът на Комет, електрофореза на отделни клетки върху агарозни гелове, се използва за определяне на увреждания на ДНК [7]. Анализът на жизнеспособността на клетките с флуоресцеин диацетат (FDA) и етидиев бромид (EtBr) се използва за оценка на жизнеспособността на клетките преди всяко проучване [8]. Жизнеспособността на клетките е била над 95%.
Изолиране на лимфоцити от периферна и стазисна кръв
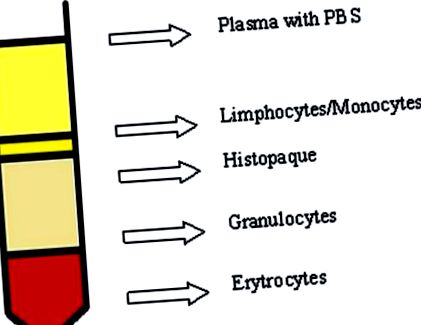
Венозна кръв се събира от болни и нормални донори в епруветки от полипропилен, съдържащи K2EDTA (1,5 mg/1 ml), стратифицирани леко по стената на епруветката Histopaqu-1077 (съотношение 1: 1), създавайки градиент на плътността. След това се центрофугира при стайна температура в продължение на 40 минути, 400 х g. След леко центрофугиране, прилагане на кръгово движение, лимфоцитният слой (Фиг. 1 1 ) беше прехвърлен в полипропиленови тръби (Falcon). Към събраните лимфоцити се добавя студен PBS без Ca 2+ и Mg 2+ йони и цялата смес се центрофугира при 4 ° С в продължение на 10 минути при 700 × g. Тази стъпка се повтори два пъти. Клетките бяха преброени с използване на Bürker камера и суспендирани по-късно в 2 × 106 клетки/ml концентрация на PBS. Така приготвената клетъчна суспензия се замразява при -80 ° C в кутия, пълна с изопропанол в среда, съдържаща 90% FBS + 10% DMSO.
Центрофугиране с градиент на плътността.
Жизнеспособност на клетките
За определяне на броя на живите клетки към общия обем се добавят 25 µl работен разтвор [25 µl FDA в ацетон (5 mg/ml), 350 µl EtBr (10 × разреден в PBS) и 4,8 ml PBS]. 20 µl (1 капка) клетъчна суспензия. Пет минути по-късно броят на живите клетки се изчислява върху предметни стъкла под флуоресцентен микроскоп с използването на син филтър. Общият брой на клетките, както и общият брой на живите клетки се определя като процент на живите клетки. Живите клетки са боядисани с флуоресцеин в зелен цвят, а ядрата на мъртвите клетки са боядисани с етидиев бромид в оранжев цвят (Фиг. 2 2 и 3 3 ). На всяка секция бяха преброени поне 200 клетки.
Определяне на жизнеспособността на клетките.
Работен модел на FDA тест: флуоресцеинът се агрегира в клетки с непокътната клетъчна мембрана; флуоресцеин изтича от клетки с прекъсната мембрана, етидиев бромид се свързва с нуклеинови киселини. Изображение от флуоресцентна микроскопия (10x величина): ядра на мъртви клетки (червен цвят), оцветени с етидиев бромид.
Алкална електрофореза на отделни клетки в агарозен гел по метод на кометата
Окислителните увреждания на ДНК се изследват чрез електрофореза на единична клетка в агарозен гел [7]. Определянето на окислителните щети се основава на откриването на 8-оксогуанин с използването на формамидопиримидин ДНК гликозилаза (Fpg) [9].
По време на първия етап от проучването бяха подготвени секции. За тази цел предварително изолирани и замразени (при - 80 ° С) лимфоцити се размразяват във водна баня при 36 ° С, което позволява да се запази висока жизнеспособност на клетките (над 95%). След това клетките се суспендират в студен PBS (4 ° С) и се получава обща концентрация от 1,5 х 106 клетки/ml. Такива подготвени проби се центрофугират при 230 × g за 8 минути при 4 ° С (центрофуга с хоризонтален ротор). Измиването с PBS се повтаря три пъти, като се спазват същите условия, както споменатите по-горе.
Клетъчната суспензия (30 000 клетки) при обем от 85 µl се суспендира отново в 225 µl (0,5%) агароза с ниска точка на топене (LMPA) и се оставя във водна баня (37 ° С). След това обемът от 100 µl клетки в агароза се намазва върху предметни стъкла, които по-рано се покриват с тънък слой (100 µl) от 0,5% нормална точка на топене агароза (NMPA) и се оставят да изсъхнат. Слайдовете бяха покрити с капаци и поставени върху леда. След 10 минути покривните фишове бяха премахнати и предметните стъкла бяха поставени в лизисния буфер (2.5 M NaCl, 100 mM EDTA, 10 mM Tris, рН 10, с добавяне на 1% Triton X – 100 и 10% DMSO) за 1 h при 4 ° C на тъмно, за да се елиминират допълнителните увреждания на ДНК.
След лизис срезовете се поставят в редестилирана вода и се измиват два пъти със студен HEPES буфер (40 mM HEPES; 0,1 M KCl; 0,5 mM EDTA; 0,2 mg/ml BSA, pH 8,0 с KOH; 10 × концентриран, съхраняван при -20 ° ° С). Постигната е оптимална среда за ензимно действие (формамидопиримидин ДНК гликозилаза). Във всяка секция се капват 50 ul Fpg, 0,1 U/ml. Слайдовете само с буфер HEPES бяха използвани като контрола.
Схематично представяне на кометния анализ, включващ специфична за лезията формамидопиримидин ДНК гликозилаза (Fpg).
РЕЗУЛТАТИ
Потвърдена е хипотезата за ефекта на CVI върху алкално-лабилни ДНК увреждания на лимфоцити от човешка кръв.
В реакцията на Хабер-Вайс, в присъствието на свободни железни йони, с участието на реактивни биологично частично редуцирани кислородни форми (O2 - и H2O2), се образува OH • свободен радикал, който може да реагира с всяка биологична молекула, намираща се в неговия пряк квартал.
OH • радикалът е строго реактивен, неговият цитотоксичен ефект се отнася и до молекулите на ДНК, причинявайки разкъсвания в ДНК веригите (образувайки 8-хидрокси-2’-деоксигуанозин) [13].
По време на реакцията на свободните радикали, пуриновите основи, принадлежащи на ДНК, могат да бъдат окислени, особено в позиция 8 на пуриновия пръстен. Един от продуктите, образувани след тази реакция, е 8-хидрокси-2-дезоксигуанозин нуклеозид.
По-голям брой окислителни увреждания на ДНК се наблюдава при остра лимфобластна левкемия [14], при което нивото на урина от 8 – хидрокси-2 ’–дезоксигуанозин (8-OH-dG) се повишава. Нивото на окислителни увреждания на ДНК се увеличава с 50% при нормални доброволци с едновременно намаляване на антиоксидантната защита поради намаляване на нивото на витамин С (от нивото от 250 mg/ден на 5 mg/ден). Окислителните увреждания на ДНК се увеличават с 50% [15]. Окислителните увреждания на ДНК придружават множество заболявания, при които ROS играят важна роля. Гореспоменатото явление е представено в табл 1 1 .
маса 1
Болести, при които се наблюдава повишено ниво на окислителни ДНК увреждания
| Остра лимфобластна левкемия | FapyGua, 8-OH-Gua, FapyAde, 8-OHAde, 5-OH-Cyt, 5-OH-5-MeHyd, 5-OH-Hyda (ДНК | Значително увеличение на нивото на увреждане на ДНК при ALL в сравнение с контрола (p -. | = Супероксиден анион |
| ОН ˙ | = Хидроксилен радикал | ||
| HO2 ˙ | = Хидропероксиден радикал | ||
| H2O2 | = Хидрокси пероксид | ||
| O2 ˙ | = Синглет с кислород | ||
| 8-оксо-гуа | = 8-оксогуанин | ||
| ХмУра | = 5-хидроксиметилурацил | ||
| BER | = Основен ексцизиен ремонт | ||
| API | = Активна фармацевтична съставка | ||
| GST | = Глутатион S-трансфераза | ||
| K2EDTA | = Етилендиаминтетраоцетна киселина дикалиева сол | ||
| PBS | = Буфериран с фосфат физиологичен разтвор | ||
| FBS | = Фетален говежди серум | ||
| DMSO | = Диметилсулфоксид | ||
| LMPA | = Агароза с ниска точка на топене | ||
| NMPA | = Нормална точка на топене агароза | ||
| Fpg | = Формамидопиримидин ДНК гликозилаза | ||
| HEPES | = [4- (2-хидроксиетил) -1-пиперазинетансулфонова киселина] |
ИЗЯВЛЕНИЕ ЗА АВТОРСТВО
WK замисля проучването и участва в неговото проектиране, извършва проби, анализира пробите, прави всички експерименти по време на проучването, извършва статистически анализ и анализ на данни и пише ръкописа. AC участва в дизайна на проучването, изображението на профила. MK участва в дизайна на проучването, събира клиничен материал. JK участва в проектирането, провеждането и записването на учебни предмети. Всички автори прочетоха и одобриха окончателния ръкопис.
- Мононатриев глутамат-индуцирано оксидативно увреждане на бъбреците и възможни механизми мини-преглед
- Удряйте Spike, контролиращ кръвните захари след хранене - поемане на контрол върху диабета
- Повечето пациенти с подагра спират да приемат лекарствата си - и разчитат твърде много на диетични средства за защита
- Натуралният сок от нар намалява възпалението, увреждането на мускулите и повишава нивата на тромбоцитите в кръвта
- Предпазни мерки при пациенти, приемащи тамоксифен