Лутер А. Бартелт
1 отдел по инфекциозни болести и международно здраве, Университет на Вирджиния, Box 801340, Charlottesville, VA 22908, САЩ
Р. Балфур Сартор
2 Отдел по гастроентерология, Център за гастроинтестинална биология и болести, Университет на Северна Каролина в Chapel Hill, Campus Box 7032, Chapel Hill, NC 27599-7032, САЩ
Резюме
Giardia lamblia е бичков протозой, който е най-честата причина за чревна паразитна инфекция при деца, живеещи в ограничени ресурси. Патогенността на Giardia се обсъжда откакто паразитът е идентифициран за първи път и клиничните резултати варират в различните проучвания. Сред последните объркващи констатации са диаметрално противоположни асоциации между Giardia и остра срещу персистираща диария и слабо разбран потенциал за дългосрочни последствия, включително нарушен детски растеж и когнитивно развитие. Механизмите, движещи тези протеинови клинични резултати, остават неуловими, но последните постижения предполагат, че вариабилността на щамовете Giardia, хранителния статус на гостоприемника, състава на микробиотата, коинфекцията на ентеропатогени, генетично обусловените имунни отговори на лигавицата и имунната модулация от Giardia са всички релевантни фактори повлияване на проявите на болестта след инфекция на Giardia.
Въведение
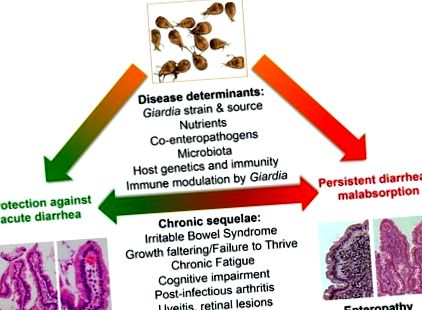
Антон ван Левенхук за пръв път идентифицира Джиардия в собствения си диаричен стол през 1681 г., но паразитът става официално признат от СЗО патоген едва през 1981 г. Дори след като Теодор Наш и колеги [30] изпълняват постулатите на Робърт Кох при човешки доброволци през 1987 г. [20], беше обсъдено заболяване, свързано с Giardia. Усложняването на това клинично равновесие е преобладаването на очевидно асимптоматични гостоприемници и все още неуловими механизми, обясняващи как някои индивиди развиват характерния синдром на лямблиоза: спазми в корема и подуване на корема, малабсорбтивна диария (стеаторея) и загуба на тегло [18]. Освен това, по неясни причини, хроничните последствия, включително постинфекциозен синдром на раздразнените черва, хронична умора [31], недохранване [32], когнитивно увреждане [33] и извън чревни прояви (като хранителна алергия, уртикария, реактивен артрит, и възпалителни очни прояви), могат да се развият и евентуално да продължат извън откриваемото отделяне на паразити (Фигура 1).
Глобалните усилия за подобряване на детското здраве в ограничени от ресурсите условия локализират инфекциите на Giardia сред по-широкия контекст на детското недохранване, множество разнообразни и чести експозиции на ентерични патогени [34] и нови разбирания за ролята на ентеропатията в околната среда (форма на хронична стомашно-чревна система) дисфункция и възпаление, включващи преди това нареченото клинично състояние „тропическа ела“) [11,35] и микробиота [36] за развитието и растежа на детството. Най-новите анализи, оборудвани с по-строги методи за наблюдение и по-чувствителна молекулярна диагностика [37–39], не само повториха широкия диапазон на вариабилност на резултатите от педиатричната инфекция на Giardia, наблюдавани в предишни проучвания [3], но разкриха много по-голяма тежест от експозиция от оценките, базирани на микроскопски техники [39,40]. Тези и други проучвания са повдигнали провокативни съображения, включително възможността Giardia да бъде защитна срещу остра диария [41–43].
В светлината на не напълно разбраната патология, свързана с инфекцията на Giardia, неотдавнашният напредък в биологията на паразитите и стомашно-чревния тракт се надява да изясни как и кога Giardia причинява заболяване. Тези постижения се отнасят до основни въпроси относно това как Giardia взаимодейства в рамките на сложната екология на микробните, хранителни и гостоприемни фактори в тънките черва, детерминантите на чувствителността на гостоприемника и дали и как възпалението на гостоприемника допринася за патогенезата (Фигура 2).
Ендемична детска равновесие на лямблиоза
Неразширяваща се вирулентност и патогенност на щама
От най-малко шест признати вида Giardia, само G. lamblia причинява инфекции при хората. Изолатите на G. lamblia се разделят допълнително на осем групи, обозначени от А до Н. Сред групите само групи А и В и съответните им подтипове причиняват инфекция при човека. Относителното съотношение на инфекция от група А към инфекция от група В варира както във времето, така и в пространството, с предразположение към повече инфекции от група В в ендемични условия [87–90].
Последователността на целия геном разкрива, че лабораторните изолати на група А и група В са доста различни и могат да бъдат по-добре категоризирани като отделни видове [91]. Въпреки тази генетична дивергенция, опитите за приписване на клинична вариабилност и патогенност въз основа на обозначението на сглобяването са неубедителни. В отделни проучвания или сбор А [92,93], или сбор В [94,95] по-силно се свързва с диария. Ограничение при оценка на патогенността, специфична за асемблаж при естествено придобита инфекция, е, че целите, използвани за разграничаване на асемблажи А и В - β-гиардин (bg), глутамат дехидрогеназа (gdh), триозна фосфат изомераза (tpi) и малката субединица 18S рРНК гени - не са известни фактори на вирулентност. Освен това, проучвания, които включват мултилокусно генотипиране, показват значителен дял от проби със смесени резултати [96,97], повишавайки възможността за хетероложни инфекции или дори събития от рекомбинация между събранията [98,99]. Разширените сравнителни геномни проучвания, изследващи няколко изолати от група А и група В, могат допълнително да изяснят специфичната за щама патогенност.
Напредъкът в биологията на Giardia и генната регулация, използвайки транскриптомен и протеомичен подход, има за цел да идентифицира нови черти на вирулентност, които биха могли да бъдат потвърдени при човешки инфекции. Например, като възможно средство за избягване на хуморална и вродена защита на гостоприемника, Giardia има репертоар от 20 до 200 kDa богати на цистеин протеини, които плътно покриват повърхността на трофозоитите, наречени варианти на повърхностни протеини (VSP). Въпреки че само един VSP се експресира върху отделен трофозоит, ширината на потенциалните VSP (73 до 270 или повече) [91, 107] в даден щам е свързана с повишена вирулентност [108]. Как превключването на VSP се случва на всеки 6-13 поколения и какви събития предизвикват регулиране на VSP след транскрипция [107,109] и трафикът може да помогне за разгадаването на паразитни детерминанти на преходна колонизация, противоположна на хроничната инфекция. Ролята на катепсините на Giardia като детерминанти на заболяването също изисква по-нататъшно разглеждане [102,103].
Хранителни детерминанти на заболяването
Все повече се признава сложна връзка между храненето на гостоприемника и имунните реакции на лигавицата. Децата с недохранване например са намалили сероконверсията към някои компоненти на оралната полиомиелитна ваксина [125]. В експериментални модели недохранването дава повишена чувствителност към Cryptosporidium [126–128] и ентероагрегативна Escherichia coli (EAEC) [129]. Недостигът на цинк повишава чувствителността към Giardia [130] и намалява възпалителните реакции към EAEC [131]. В модела на хронична лямблиоза, недохранването с протеини води до намалена експресия на IL-4 и IL-5 и намалява популациите на В-клетки в чревните тъкани, притъпяване на вили и нарушение на растежа въпреки паразитно бреме, подобно на това на добре подхранените заразени контроли [ 85]. Тези открития предполагат, че при деца с хронична лямблиоза хранителният статус може по същия начин да определи тежестта на заболяването.
Взаимодействия между микробиота и копатогени
Отговори на домакините и патогенеза на заболяването
Двойствеността на имунния отговор на гостоприемника при патогенезата на Giardia е сложна и е прегледана подробно [83,154]. Все по-често се идентифицират излишни механизми на имунологичен контрол, включително хемокини (CCL2, CCL20, CXCL1, CXCL2 и CXCL3) от епителни клетки [155], IL-6, получени от дендритни клетки и евентуално мастоцити [156–158], TNF -α [159], α-дефензини, активирани от матрична металопротеаза 7 (Mmp7) [159], и азотен оксид, генериран от азотен оксид синтаза 1 (NOS1) или NOS2 [159–161]. Данните от изолирани огнища и експериментални модели показват смесен имунен отговор, състоящ се както от производството на антитела [162,163], така и от лигавицата и системните Th1-тип CD4 + Т-клетъчни отговори [84,164,165]. Изследвания при популации със серийни огнища показват, че излагането на Giardia може да повиши защитния имунитет [166], който се характеризира с преобладаване на циркулиращи Т клетки с фенотип Th1-памет (CD25 + CD26 ярки клетки, които произвеждат IFN-γ) [165] . Също така, липсата на CD4 + Т клетки води до по-продължителна инфекция в експериментални модели [84].
Въпреки доказателствата за ролята на Т-клетките в защитния имунитет, клиничните наблюдения показват, че хуморалните отговори са критични за имунитета. Тези проучвания демонстрират по-голямо разпространение на кисти на Giardia и повече симптоматика при пациенти с хипогамаглобулинемия (т.е. х-свързана агамаглобулинемия [болест на Брутон] и обща променлива имунна недостатъчност) [167–169], отколкото тези с дефицит на Т-клетки (напреднал СПИН или аплазия на тимуса ). Намален секреторен IgA варира асоциирано с повишен риск [170] и нарушени IgA отговори се наблюдават при деца с персистираща инфекция на Giardia [171]. При животински модели по-голямата част от гените, експресирани при експериментални миши инфекции, са свързани с производството на антитела [159], а мишките с дефицит на IgA нокаут имат затруднения при изчистването на Giardia [172]. Полимерният Ig рецептор, който транспортира IgA и IgM през епитела, е от съществено значение за елиминирането на G. muris от миши гостоприемници, като допълнително подкрепя възможната зависимост от отговорите на секреторните антитела на лигавицата за ликвидиране на инфекцията [173].
Такива хронични и повтарящи се излагания на Giardia са често срещани при деца в условия с ниски доходи, които също имат високо разпространение на недохранване и все по-често призната дисфункция на червата с хронично чревно възпаление, повишена пропускливост на червата и намалена дължина на вилусите, наречена ентеропатия на околната среда [11]. Малко проучвания характеризират имунния отговор на Giardia при тези деца. Kohli и колеги [87] идентифицират възпалителна диария чрез използване на фекален лактоферин по време на първия случай (но не и следващите случаи) на Giardia, а Long и колеги [176] демонстрират повишен IL-4, IL-5, моноцитен хемоаттрактант протеин-1 (MCP) -1) и IFN-y, но намалява IL-8 при деца с по-продължителни епизоди на Giardia. По този начин връзките между чревния възпалителен отговор и инфекцията на Giardia могат да повлияят на резултатите от заболяването при тези деца.
Заключения
G. lamblia остава загадъчен паразит с потенциално влияние върху здравето и развитието при деца в ендемични условия, ограничени от ресурси, където инфекцията е почти универсална. Един извод, обясняващ променливите резултати както при полеви проучвания, така и при експериментални модели, е, че Giardia може да не отговаря на традиционните концепции за „коменсалния“ или „патогенния“ микроб и понякога може да насърчава състояния или на лигавична защита, или на заболяване. Следователно, разпознаването на преките ефекти на различни щамове на Giardia от непреки ефекти, медиирани чрез влиянието на паразита върху сложна и динамична луминална екология и хомеостаза на лигавицата на гостоприемника, ще бъде критична стъпка към превръщането на основните лабораторни открития в резултатите от човешкото заболяване. Такова разбиране може да доведе до подобрени интервенции за хронична лямблиоза, както и ентеропатия в околната среда и недохранване в детска възраст, като същевременно идентифицира свойствата на организма, които могат да бъдат използвани за укрепване на човешкото здраве.
Благодарности
Благодарим на Richard L. Guerrant, Cirle A. Warren, Leana Guerin, Scott Dawson и Jörg-Dieter Schulzke за техните прозрения и съдействие при подготовката на фигурата. Получена е подкрепа от Националния здравен институт/Национален институт по алергия и инфекциозни болести K08-AI108730-01 на Luther A. Bartelt.
Съкращения
| APO-E | аполипопротеин Е |
| КОТКА | катионен транспортер |
| CI | доверителен интервал |
| EAEC | ентероагрегативна ешерихия коли |
| IFN-γ | интерферон-гама |
| I Л | интерлевкин |
| NOS | азотен оксид синтаза |
| ИЛИ | отношение на шансовете |
| TLR | Тол-подобен рецептор |
| TNF-α | фактор на туморна некроза-алфа |
| VSP | вариант повърхностен протеин |
| СЗО | Световна здравна организация |
Бележки
Електронната версия на тази статия е пълна и може да бъде намерена на: http://f1000.com/prime/reports/b/7/62
Бележки
Разкриване
Авторите декларират, че нямат разкрития.
- 8-ма конференция за последните постижения в превенцията; Лечение на детско и юношеско затлъстяване
- 4 съвета за управление на фондация за хроничен болков артрит
- Ползи от мед; Упражнение; Хронична сила
- 4 начина да помогнете на пациенти с хронично заболяване да направят диетични промени Американска медицинска асоциация
- Интегрирана рамка за профилактика и лечение на затлъстяването и свързаната с него хронична болест