Свързани термини:
- Хиперурикемия
- Синдром на Леш-Найхан
- Пикочна киселина
- Ензим
- Автоматизация
- Пурин
- Подагра
- Урат
- Хипоксантин фосфорибозилтрансфераза
Изтеглете като PDF
За тази страница
Пуриновият метаболизъм в патогенезата на хиперурикемията и вродените грешки на пуриновия метаболизъм, свързани с болестта
Роза Торес Хименес, Хуан Гарсия Пуиг, в Подагра и други кристални артропатии, 2012 г.
Нарушения на пуриновия метаболизъм: Класификация
Някои ензимни дефекти на въглехидратния метаболизъм (заболявания на съхранението на гликоген) са свързани с хиперурикемия и подагра 8 (фиг. 3-2). Гликогенозата от тип I, поради дефицит на глюкозо-6-фосфат, компрометира дефосфорилирането на глюкозата и може да увеличи концентрациите на серумен урат чрез двоен механизъм: повишено производство на лактат, което може да попречи на екскрецията на пикочна киселина с пикочната система 9 От друга страна, хиперурикемията при гликогеноза тип I може също да е резултат от повишен синтез на хипоксантин, ксантин и пикочна киселина поради засилено разграждане на АТФ и повишено производство на АМФ. 10 При гликогеноза типове III, V и VII, синтезът на ацетил-КоА е нарушен, което води до лоша ефективност на лимоновия цикъл с намалено производство на АТФ. 10 За да се компенсира това, аденин-нуклеотидният цикъл свръхпродуцира фумарат, за да стимулира активността на цикъла на Кребс. Свръхактивността на адениновия нуклеотиден цикъл води до повишено образуване на IMP от AMP, което може да влезе в пътя на разграждане на пуриновия нуклеотид, което води до повишен синтез на пикочна киселина 10 (вж. Фиг. 3-2).
Определение
Подаграта е наследствено нарушение на пуриновия метаболизъм, което причинява хиперурикемия при хората, особено при мъжете. Терминът "подагра" в обща употреба се отнася до форма на артрит. Обикновено повишените нива на пикочна киселина в кръвта (серумно-уратни нива> 7 mg/dl при мъжете и> 6 mg/dl при жените) карат мононатриевите уратни кристали да се отлагат в ставите, костите и подкожните тъкани. Възпалителните реакции към тези кристали водят до тежки повтарящи се пристъпи на остър артрит. Диагнозата на подагра се потвърждава от демонстрацията на отрицателно двупречупващи кристали в течността на синовиалната става.
Ухо и темпорална кост
Тофтална подагра
Тофалната подагра е нарушение на метаболизма на пурините или бъбречната екскреция на пикочна киселина. Мононатриевият урат се утаява, оставяйки отлагания (тофи) в тялото. Едно от най-често срещаните места на подагричен тофи е спиралата на ухото. На това място тофите са безболезнени, твърди възли. Подаграта може да се появи като наследствена или придобита болест. Първичната подагра (90% от случаите) е наследствена грешка в метаболизма, която е резултат или от ензимен дефект в пуриновия синтез, или от дефект в бъбречната екскреция на пикочна киселина. Вторична или придобита подагра (10% от случаите) се появява при нарушения, които увеличават производството на пикочна киселина (напр. Левкемии) или намаляват нейната екскреция (напр. Хронична бъбречна недостатъчност).
Хистологично подагричният тофи е съставен от иглени агрегати от уратни кристали с гигантска клетъчна реакция на околното чуждо тяло. Ако има съмнение за диагноза подагра, резецираната тъкан трябва да бъде фиксирана в абсолютен алкохол или какъвто и да е неводен фиксатор, тъй като кристалите на уратите са водоразтворими.
Лечението е насочено към системното разстройство.
Неврологични аспекти на системното заболяване, част II
Роджър Е. Кели, Ханс С. Андерсон, в Наръчник по клинична неврология, 2014
Най-често срещаното нарушение на пуриновия метаболизъм е подаграта. Това засяга приблизително 1-2% от населението и се характеризира с хиперурикемия с отлагане на уратни кристали, водещо до нефролитиаза и възпалителен артрит (Schlesinger, 2010). Развитието на подагра е многофакторно в патогенезата, въпреки че се съобщава за автозомно доминираща младежка подагрична нефропатия (Calabrese et al., 1990). Това генетично медиирано разстройство е свързано с намален бъбречен клирънс на урат, а не с нарушени метаболитни пътища на пурина. Установени са мутации на гена UMOD, който кодира уромодулин, известен също като гликопротеин Tamm-Horsfall (Turner et al., 2003). Възможно е развитие на бъбречно заболяване в краен стадий, свързано с образуването на бъбречно-медуларни кисти.
Освен нарушените метаболитни пътища на пурина и намаленият бъбречен клирънс на пикочната киселина, други обяснения за хиперурикемията, наблюдавана при подагра, включват размер на пуриновия нуклеотиден пул, засилен катаболизъм на пуринови аналози, включително нуклеинови киселини, увеличен оборот на предварително оформени пурини и съпътстващи заболявания, свързани с повишени нива на пикочна киселина, като болестно затлъстяване, хиперлипидемия, злокачествено заболяване, сърповидно-клетъчна болест, заболяване за съхранение на гликоген, диета (месо, морски дарове, бира, спиртни напитки), както и фамилна предразположеност.
Подаграта обикновено не е пряко свързана с неврологично заболяване. Въпреки това може да има вторични ефекти. Например, свързано с UMOD бъбречно заболяване може да доведе до уремична енцефалопатия, ако не се лекува правилно с хемодиализа. Освен това, така наречената рискова триада за насърчаване на атеросклероза при пациенти с подагра включва възпаление, оксидативен стрес и хиперлипидемия (Krishnan et al., 2008). Това може да увеличи риска от мозъчно-съдови заболявания като усложнение на тази триада.
Лечението на подагра включва профилактика с диета с ниско съдържание на пурини и агент алопуринол, който блокира превръщането на хипоксантин в по-малко разтворимия ксантин чрез инхибиране на ксантиноксидазата. Острите пристъпи обикновено се лекуват или с колхицин, или с нестероидни противовъзпалителни средства.
Детска неврология Част III
H.A. Джина,. Джордж Ван Ден Берге, в Наръчник по клинична неврология, 2013
Други пуринови нарушения
Общ преглед
Има няколко други нарушения на пуриновия метаболизъм, при които неврологичните характеристики се характеризират по-слабо или са достъпни само за малък брой пациенти (Camici et al., 2009). При някои от тези нарушения неврологичните особености са несъвместими, което поражда въпроси относно връзката им с метаболитното разстройство. Най-разпространените от тях са описани по-долу и обобщени в таблица 187.1 .
Дефекти на фосфорибозилпирофосфат синтазата
Фосфорибозилпирофосфат (PRPP) синтазата дава пример за това как различните мутации в един и същ ген могат да доведат до различни клинични фенотипове. Мутациите в гена PRPS1, които повишават активността на PRPP синтазата, водят до сензоневрална загуба на слуха. Приблизително половината от тези пациенти също имат психомоторно забавяне в различна степен.
Мутациите в гена PRPS1, които намаляват, но не елиминират активността на PRPP синтазата, са свързани с някои случаи на синдрома на Charcot-Marie-Tooth, тип CMTX5. Засегнатите лица имат сензоневрална загуба на слуха, оптична невропатия и периферна сензомоторна невропатия. Мутациите, водещи до нулева PRPP синтаза, са свързани със синдрома на Артс, който се характеризира със загуба на слуха и зрението, психомоторно забавяне и повтарящи се инфекции.
Механизмите, чрез които аномалиите в PRPP синтазата причиняват неврологична дисфункция, не са известни. PRPP служи като косубстрат за разнообразно семейство ензими, само три от които участват директно в метаболизма на пурините. Те включват първата и ограничаваща скоростта стъпка на ново пуриновия синтез (амидофосфорибозилтрансфераза (AMPRT)), както и два рециклиращи ензима (APRT и HPRT). Клиничните синдроми, свързани с PRPP синтазни дефекти, не приличат на синдромите, свързани с APRT или HPRT дефекти. По този начин неврологичните прояви, свързани с PRPP синтазата, могат да бъдат резултат от промени в непуриновите пътища.
Дефицит на пуринов нуклеотид фосфорилаза
Дефицитът на пуринова нуклеотидна фосфорилаза (PNP) обикновено се проявява с аномалии, свързани с имунната система. Повечето пациенти имат различна степен на имунна недостатъчност, а една трета имат автоимунни заболявания. Приблизително половината проявяват неврологични характеристики. Има широк диапазон на тежест. По-тежко засегнатите лица проявяват тежка психомоторна изостаналост, докато по-слабо засегнатите лица могат да имат само леки двигателни или когнитивни аномалии. Причината за забележимата променливост на неврологичните затруднения остава несигурна. Някои от неврологичните проблеми могат да са резултат директно от ензимния дефект, докато други могат да бъдат вторични спрямо имунните дефекти или взаимодействието с други неизвестни наследствени или придобити фактори.
Дефицит на аденозин дезаминаза
Дефицитът на аденозин дезаминаза (ADA) най-често се проявява със синдрома на тежка комбинирана имунна недостатъчност, със смъртоносни инфекции в ранна детска възраст. Децата, които оцеляват с лечения, включващи трансплантация на костен мозък или заместване на ензими, понякога развиват неврологични затруднения с напредването на възрастта. Проблемите могат да включват психомоторно изоставане, гърчове или загуба на слуха. Някои от тези проблеми могат да са резултат директно от ензимния дефект, докато други може да са резултат от хронична инфекция или тяхното лечение.
Дефицит на дезоксигуанозин киназа
Ензимът дезоксигуанозин киназа (dGK) е митохондриален и неговият дефицит се проявява с тежка форма на синдроми на изчерпване на ДНК на митохондриите. Повечето пациенти имат чернодробна недостатъчност и тежка психомоторна изостаналост малко след раждането. Фатален мултиорганен отказ е често срещан през първата година от живота.
Дефицит на IMP дехидрогеназа
Мутациите в гена, кодиращ IMP дехидрогеназа (IDH) 1, са свързани с пигментозен ретинит тип 10 и някои случаи на вродена амавроза на Лебер.
Уролитиаза и нефрокалциноза в детството
Бернд Хопе,. Dawn S. Milliner, в Комплексна детска нефрология, 2008
Ксантин
Ксантинурията е рядко автозомно-рецесивно разстройство на пуриновия метаболизъм, което води до уролитиаза. 83 Дефицитът на ксантин оксидоредуктаза или дехидрогеназа, който катализира последните две стъпки от разграждането на пурина, води до производството на големи количества ксантин и хипоксантин, свързани с намаленото производство на пикочна киселина. Ксантиновите камъни могат да се образуват на всяка възраст, дори при кърмачета, в резултат на слабата разтворимост на ксантина. Съществува обаче голяма клинична вариабилност, която не се обяснява с генетичния дефект; само около половината от всички пациенти имат уролитиаза. 83 Острата бъбречна недостатъчност, причинена от кристална нефропатия, е рядко усложнение. 84 Повечето пациенти са от близкоизточен или средиземноморски произход. 83 Ксантинурия е рядкост в други части на света.
Диагнозата се поставя чрез анализ на камъни или от наличието на прекомерна екскреция на ксантин в урината. Подсказка е откриването на оранжево-кафява уринарна утайка, оцветени в оранжево пелени, 85 или дълбока хипоурикемия, която често се открива случайно.
Известни са два вида класическа ксантинурия. При тип I преобразуването на алопуринол в оксипуринол не е нарушено, докато при тип II допълнителният дефицит на алдехид оксидаза блокира превръщането на алопуринол в оксипуринол. И двата типа са клинично идентични и се предполага, че са причинени от различни мутации на един и същ ген XDH.
За разлика от двата типа класическа ксантинурия, ксантинурията, произтичаща от вроденото отсъствие на молибденов кофактор с комбиниран дефицит на ксантин дехидрогеназа/сулфит оксидаза, е сложно заболяване. Такива пациенти обикновено се срещат с неонатални гърчове, тежки неврологични симптоми и дисморфични черти и отделят сулфоцистеинова киселина с урината. 83
Вторичните ксантинови камъни и дори ксантиновата нефропатия могат да се развият в резултат на лечението с алопуринол на тежка хиперурикемия, свързана с брутното свръхпроизводство на пикочна киселина, както се наблюдава при синдрома на Lesch-Nyhan и при миелопролиферативните нарушения. Такива камъни обаче често съдържат допълнителни съставки освен ксантин. 83
Синдром на Леш – Найхан
Лора Де Грегорио, Уилям Л. Найхан, в Енциклопедия на неврологичните науки, 2003
Биохимична основа
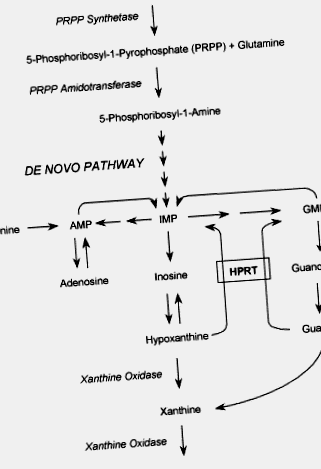
Синдромът на Lesch – Nyhan (LNS) е генетично нарушение на пуриновия метаболизъм, причинено от почти пълен дефицит на ензима HPRT. HPRT катализира реакцията на рециклиране, при която свободните пуринови основи хипоксантин и гуанин се използват повторно, за да образуват съответните им нуклеотиди, инозинова и гуанилова киселини. Този механизъм за спасяване на пурини осигурява алтернативен и по-икономичен път към синтеза на ново пуринови нуклеотиди. Пикочната киселина е крайният продукт на пуриновия метаболизъм. При липса на спасителния път се получават прекомерни количества пикочна киселина (фиг. 1). По този начин хиперурикемията е общата характеристика на всеки тип дефицит на HPRT.
Фигура 1 . Диаграма на пуриновите метаболитни пътища. AMP, аденозинова киселина; IMP, инозинова киселина; GMP, гуанилова киселина; HPRT, хипоксантин гуанин фосфорибозилтрансфераза.
Преглед на самонараняващото се поведение и болка при хора с увреждания в развитието
1 СИНДРОМ НА LESCH-NYHAN
LNS (Lesch & Nyhan, 1964) е свързано с пола нарушение на пуриновия метаболизъм, при което индивидът демонстрира спастичност, хореоатетоза, възможна умствена изостаналост, повишена пикочна киселина в урината, самонараняващо се и агресивно поведение (Schroeder et al., 1991) . По-конкретно, този синдром е свързан с недостатъчна активност на ензима хипоксантин гуанин фосфорибозил трансфераза (HG-PRT). При раждането повечето индивиди с LNS показват нормално двигателно развитие, но към 6-8 месеца започват да показват признаци на прогресивна генерализирана спастична пареза и двустранна антетоза. Развиват се и неволеви мускулни движения, включително хорея, бализъм и тремор. Тежката дизартия и дисфагия също съпътстват развитието на синдрома. В допълнение, обсесивно хапане на устните структури и пръсти се случва във всички случаи на LNS. Въпреки очевидната болка, генерирана от самонараняване (възприемането на болката изглежда нормално в LNS), самоухапването продължава.
Синдром на Леш – Найхан
Въведение
Синдромът на Lesch-Nyhan (LNS) е Х-свързано генетично нарушение на метаболизма на пурините, причинено от почти пълен дефицит на ензима хипоксантин-гуанин фосфорибозилтрансфераза (HPRT).
HPRT катализира реакцията на рециклиране, при която свободните пуринови основи хипоксантин и гуанин се използват повторно, за да образуват съответните им нуклеотиди, инозинова и гуанилова киселини. Този механизъм за спасяване на пурини осигурява алтернативен и по-икономичен път към синтеза на пуринови нуклеотиди de novo. Пикочната киселина е крайният продукт на пуриновия метаболизъм. При липса на спасителния път се получават прекомерни количества пикочна киселина (Фигура 1). По този начин хиперурикемията е общата характеристика на всеки тип дефицит на HPRT.
Фигура 1 . Диаграма на пътищата на пуриновия метаболизъм. AMP, аденозин 5'-монофосфат; АТФ, аденозин трифосфат; GMP, гуанозин 5′-монофосфат; IMP, инозин 5′-монофосфат; PRPP, 5-фосфорибозил-1-пирофосфат.
Класическата болест на Lesch – Nyhan се характеризира с хиперурикемия, умствена изостаналост, самонараняващо се поведение, хореоатетоза и спастичност. Съществува обаче широка фенотипна хетерогенност в изразяването на дефицит на HPRT. Генът HPRT е разположен на дългото рамо на хромозома X (Xq26 – q27) и заболяването се среща почти изключително при мъжете.
Счита се, че честотата на LNS варира от 1 на 100 000 до 1 на 380 000. Характеризирането на молекулярния дефект в гена HPRT на редица пациенти с дефицит на HPRT разкрива хетерогенен модел на мутации, със същата промяна рядко се намира в несвързани родословия. Различни ензими с различна степен на остатъчна активност се откриват при пациенти, които нямат определени характеристики на класическото заболяване и има груба корелация между тежестта на клиничните прояви и количеството на остатъчната активност, измерена в интактни фибробласти.
Лечението с инхибитори на ксантиноксидаза, като алопуринол или фебуксостат, предотвратява повечето от последиците от свръхпроизводството на пикочна киселина, докато няма налично ефективно лечение за неврологичните или поведенческите симптоми.
Самонараняващо се поведение: Нечовешки модели на примати за човешкото състояние
Допамин
Ако SIB потенциално може да бъде произведен чрез стимулиране на свръхчувствителни или регулирани DA рецептори, тогава има основание да се каже, че антагонистите на DA рецептора трябва да могат да отслабят, ако не блокират появата на тази поведенческа патология. Понастоящем има малко доказателства за такъв ефект на DA антагонисти при синдрома на Lesch – Nyhan (Nyhan, 2000; Saito и Takashima, 2000), има значителна литература за отговорите на умствено изостанали лица/хора с увреждания в развитието на невролептични (антипсихотични ) лекарства, които обикновено блокират D2, а понякога и D1 рецепторите. Като цяло тези проучвания са открили смесени резултати с положителни отговори (т.е. намалена честота или тежест на SIB) в някои случаи, но не и в други (Baumeister et al., 1993; Schroeder et al., 1995; Clarke, 1998). Въпреки тези неубедителни констатации обаче има продължителен интерес към възможните терапевтични ползи от антагонистите на DA, особено атипични невролептици като рисперидон, оланзапин или кветиапин, които взаимодействат с допълнителни молекулярни мишени като 5-НТ2 рецептори (вж. По-късния раздел за лекарството) лечение на SIB).
- Незаразни болести - общ преглед на ScienceDirect теми
- Аденом на простатата - общ преглед на ScienceDirect теми
- Панкреатичен сок - общ преглед на ScienceDirect теми
- Rose Hip - общ преглед на ScienceDirect теми
- Паралитичен илеус - общ преглед на ScienceDirect теми