Хонг Сян
1 Колеж по интегративна медицина, Медицински университет Далиан, Далиан, Китай
2 Катедра по обща хирургия, Първа свързана болница на Медицинския университет в Далиан, Далиан, Китай
Xufeng Tao
3 Колеж по фармация, Медицински университет Далиан, Далиан, Китай
Шилин Ся
4 Клинична лаборатория по интегративна медицина, Първа свързана болница на Медицинския университет в Далиан, Далиан, Китай
Джиалин Ку
4 Клинична лаборатория по интегративна медицина, Първа свързана болница на Медицинския университет в Далиан, Далиан, Китай
Песен Huiyi
4 Клинична лаборатория по интегративна медицина, Първа свързана болница на Медицинския университет в Далиан, Далиан, Китай
Jianjun Liu
4 Клинична лаборатория по интегративна медицина, Първа свързана болница на Медицинския университет в Далиан, Далиан, Китай
Донг Шан
1 Колеж по интегративна медицина, Медицински университет Далиан, Далиан, Китай
2 Катедра по обща хирургия, Първа свързана болница на Медицинския университет в Далиан, Далиан, Китай
Резюме
Въведение
Острият панкреатит (AP) е вид стерилно възпаление на панкреаса, инициирано от дисфункция на екзокринния панкреас, което нарушава баланса между защитните ензими и стресовите сигнали (Lankisch et al., 2015). При по-голямата част от пациентите състоянието е леко и самоограничаващо се, но
20–30% от случаите в крайна сметка развиват тежко протичане с висока смъртност въпреки лечението (Bakker et al., 2014). Като бързо развиващо се състояние, тежестта на AP може да се промени бързо за изключително кратък период от време (Mentula и Leppaniemi, 2014). Настоящото управление на AP обикновено се състои от комбинирано лечение на хранителна подкрепа, аналгетици и протеазни инхибитори; за съжаление, тези терапии показват ограничена ефикасност поради липсата им на насочване (Tenner et al., 2013; Yokoe et al., 2015). Ето защо е спешно да се търсят нови диагностични и терапевтични методи за AP.
Откриването на микроРНК (miRNA) стартира изцяло нов мисловен процес по отношение на диагностиката и лечението на AP. miRNA е едноверижна некодираща РНК, която контролира експресията на по-голямата част от гените чрез разцепване или транслационна репресия (Iorio and Croce, 2009). Има нови доказателства, че променената експресия на miRNA може да доведе до промяна на основните физиологични функции, които участват в инфилтрацията на възпаление и усложняването на множество заболявания, включително AP (Hu et al., 2015; Kusnierz-Cabala et al., 2015; Maltby et al ., 2016). Следователно, ние обобщаваме взаимосвързаните взаимоотношения между miRNA и AP, за да предложим възможно диагностично и терапевтично средство за управление на това заболяване в този мини-преглед.
експресия на miRNA в панкреаса
Много miRNAs често са еволюционно консервирани и ограничени в своята експресия до определени етапи в развитието или до определени видове клетки или тъкани (Sood et al., 2006). Следователно, способността да се определя експресията на miRNA в екзокринния панкреас ще се окаже ценна за подпомагане на разбирането на предполагаемите роли, изпълнявани от miRNA в AP. Szafranska et al. съобщава, че експресията на miR-216 и miR-217 е идентифицирана като характеристика на човешката панкреасна тъкан (Szafranska et al., 2007), които са почти изключително изразени в панкреаса на плъхове (Wang et al., 2017). Тъй като нормалният панкреас се състои от
90% ацинарни клетки, лесно е да се мисли, че miR-216 (включително силно хомоложни miR-216a и miR-216b) и miR-217 са обогатени в ацинарните клетки и играят ключова роля в екзокринната функция на панкреаса (Meher et al., 2015; Rouse et al., 2017). Освен това, Kong et al. определя количествено относителната концентрация на miR-216a в тъканите на панкреаса, взети от здрави плъхове, и установява, че тя е 128 пъти по-висока от тази в бъбреците, които имат следващата най-висока концентрация, което показва, че miR-216a може да допринесе за разграничаването на панкреатичните заболявания от другите тъкани заболявания (Kong et al., 2010). Dixit et al. установи, че miR-148a-3p, miR-375-3p, miR-217-5p и miR-200a-3p са най-разпространените miRNAs в базално състояние, докато miR-421-3p, miR-24-5p и miR -29a-5p са най-малко експресирани в ацинарните клетки на панкреаса на мишка (Dixit et al., 2016). В допълнение, Let-7b и miR-495 и техните целеви гени контролират транскрипционна мрежа, която задвижва диференциацията на ацинарните клетки на панкреаса, които са от решаващо значение за осигуряване на ацинарна хомеостаза (Prevot et al., 2013). Поради тези корелации на miRNAs в регулирането на физиологичните процеси в панкреаса, разбирането на модулацията на експресията на miRNAs в AP е от решаващо значение.
Аберантни нива на експресия на miRNA при остър панкреатит
Ранното диагностициране на тежестта на AP може да идентифицира потенциален тежък риск от остър панкреатит (SAP) възможно най-рано и да осигури висока клинична стойност за подобряване на прогнозата на пациента (Lee et al., 2013). Понастоящем биомаркерите на панкреаса амилаза и липаза обикновено се използват при ранното предсказване на AP, но често са ограничени в клиничната практика поради собствените си ограничения (Treacy et al., 2001; Huang et al., 2016). Натрупващите се доказателства показват, че ненормалната експресия на miRNA, свързана с патогенезата на AP, може да служи като кандидат-биомаркер на тази диагноза и прогноза на заболяването (Kong et al., 2010; An et al., 2014; Dixit et al., 2016; Zhang et al ., 2017). Аберантните модели на експресия на miRNA при животински модели и пациенти с AP са изброени в таблица Таблица1 1 .
маса 1
Аберантни нива на експресия на miRNA при остър панкреатит.
| miR-216a ↑ | Плазма на плъх/пациенти | Kong et al., 2010; Blenkiron et al., 2014; Zhang et al., 2017 |
| miR-21-3p ↑ | Миши панкреатични ацини | Dixit et al., 2016 |
| miR-122 ↑ | Плазма на мишки | Rivkin et al., 2016 |
| miR-216a/miR-216b ↑ | Плъх плазма | Endo et al., 2013 |
| miR-216a/miR-375 ↑ | Плъх серум | Usborne et al., 2014 |
| miR-216a/miR-217 ↑ | Плъх/мишки серум | Гудуин и др., 2014; Wang et al., 2017 |
| miR-216a-5p/miR-375-3p/miR-148a-3p/miR-216b-5p/miR-141-3p ↑ | Плъх/кучешки серум | Smith et al., 2016 |
| miR-216a/miR-216b/miR-217 ↑ | Плъх/кучешки серум | Calvano et al., 2016; Rouse et al., 2017 |
| miR-375/miR-217/miR-148a/miR-216a/miR-122/miR-214/miR-138 ↑ | Плъх мезентериална лимфа | Blenkiron et al., 2014 |
| miR-126-5p/miR-148a-3p/miR-216a-5p/miR-551b-5p/miR-375 ↑ | SAP пациенти серум | Kusnierz-Cabala et al., 2015 |
| miR-216a-5p/miR-551b-5p/miR-375 ↑ | MAP пациенти серум | Kusnierz-Cabala et al., 2015 |
| miR-92b/miR-10a/miR-7 ↓ | Пациенти серум | Liu et al., 2014 |
| miR-24-3p/miR-361-5p/miR-1246/miR-222-3p ↑ miR-181a-5p ↓ | Серум за пациенти с HTAP | An et al., 2014 |
Животни
Пациенти
Поради специфичността и чувствителността на miRNA при регулирането на процеса на AP, тя е по-добра от конвенционалните биомаркери с лоша тъканна и клетъчна специфичност (Beuvink et al., 2007; Tombol et al., 2009). Въпреки това, общоприето е, че РНК се разгражда лесно, когато се изолира от богати на RNase проби от тъкани, като панкреаса, Kim et al. вярва, че разграждането на РНК поради продължително съхранение при стайна температура не оказва влияние върху предсказуемата сила на тъканно специфичния miRNA количествена обратна транскрипция полимеразна верижна реакция (QRTPCR) предиктор (Kim et al., 2011). Освен това, няколко miRNAs са в състояние да издържат на различни сурови среди, като многократно замразяване и размразяване или силно киселинни или основни среди с екстремно рН (Machado et al., 2015). В сравнение с други биомаркери, експресията на miRNA е стабилна в телесните течности, особено в кръвния поток, генерирайки интерес към използването на miRNA като серумни и/или плазмени биомаркери за диагностика на AP и стратификация на пациента (Mitchell et al., 2008; Kong и др., 2010; Liu и сътр., 2014). Въпреки това, различни miRNAs са необичайно представени в болестното състояние на AP; по този начин трябва да се създаде подробен miRNA профил, който също се отнася до други диагностични методи, за да се избегне погрешно тълкуване.
miRNA, регулираща острата експресия на гена, свързана с панкреатрис
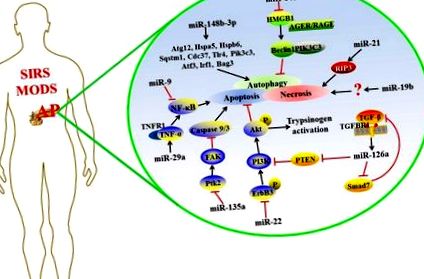
Наскоро бяха открити някои miRNAs, които регулират експресията на целеви гени в сложен AP и подробният механизъм е показан на Фигура Фигура 1 1 .
Възможните механизми на miRNAs, регулиращи експресията на мишена в сложен AP.
Апоптоза/некроза
Апоптозата и некрозата са двата основни модела на смърт на ацинарните клетки на панкреаса по време на AP и те могат да се обменят помежду си при подходящи условия (Bhatia, 2004; Mareninova et al., 2006). Апоптозата поддържа целостта на мембраната, без да стимулира имунната система, докато некротичните клетки освобождават свързани с увреждане молекулни молекули (DAMP), които предизвикват възпалителна каскада (Bhatia, 2004).
Скоростта на некроза на ацинарните клетки на панкреаса и следващото възпаление корелират със смъртността на пациенти с остър некротизиращ панкреатит (ANP) (Xu et al., 2015). Нарастващите изследвания демонстрират функцията на miRNAs при панкреатична ацинарна некроза на клетките, което показва, че miRNA може да бъде потенциална цел за разработване на лекарства срещу AP (Ma et al., 2015; Hu et al., 2016). Повишената експресия на miR-19b в ANP плъхове или третирани с тауролитохолова киселина 3-сулфатна динатриева сол (TLC-S) AR42J клетки, може да насърчи клетъчната некроза; в противен случай изтриването на miR-19b може да намали степента на некроза (Hu et al., 2016). Ma et al. докладват, че miR-21 е свръхекспресиран в миши модел на AP; инхибирането на miR-21 предпазва от индуциран от церулеин или L-аргинин AP и ефективно намалява тежестта на заболяването. Освен това, заглушаването на експресията на miR-21 е защитно при TNF-индуцирани SIRS. MiR-21 насърчава TNF-α-индуцирана некроптоза, патологично състояние, включващо взаимодействащ с рецептора протеин 3 (RIP3) -регулирана некроза (Ma et al., 2015). RIP3 е компонент на некрозомата, който може да бъде директно разцепен и инактивиран от каспаза 8, за да регулира отрицателно некроптозата, индуцирана от TNF-α (Kaiser et al., 2011). По този начин, miRNAs критично участват в процесите на апоптоза и/или некроза на AP.
Автофагия
Автофагията е форма на програмирана клетъчна смърт в еволюционния процес и основната й функция е лизозомно саморазграждане на собствените компоненти на клетката в отговор на външни стимули (Jones et al., 2013; Vernon and Tang, 2013). Много проучвания показват, че автофагията участва в прогресията на AP, но нейната функция в хода на AP все още е противоречива. Предишни проучвания съобщават, че селективната автофагия играе цитопротективна роля, като елиминира излишното активиране на зимоген и намалява смъртта на панкреатичните клетки, индуцирана от трипсин в началото на AP (Grasso et al., 2011). Друго противоположно мнение е, че автофагията допринася за образуването на ацинарни клетъчни вакуоли и за активирането на трипсиногена като основен механизъм, лежащ в основата на патогенезата на AP (Gukovsky et al., 2012).
Път на обратна връзка на TGF-β
Трансформиращият растежен фактор-β (TGF-β) е многофункционален цитокин, който участва в различни биологични процеси, включително клетъчна апоптоза и регулиране на имунната система (Mikami et al., 2006). Съобщава се, че TGF-β и неговите рецептори се регулират нагоре при пациенти с AP (Friess et al., 1998; Wildi et al., 2007). Експресията на miR-216a се увеличава по дозозависим начин в AR42J клетки след TGF-β стимулация. Междувременно, TGF-β инхибиторът SB431542 може да намали експресията на miR-216a в панкреатичната тъкан и серума в индуцирания от cerulean модел AP мишка. TGF-β влошава AP чрез регулиращ нагоре miR-216a, който е насочен към PTEN и Smad7 (Zhang et al., 2015). PTEN е супресор на сигналния път PI3K/Akt, свързан с клетъчната апоптоза (Blanco-Aparicio et al., 2007). Smad7 блокира сигналния път на TGF-β през цикъл с отрицателна обратна връзка и също така действа като кръстосан посредник между TGF-β сигнализиране и други (Yan и Chen, 2011). Следователно, сигналната пътека TGF-β/miR-216a регулира множество биологични процеси в AP.
NF-κB сигнален път
Мезенхимните стволови клетки (MSCs) принадлежат към семейството на стволовите клетки и са широко използвани като средство за доставяне на ген за доставяне на екзогенни гени до увредени тъкани за терапевтична стратегия на базата на клетки (Si et al., 2011). MiR-9 е ключова паракринна молекула на мезенхимни стволови клетки, получени от костен мозък (BMSC) и неговото регулиране може да инхибира възпалителния отговор, индуциран от липополизахарид (LPS) в човешки полиморфно-ядрени неутрофили (PMN) и мононуклеарни клетки от периферна кръв (PBMC) (Bazzoni et al., 2009). Qian et al. установи, че miR-9-модифицираните BMSC (pri-miR-9-BMSC) значително намаляват увреждането на панкреаса и дейностите на серумна амилаза и липаза при AP плъхове. Междувременно се наблюдава и намалено отделяне на възпалителни фактори и засилена регенерация на некротизираните панкреатични тъкани. Тези резултати показват, че miR-9 може да е противовъзпалителен фактор, участващ в прогресията на AP. BMSCs доставят miR-9 на увредения панкреас или PBMC, което може да отслаби насочването на SAP на гена NF-κB1/p50 (Qian et al., 2017).
Когато настъпи AP, увредените панкреатични клетки освобождават провъзпалителни медиатори, за да стимулират макрофагите в панкреаса, перитонеума и други тъкани (Gutierrez et al., 2008). Активираните макрофаги секретират различни възпалителни цитокини, което води до разпространение на възпалението (Jaffray et al., 2000; Ni et al., 2014). Следователно терапиите на клетъчно ниво, насочени към макрофагите, могат да постигнат ценен пробив в лечението на AP. Открито е, че междуклетъчната комуникация играе съществена роля в активирането на свързаните с панкреатит макрофаги (Lundberg et al., 2000). Смята се, че miRNA е медиатор на междуклетъчната комуникация, който се транспортира до клетките реципиенти, за да регулира техните функции (Chevillet et al., 2014). Наскоро резултатите от изследванията на Zhao et al. Показаха, че активираните AR42J клетки усилват NF-κB активирането в макрофагите чрез секретиране на екзозоми, носещи диференциално експресирани miRNAs (Zhao et al., 2016) Тези изследвания показват, че miRNA изглежда регулира NF-кВ промотираните възпалителни отговори в AP.
miRNA като потенциално терапевтично средство
miRNA играят ключови роли в регулацията на генната експресия; по този начин манипулирането на miRNA функцията in vitro и in vivo е потенциална терапия на генетично ниво за модулиране на патогенезата на заболяването. Откриването на miRNA инхибитори (напр. Анти-miRNAs и miRNA гъби) или подобрители (имитатори) пречат на miRNA, увеличавайки или инхибирайки транслацията на miRNA-насочени mRNAs, като по този начин модифицират нивата на експресия на протеини и значително тласкат напред развитието на нови лекарства (Ebert и др., 2007; Lennox и Behlke, 2011; Robb et al., 2017). Понастоящем основното ограничение за експлоатацията на miRNAs като терапии е вероятността от нежелани странични ефекти поради техните биологични свойства, при които отделните miRNAs модулират множество цели надолу по веригата, а намесата в единични miRNAs може да има широко въздействие върху множество клетъчни пътища едновременно и потенциално да компенсира желаните терапевтични ефекти, особено когато се използва системно доставяне на лекарства (Baker, 2010). Следователно, при бъдещи изследвания са необходими персонализирана miRNA терапия за поддържане на други функции без смущения и оптимизиране на системите за доставка на лекарства.
Заключение
В този мини-преглед обсъдихме обещаващата роля на miRNAs при разработването на по-ефективни терапии за AP, освен че действат като потенциални диагностични инструменти. Въпреки че някои miRNAs са открити, за да демонстрират пряка или непряка връзка с прогресията на AP, разследванията за прилагане на miRNA при лечение на AP остават на етапа на развитие. Тези основни изследвания могат да предоставят голям брой ценна информация за клиничното популяризиране на miRNA-диагностично приложение и бъдещото развитие на AP-лечението.
Авторски приноси
HX, XT, SX, JQ, HS, JL и DS са написали ръкописа.
Изявление за конфликт на интереси
Авторите декларират, че изследването е проведено при липса на каквито и да било търговски или финансови отношения, които биха могли да се тълкуват като потенциален конфликт на интереси.
- Функция на щитовидната жлеза при остър панкреатит - PubMed
- Ролята на червата в патофизиологията и лечението на тежък остър панкреатит -
- Преразгледано лечение и фактори, влияещи върху прогнозата на тежкия остър панкреатит
- Какви са симптомите на остър панкреатит
- Каква диета е подходяща за остър идиопатичен панкреатит с псевдокиста