Катедра по неврология и неврология, Медицинско училище в Ню Джърси, UMDNJ, Нюарк, Ню Джърси, САЩ
Катедра по неврология и неврология, Медицинско училище в Ню Джърси, UMDNJ, Нюарк, Ню Джърси, САЩ
Катедра по неврология и неврология, Медицинско училище в Ню Джърси, UMDNJ, Нюарк, Ню Джърси, САЩ
Катедра по неврология и неврология, Медицинско училище в Ню Джърси, UMDNJ, Нюарк, Ню Джърси, САЩ
Резюме
J. Neurochem. (2011) 116, 714–720.
Резюме
Използвани съкращения:
Ганглиозидите, съдържащи сиалова киселина подгрупа на гликосфинголипидите, са добре установени съставки на ядрената обвивка (NE), чиято функция в този локус постепенно придобива разбиране. Липидите като цяло съставляват относително малка част от ядрото (∼ 5 тегловни%), което може да се дължи на ограничената надеждност, която първоначално дава предположението, че тяхната функция може да надхвърли тази на структурната опора. Работата на много лаборатории през последните години установи каква е добре познатата днес роля на липидите като основни сигнални субстрати в ядрото, както е обобщено в последните рецензии (Tamiya-Koizumi 2002; Irvine 2003; Albi and Viola Magni 2004; Ledeen and Wu 2006). Показано е, че основната роля на GM1, основен ганглиозид на NE, се концентрира върху регулирането на Ca 2+ чрез потенциране на Na +/Ca 2+ обменник (NCX) по начин, който засяга цитозолния Ca 2+, както и този в СИ и нуклеоплазмата (за преглед: Ledeen and Wu 2007). Показано е, че GD1a, друг основен ганглиозид на NE, функционира като предшественик на GM1 чрез реакция с мембранно свързана невраминидаза (N’ase), която съществува едновременно с ганглиозидите в NE (Wang и др. 2009). Този преглед ще се опита да обобщи тези констатации и да ги разгледа в по-широкия контекст на цитопротективните механизми, предоставени от тези ядрени съставки.
Ганглиозиди и невраминидаза на ядрото
Другият основен ганглиозид, разкрит в тези проучвания на NE, е GD1a, реагиращ на невраминидаза прекурсор на GM1, който всъщност е по-обилен от последния. Основна функция на GD1a изглежда е тази на резервния прекурсор за GM1, като това превръщане се катализира от ензима N’ase (сиалидаза), както е показано и в NE (Saito и др. 1996). По-нататъшно проучване демонстрира присъствието на N’ase и в двете мембрани на NE, изоформата на Neu3 се появява във вътрешната и Neu1 във външната мембрана на обвивката (Wang и др. 2009) (Фиг. 1). Тези открития са улеснени от разделянето на двете мембрани съгласно процедурата на Gilchrist и Pierce (1993), която в нашите ръце дава разумно чисти препарати на вътрешната и външната мембрани. Neu3 е изоформата, за която е доказано, че се появява в плазмената мембрана и реагира специфично на ганглиозидите (Miyagi и др. 1999; Монти и др. 2000), докато Neu1 първоначално е идентифициран като лизозомен по произход и впоследствие е доказано, че се среща и в плазмената мембрана (Liang и др. 2006); той проявява активност както към ганглиозидите, така и към гликопротеините (Pshezhetsky and Ashmarina 2001). Нашето проучване показа, че N’ase и на двете места е способен да катализира превръщането на GD1a в GM1 (Wang и др. 2009). Тези резултати предполагат ориентацията за Neu1 и Neu3, посочена на фиг. 2.
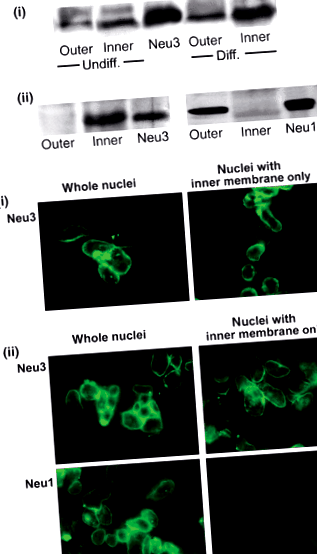
Идентифициране на изоформите на невраминидаза в ядрената обвивка. а) анализ на Western blot. Панел (i), Външна и вътрешна NE мембрани от диференцирани (Diff.) И недиференцирани (Undiff.) NG108‐15 клетки бяха подложени на имуноблот анализ с антимиши Neu3 Ab. Показан е стандартът Neu3. Оцветяването с Neu3 е значително по-тежко във вътрешната в сравнение с външната мембрана и в пробите от диференцирани в сравнение с недиференцирани ядра. Панел (ii), NE мембрани от недиференцирани SH-SY5Y клетки бяха подложени, както по-горе, на имуноблот анализ с анти-човешки Neu3 и Neu1. Показани са стандартите Neu3 и Neu1. Резултатите показват, че Neu3 се експресира във вътрешната и Neu1 във външната мембрана на NE на SH-SY5Y клетките. (б) Имуноцитохимичен анализ. Ядрата, изолирани от диференцирани клетки NG108-15 (панел i) и недиференцирани ядра SH-SY5Y (панел ii), третирани или необработени с цитрат за отстраняване на ONM, бяха подложени на оцветяване с античовешки Neu3 и Neu1 Abs, последвани от подходящи 2-ри Abs свързан с FITC. В съгласие с Western blot анализа, тези резултати показват Neu3 в INM и Neu1 в ONM. Препечатано с разрешение от Уанг и др. (2009) с разрешение от J. Neurochem.
Предложена топология на GM1, невраминидаза (Neu1, Neu3) и Na +/Ca 2+ обменник (NCX) в ядрената обвивка (NE, a) и плазмената мембрана (PM, b). И в двата случая голямата верига между трансмембранните звена 5 и 6 е разположена от ниската страна на Са 2+, т.е. цитоплазма за РМ и нуклеоплазма за NE. Това е в съответствие с демонстрираното местоположение на GM1 и NCX във вътрешната мембрана на NE (INM) и появата на голямата NCX верига в близост до GM1 олигозахаридна верига. Предложихме, че асоциацията с висок афинитет на GM1 с NCX произтича от отрицателния заряд на н‐Ацетилнеураминова киселина в GM1, взаимодействаща с алтернативната сплайсинг област (ASR) на NCX контура, някои от чиито изоформи са обогатени с положително заредени аминокиселини. Такова свързване не е възможно за РМ, тъй като NCX контурът и GM1 олигозахаридът се срещат от противоположните страни на мембраната. Neu1 е разположен във външната ядрена мембрана (ONM) и Neu3 в INM. Известно е, че PM съдържа Neu3, но само понякога Neu1. Възпроизведено частично от Ledeen and Wu (2007) с разрешение от J. Neurochem.
По отношение на ендонуклеарните домейни, хетерохроматинът в епителните клетки на мишки показва доказателства за наличие на GM1, както се установява чрез свързване както на CtxB, така и на анти-GM1 Ab (Паркинсон и др. 1989). Предполага се, че GD3 се появява и в хетерохроматин въз основа на имуноцитохимично изследване на кортикални неврони на плъхове, подложени на β-амилоиден пептид (Copani и др. 2002). Тази относително неизследвана област очевидно се нуждае от систематично проучване.
GM1 взаимодействие с Na +/Ca 2+ обменник
Основна улика относно функцията на GM1 в СИ излезе наяве с откритието, че този ганглиозид се среща в много тясна връзка с Na +/Ca 2+ обменник (NCX) (Xie и др. 2002). Тази асоциация с висок афинитет беше демонстрирана чрез имунопреципитация на NE екстракт с анти-NCX Ab, последван от имуноблот анализ, който показа, че GM1 остава свързан с NCX по време на електрофореза с натриев додецил сулфат-полиакриламиден гел. Тази процедура обикновено дисоциира липидите от протеини с редки изключения, като свързване на GM1 с нервния растежен фактор (Mutoh и др. 1995). NCX изоформите на NE очевидно се различават от тези в плазмената мембрана по това, че никоя от последните не остава свързана с GM1. Предложените резултати обаче GM1 може да са по-свободно свързани с една или повече NCX изоформи в този локус. Описано е съществуването на базирани на снаждане изоформи на NCX (Kofuji и др. 1994; Той и др. 1998).
Потенцирането на активността на NCX чрез асоцииране с GM1 беше показано чрез експерименти за поглъщане на 45 Ca 2+ с изолирани ядра, трансфер на изотоп, възникващ от нуклеоплазма към NE (Xie и др. 2002). Това беше показано при сравняване на стабилна NCX активност в ядра от диференцирани клетки NG108-15 (високо NE GM1) с мудна активност в ядра от недиференцирани клетки (малко или никакво NE GM1). Прехвърлянето на 45 Ca 2+ от нуклеоплазмата към NE лумена предполага местоположението на комплекса NCX/GM1 във вътрешната мембрана на NE и това е потвърдено чрез имуноблот анализ на отделените мембрани. Тъй като преносът на Ca 2+ чрез NCX се управлява от Na + градиент, Na + беше повишен в NE в горното инвитро експерименти чрез предварително инкубиране на ядрата в съдържаща Na + среда с подходящи йонофори. Предполага се, че такъв трансфер се осъществява естествено чрез Na +/K + -ATPase, за което е доказано, че се случва във вътрешната мембрана на NE, процес, който създава висока интралуминална концентрация на Na + (Garner 2002).
Обменникът Na +/Ca 2+ в плазмената мембрана посредничи за противотранспорт на три Na + за един Ca 2+, като същевременно насърчава екструзия нагоре по цитозолния Ca 2+. Едно топологично изискване на този „напред“ начин на обмен е, че големият полипептиден контур между трансмембранните сегменти 5 и 6 се намира на ниската Са 2+ (цитозолна) страна на мембраната (Philipson and Nicoll 2000). Приемайки същото изискване за NCX на NE, този пептиден контур ще се простира в нуклеоплазмата, за да улесни пренасянето нагоре на нуклеоплазмен Ca 2+ през вътрешната ядрена мембрана към концентрирания Ca 2+ басейн в лумена на NE. Това би довело до значителна разлика в ориентацията на GM1, като GM1 олигозахаридната верига и NCX веригата са от противоположните страни на плазмената мембрана, но от същата страна на вътрешната NE мембрана (фиг. 2). Тази топология би позволила отрицателният заряд на GM1 сиалова киселина да взаимодейства с положително заредени аминокиселини (и), за които е доказано, че се появяват в алтернативно сплайсираната област на някои изоформи на този NCX контур (He и др. 1998). Такова взаимодействие заряд-заряд, препоръчано експериментално да се случи в СИ (Xie и др. 2004a), не е възможно в плазмената мембрана.
Ядреният NCX/GM1 медиира трансфера на Ca 2+ от цитозола в ендоплазмен ретикулум
Сравнение на влизането на Ca 2+ във вътреклетъчните отделения, което зависи от GM1 и NCX в NE. Отстраняването на NE/ER Ca 2+ с тапсигаргин е последвано от добавяне на Ca 2+. Клетките NG108-15 (експресиращи GM1) показват значително повече навлизане на Ca 2+ в NE/ER, отколкото клетките NG-CR72 (дефицит на GM1) (a-i срещу a-ii). Клетките C6 (експресиращи NCX в NE) изпитват стабилно влизане на Ca 2+ в NE/ER (b-i) за разлика от клетките Jurkat (без експресия на NCX), които не показват влизане на Ca 2+ в NE/ER (c-i). Влизането на Ca 2+ в нуклеоплазмата е сходно за клетките C6 (b-ii) и Jurkat (c-ii), както важи и за навлизането на Ca 2+ в цитозола (b-iii, c-iii); KB-R7943 (KB, NCX инхибитор) имаше умерен ефект върху нуклеоплазмата и цитозола на C6-, но няма ефект върху клетките Jurkat. KB имаше основен ефект върху навлизането на Ca 2+ в NE/ER на NG108‐15 (a-i) и малък ефект при NG-CR72 клетки (b-i). Получени са серийни изображения с ER-камелеон-експресиращи клетки NG108‐15 след приложение на тапсигаргин на 50 s, което води до изчерпване на [Ca 2+] ne/er (d). Добавянето на CaCl2/KCl за 550 s предизвика повишаване на [Ca 2+] ne/er, възникнало в перинуклеарния (NE) регион (върховете на стрелките при 592,8 s изображение с *) и след това разширено до цялото NE/ER. Това беше последвано от постепенно Tg-индуцирано изчерпване. Адаптирано от Ву и др. (2009) с разрешение от Proc. Natl Акад. Sci. САЩ.
Ядрената NCX/GM1 осигурява цитозащита
Понастоящем ганглиозидите се разпознават като повсеместни компоненти на почти всички гръбначни и някои безгръбначни клетки с множество регулаторни и сигнални функции в мембраната и в клетката (Yu и Saito 1989; Ledeen и др. 1998; Хакомори 2001). Що се отнася до разпространението на ядрения NCX/GM1, повечето от изследваните към момента клетъчни типове притежават този комплекс, дори в клетки (напр. С6), които не съдържат NCX в плазмената мембрана (Xie и др. 2004а, б). Основното изключение, което наблюдаваме до момента, са първичните или производни клетки на имунната система, включително Jurkat и подгрупа от човешки Т клетки (Xie и др. 2004а). Фактът, че някои клетки не притежават този цитопротективен механизъм, предполага, че те могат да бъдат предназначени за елиминиране в подходящо време в полза на организма. По този начин присъствието, както и отсъствието на ядрен NCX/GM1 изглежда оказват критично влияние върху поведението и оцеляването на клетките.
Бъдещи перспективи
Признание
Тази работа беше подкрепена от Националните здравни институти: 2 RO1 NS033912.
- Физиология на затлъстяването и ефекти върху белодробната функция Journal of Applied Physiology
- Следродилен ден 2 до 11 представлява 5-HT-чувствителен период, въздействащ на възрастни mPFC Функционален вестник на
- Растително хранене Ползите от почистването на вашия диетичен йога вестник
- Алгоритъм за диагностика и лечение на затлъстяването Британска Колумбия Medical Journal
- Мускулна диастаза - общ преглед на ScienceDirect теми